杜泊羊冷冻胚胎移植效果的影响因素及羔羊早期生长性能研究
2021-07-17冷学义肖发沂徐相亭
张 菊,亓 鹏,冷学义,肖发沂*,徐相亭*
(1.山东畜牧兽医职业学院,山东潍坊 261061;2.潍坊三农伟业饲料科技有限公司,山东潍坊 262113)
杜泊绵羊(简称杜泊羊,Dorper sheep)原产南非,有黑头杜泊羊和白头杜泊羊2 个类型,可以生产出世界公认的“钻石级”羊肉,被誉为“南非国宝”[1]。优秀的杜泊羊被引入澳大利亚后,经过更加系统地选种和育种,其生产性能得到进一步提升[2-3]。潍坊普兰特汉种羊有限公司从澳大利亚南部珀斯Plantagenet Dorper 种羊场引进新鲜冷冻胚胎,通过对受体羊(湖羊和小尾寒羊)进行同期发情处理[4-6],将胚胎移植至受体羊的子宫角部位,经受体羊妊娠分娩后获得纯种黑头杜泊羊。
近期,胚胎移植技术在国内发展比较迅速,但成功率与国外存在一定差距。影响胚胎移植效果的因素很多,目前的研究多集中在胚胎、受体以及胚胎与受体的相互作用3 个方面,其中胚胎质量的优劣和胚胎发育阶段是影响胚胎移植成功率的重要因素,另外受体因素对移植成功率也有很大影响,包括同期发情方法、发情状况、外源性激素使用情况以及受体的年龄和季节等[7]。本研究从冷冻胚胎的发育阶段、受体羊同期发情的季节、受体品种、卵巢上不同黄体的个数、受体羊的营养状况、移植胚胎的数量分析其对胚胎移植效果的影响,并测定羔羊早期生长性能,旨在为杜泊羊胚胎移植的推广和应用提供参考。
1 材料与方法
1.1 实验动物及饲养管理 纯种黑头杜泊羊冷冻胚胎均购自澳大利亚,种源具有四代系谱,基因纯正优良。受体羊为小尾寒羊和湖羊,健康无传染性疾病,无繁殖性疾病。小尾寒羊和湖羊为1.5~3 岁,膘情适中。2016年4 月进行第1 批500 枚质量合格的冷冻胚胎的移植,选择小尾寒羊180 只、湖羊270 只作为受体羊进行同期发情。2016 年11 月进行第2 批861 枚质量合格冷冻胚胎的移植,选择受体羊湖羊700 只进行同期发情。试验在潍坊普兰特汉种羊有限公司养殖场进行。羊饲料以玉米青贮饲料、花生秧、干苜蓿、胡萝卜为主,自由饮水,羊圈悬挂矿物质添砖。
1.2 实验药品 羊用孕酮阴道栓(CΙDR,Zoetis Ιnc.,新西兰生产),含孕酮0.3 g/支;孕马血清促性腺激素(PMSG,宁波第二激素厂),规格1 000 ΙU/支。
1.3 同期发情 受体羊放入 CΙDR(记为第0 天),在同期发情后第 14 天取出CΙDR 栓,注射PMSG 500 ΙU。第15 天进行公羊试情,第17~18 天结束试请。对发情正常的受体母羊进行胚胎移植。
1.4 胚胎移植
1.4.1 胚胎解冻 镊子取出冻胚管,放入30℃的水浴锅解胚(时间约20 s),记录,剪头,用推针推至培养皿中,查看胚胎个数与质量,解冻后的胚胎通过体视显微镜观察分为3 个级别,优良胚胎和普通胚胎可以进行移植。将质量合格的胚胎放入配好的营养液中,激活约18 min,40×显微镜下取胚胎,放入注射器内。
优良胚胎:胚胎的形态典型,分裂球的轮廓清晰,细胞质致密,大小、色泽均匀,透明带完整。
普通胚胎:与典型的胚胎相比,稍有变形,但分裂球的轮廓清晰,细胞质较致密,分布均匀,透明带完整。
不良胚胎:形态有明显变异,卵裂球排列松散,轮廓不清晰或者部分不清晰,细胞质不致密,分布不均匀,色泽发暗,有的破裂呈沙粒样,有碎片;透明带不完整。
1.4.2 胚胎移植 对受体羊进行麻醉,腹部刮毛,消毒。左侧乳上10 cm 插入内视镜,右侧对应位置切升皮肤2 cm,刀尖深入切开1 cm 将持宫钳深入,夹出子宫角(有黄体),用0.9%的灭菌生理盐水冲洗,针刺入子宫角,将解冻好的胚胎注入子宫内冲洗后,放入腹腔。用一次性金属缝合夹,将伤口夹好,10 d 后金属缝合夹自动脱落。用碘酊消毒伤口(如有出血,止血后夹好消毒)。并进行胚胎移植后的记录。最后在受体羊在腿部肌肉部位注射抗生素。
在胚胎移植后 30~35 d,进行公羊试情法或超声波(B 超)检测,进行妊娠诊断。
1.5 杜泊羊冷冻胚胎移植效果的影响因素 2016 年4 月(春季)和2016 年11 月(秋季),对湖羊进行同期发情和胚胎移植,同期发情处理前两个月对受体羊进行补饲,比较季节对同期发情和胚胎移植效果的影响。2016年4 月,研究受体羊的品种(小尾寒羊和湖羊)、卵巢上不同黄体的个数(1 个、2~3 个)和受体羊的营养状况(中上等膘情、下等膘情)对胚胎移植效果的影响。参照国际肉羊评分系统,根据体型外貌、体重、年龄等指标,对小尾寒羊和湖羊进行总分为5 分的评定打分。最佳是5 分,优良是4 分,普通是3 分,较差是2 分,最差是1 分。5~4 分属于中上等膘情,3~2 分是下等膘情,1 分不能作为受体羊。根据冷冻胚胎档案中对胚胎胚龄的描述,分为桑椹胚、晚期桑椹胚、早期囊胚、囊胚和扩张囊胚,观察解冻后5 个不同胚胎发育阶段对移植后妊娠率的影响。根据受体羊的膘情,移入2 枚或1 枚胚胎,统计移植胚胎的数量对妊娠率的影响。
1.6 羔羊早期生长性能的测定 母羊临近生产,做好分娩准备工作。羔羊出生后,迅速去除其口、鼻、耳中的黏液,让母羊舔净羔羊身上的黏液,称测出生重,打耳标并做好记录。羔羊采取随母哺乳,在羔羊生长至1 月龄、2 月龄和3 月龄时称重。3 月龄断奶后,采取全舍饲。饲养管理按常规标准方法进行。按口蹄疫、羊痘、支原体等疫苗的免疫接种程序接种,定期驱虫。
1.7 统计分析 试验数据经Excel 2010 软件整理后,采用t检验,使用SPSS 20.0 软件进行数据分析。P>0.05表示差异不显著,P<0.05 表示差异显著。
2 结果
2.1 不同季节对受体羊的同期发情和胚胎移植的影响如表1 所示,2016 年11 月供体羊湖羊的发情率高于4月湖羊(P<0.05),11 月和4 月的妊娠率分别为61.7%和61.8%(P>0.05)。
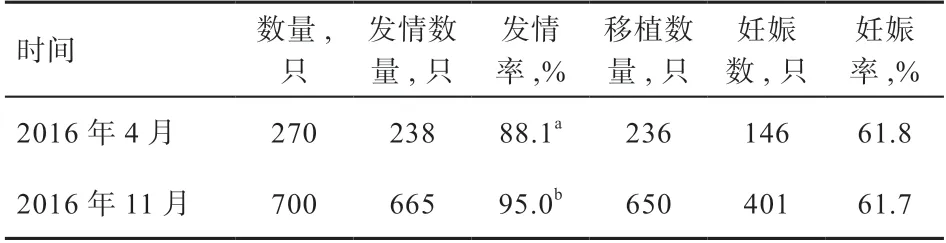
表1 不同季节受体羊的同期发情和胚胎移植效果
2.2 不同品种受体羊的同期发情和胚胎移植的效果 由表2 可知,湖羊和小尾寒羊的同期发情率分别为88.1%和90.6%,妊娠率分别为61.8%和60.6%(P>0.05)。
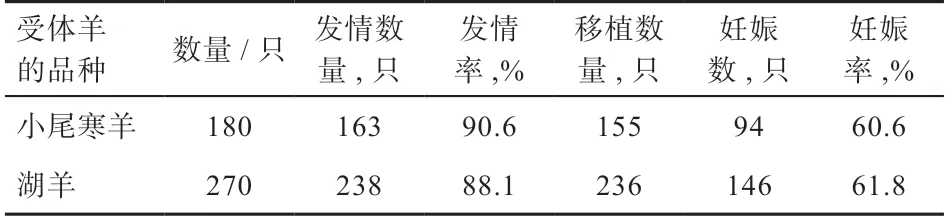
表2 湖羊和小尾寒羊同期发情和胚胎移植的效果
2.3 卵巢不同黄体个数对妊娠率的影响 由表3 可知,小尾寒羊双侧卵巢上有1 个黄体的移植后妊娠率为61.2%,有2~3 个黄体的移植后妊娠率为59.6%(P>0.05);湖羊双侧卵巢上有1 个黄体的移植后妊娠率为62.0%,有2~3 个黄体的移植后妊娠率为61.6%(P>0.05)。
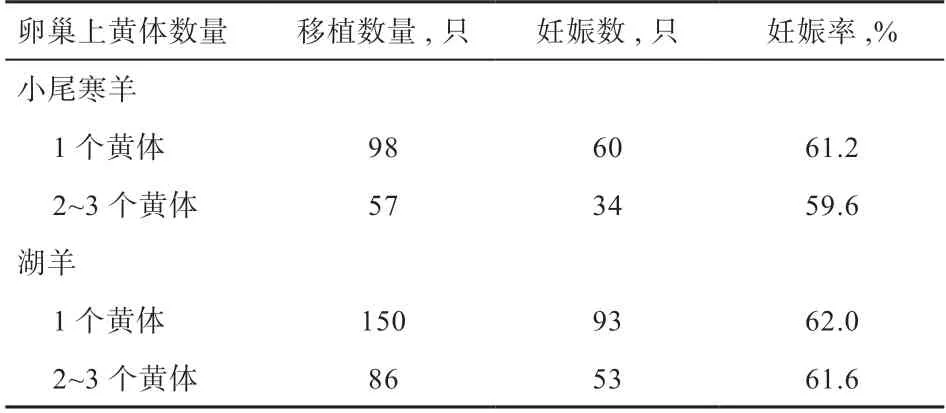
表3 不同黄体个数对妊娠率的影响
2.4 受体羊营养状况对胚胎移植效果的影响 如表4 所示,小尾寒羊和湖羊的营养状况均对妊娠率有显著影响,中上等膘情小尾寒羊和湖羊移植后的妊娠率均显著高于下等膘情。

表4 受体羊营养状况对妊娠率的影响
2.5 胚胎发育阶段对妊娠率的影响 如表5 所示,移植扩张囊胚的受体羊妊娠率为30.0%,显著低于其他4 个胚胎发育阶段,其他4 个胚胎发育阶段的妊娠率差异不显著。

表5 胚胎发育阶段对妊娠率的影响
2.6 移植胚胎数对妊娠率的影响 由表6 可见,2016 年4 月,小尾寒羊组移植200 枚冷冻胚胎,其中110 只小尾寒羊移入单胚,妊娠率61.8%;45 只小尾寒羊移入双胚,妊娠率57.8%(P>0.05);剩下的300 枚冷冻胚胎,172 只湖羊移入单胚,妊娠率64.0%;64 只湖羊移入双胚,妊娠率56.3%,两者差异显著。2015 年11 月,湖羊组移植861 枚冷冻胚胎,439 只湖羊移入单胚,妊娠率63.1%;211 只湖羊移入双胚,妊娠率58.8%,两者差异不显著。对以上数据分析发现,移植双胚的妊娠率低于移植单胚妊娠率。

表6 单胚和双胚移植情况统计
2.7 羔羊早期生长发育情况 如表7 所示,小尾寒羊作为受体羊和湖羊作为受体羊所产的羔羊,出生重及1、2、3 月龄体重均没有显著性差异,但是小尾寒羊所产羔羊各阶段体重均高于湖羊所产羔羊。小尾寒羊和湖羊所产羔羊的早期体重和成活率与澳大利亚提供的羔羊生长数据基本一致。
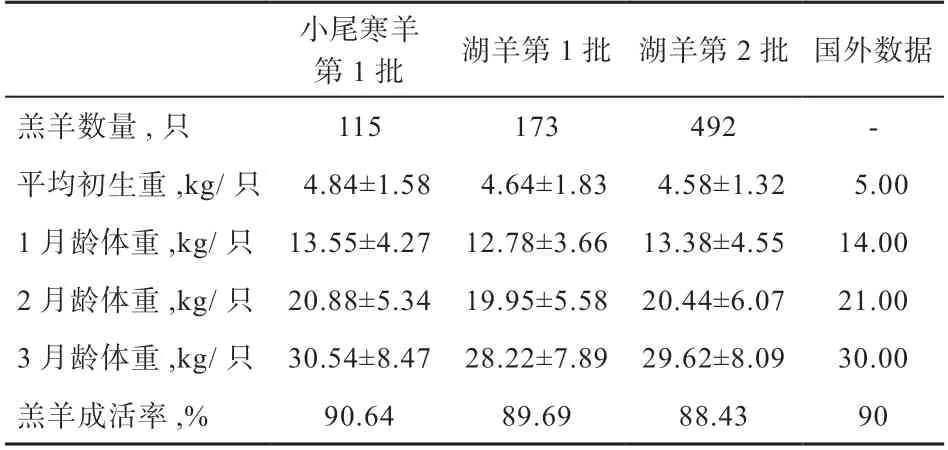
表7 羔羊早期生长发育情况
3 讨论
肉羊胚胎移植效果在不同地区差异较大,主要受胚胎、受体和胚胎与受体的相互作用的影响[8]。本实验中所使用的受体羊都是1.5~3 岁的小尾寒羊和湖羊,经统一饲养与管理,在一定程度上排除了外界环境对受体羊的影响。
季节对受体羊的同期发情率有影响。绵羊是短日照季节性多次发情的家畜,发情季节为 9~11 月[4]。本研究发现11 月同期发情率明显高于4 月,但11 月与4 月的妊娠率没有明显差异[9-13]。4 月的同期发情率低,说明一部分绵羊对外源激素不够敏感。但能够正常发情的绵羊就是能够正常排卵的受体羊,在促乳素、雌激素和孕激素等作用下,受体羊的子宫已经为胚胎附植做好了准备,因此妊娠率没有明显差异。另外,研究表明秋季和冬季进行同期发情和胚胎移植有一定优势[14],需要结合羊场具体的生产安排选择合适的季节进行胚胎移植。
湖羊和小尾寒羊均属于我国优良地方品种,两者的同期发情率和妊娠率没有显著性差异,均可作为胚胎移植的受体羊。湖羊母羊的成年体重在40 kg 以上,小尾寒羊母羊的成年体重在50 kg 以上。湖羊每日的饲喂量少于小尾寒羊,因此,湖羊作为受体羊在一定程度上可以节约饲料成本。
绵羊受体血浆中的孕激素浓度与黄体的数量和大小有关,在妊娠初期孕激素有利于胚泡附植[5]。本研究中,受体羊卵巢上的黄体个数对移植胚胎的存活率没有显著性影响[14-15]。受体羊进行胚胎移植后,孕酮会降低子宫肌的兴奋性,刺激子宫分泌子宫乳,移植母体对胎儿抗原的免疫反应等,有助于胚胎附植。孕激素水平达到妊娠所需的阈值就可以满足胚泡附植,继而维持妊娠,研究孕激素何时升高到阈值水平有利于把握胚胎移植的最佳时机[16]。
胚胎移植后的妊娠率与受体羊的膘情有直接联系。当受体羊的膘情良好时,大部分胚胎着床以后都能继续发育并顺利生长。膘情中上等的小尾寒羊和湖羊胚胎移植后的妊娠率高,所以在进行胚胎移植前后,加强受体羊的饲养管理非常重要[15,17]。
冷冻胚胎移植后的成功率受很多因素影响,胚龄是非常重要的影响因素[21]。本研究结果发现,移植扩张囊胚的受体羊妊娠率为30.0%,显著低于其他4 个胚胎发育阶段,移植囊胚的妊娠率最高,为62.5%。囊胚期胚胎内细胞数量多,细胞对外界不良环境的抵抗力强,有利于移植后胚胎存活。在扩张囊胚阶段,随着胚内细胞的不断分化,胚内出现内细胞团和充满液体的囊胚腔,胚胎的均一性下降,可能影响了冷冻胚胎的质量和移植后的妊娠率[18]。本研究发现,扩张囊胚移植后的妊娠率很低,不建议移植扩张囊胚。目前选择移植的胚胎主要是囊胚和桑椹胚,但是桑椹胚与囊胚移植后妊娠率的高低在文献中报道不一致[19-20],具体的影响机理有待进一步的研究。
从移植胚胎数对妊娠率的影响来看,受体羊移植双胚的妊娠率较移植单胚低5%,这与文献报道的研究结果不一致[19,23-25]。胚胎能否在受体羊体内附植成功与受体羊体内生殖激素的水平有重要关系[26-29],妊娠初期,孕酮与雌激素协同,促进子宫形成分泌性子宫内膜,黏膜层加厚,有利于胚胎附植。如果此时孕酮水平不足,容易发生流产。分析移植双胚较单胚低的原因,可能是受体羊孕激素水平低造成的。
羔羊早期生长发育指标统计结果表明,小尾寒羊作为受体羊所产羔羊的出生重、1 月龄、2 月龄和3 月龄的体重均高于湖羊作为受体羊所产羔羊,但没有显著性差异[30]。小尾寒羊作为受体,胎儿出生重高于湖羊作为受体羊的原因,与胚胎生活的子宫内环境有关,具体原因有待进一步研究。
4 结论
本实验结果显示,不同发育阶段的胚胎对移植妊娠率有一定影响,扩张囊胚的妊娠率30.0%,显著低于桑椹胚、晚期桑椹胚、早期囊胚和囊胚的妊娠率,所以不建议移植扩张囊胚;中上等营养水平受体羊的妊娠率显著高于下等营养水平受体羊,在受体羊的饲喂过程中一定要保证充足的营养水平。在山东潍坊地区,小尾寒羊和湖羊均可以作为胚胎移植的受体,但小尾寒羊体型偏大,每日饲料消耗偏多,所以湖羊作为受体羊在节约饲料方面更有优势。
