2型糖尿病患者m6A腺苷的动态调节及其发生机制
2021-07-17陈夜茜
陈夜茜
(1. 新乡医学院药学院,河南 新乡 453003;2. 河南省儿童医院,河南 郑州 450000)
2型糖尿病(type 2 diabetes mellitus,T2DM)在60岁以上老人中有很高发病率,并且在我国其发病率呈上升趋势。但是,其病理机制尚未得到准确结论。已有研究表明,T2DM的发病与很多基因以及环境相关因素有很大联系[1]。有研究指出,脂肪酸合成酶(fatty acid synthase,FAS)、叉头转录因子(forkhead box O1,FOXO1)和葡萄糖-6-磷酸酶(glucose-6-phosphatase catalytic ,G6PC)等基因失调可能会产生糖脂代谢异常。这些基因在T2DM的病理过程中有重要作用[2-5],但这些基因的异常表达是由于哪些体内或体外环境等因素造成的,至今还无确定结论。已有较多研究探讨了不同层次的表观调控对诸多代谢性疾病的影响,但是目前对T2DM的表观转录调控的研究较少[6]。因此,在研究糖尿病发病机制中,表观转录变化很可能是一个重要方向。
N6-甲基腺苷(N6-Methyladenosine,m6A)是mRNA中丰度较高的表观转录调控形式之一[7]。肥胖、糖尿病、癌症和其他人类疾病等很多都与m6A修饰改变有关[8-9]。并且,m6A修饰是一种处于动态过程的修饰[7,10]。一方面,甲基转移酶样3(methyltransferase like 3,METTL3)、甲基转移酶样14(methyltransferase like 14,METTL14)和Wilms肿瘤1相关蛋白(Wilms’ tumor 1-associating protein,WTAP)形成的m6A甲基转移酶复合物可以在哺乳动物细胞mRNA中催化m6A[11-13]。另一方面,α-酮戊二酸依赖性双加氧酶蛋白家族的2个成员:脂肪和肥胖相关蛋白(fat mass and obesity associated protein,FTO)及α-酮戊二酸依赖性双加氧酶烷烃羟化酶同系物5(alk B homolog 5,ALKBH5)作为去甲基化酶,可以有效降低mRNA中m6A水平[10,14-16]。m6A甲基转移酶复合物和去甲基化酶相互制约,在细胞内形成了对的m6A动态调控。但对于T2DM中这些甲基化酶和去甲基化酶的表达是否变化?与T2DM发病有关的基因表达水平是否受其影响?这些问题还没有相关研究。因此,本研究通过检测T2DM患者m6A水平动态变化,以及甲基化酶和去甲基化酶的差异表达,旨在探讨表观转录在T2DM发病机制中的作用。
1 资料与方法
1.1 一般资料 选取南京中医药大学附属医院2017年收治的60例T2DM患者(T2DM组,其中男性29例,女性31例,年龄52~64岁)和同期体检的年龄、性别相匹配的65例健康人(健康对照组,其中男性32例,女性33例,年龄52~66岁)为研究对象。
1.2 外周血生化指标检查 采集所有研究对象空腹外周静脉血2 ml,应用全自动Beckman AU5800生化分析仪测定其血糖、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)等生化指标。
1.3 外周血总RNA的提取 应用Blood RNA简易试剂盒(天根生化,北京)从外周血白细胞分离提取总RNA。使用微量分光光度计(Nano Drop)检测RNA浓度,同时使用凝胶电泳法测定RNA完整性。另外,选取T2DM组低血糖急症[(空腹血糖<2.5 mmol/L患者、空腹血糖正常(3.9~6.1 mmol/L)]和3例高血糖急症(空腹血糖>22.5 mmol/L) T2DM患者进行FTO mRNA表达量的测定。
1.4 RNA酶水解及总RNA m6A检测 总RNA按Niand 描述的方法进行酶解[17]。并采取液相色谱-电喷雾电离质谱联用系统对核苷进行分析检测,质谱仪为AB 3200 QTRAP (Applied Biosystems,CA,USA),在正相电喷雾电离模式下进行质谱检测。用Mm6A与MrA的比值计算m6A的含量,其中Mm6A是m6A的摩尔量,而MrA是RNA样品中测定的腺苷(A)的摩尔量。所有系数值(R2)均>0.998,线性范围为0.05%~5.00%(m6A/rA的摩尔比)。
1.5 细胞培养和质粒转染 选用HepG2细胞系(本实验室自有),对HepG2细胞分别用含有5.5 mM和16.7 mM的葡萄糖的培养基孵育48 h后,收集细胞,提取RNA备用。应用Dulbecco’s Modified Eagle Medium(DMEM)培养基培养,DMEM中添加10%FBS(胎牛血清)和1%Pen-Strep(双抗)。Lipofectamine(脂质体)3000(Invitrogen,美国)用于DNA质粒(pcDNA3.1-FTO,筛选标记为嘌呤霉素)和si-FTO转染,si-FTO序列为5′-AAAUAGCCGCUGCUUGAGA-3′,并以序列为5′-UUCCGAACGUGUCACGUTT-3′的无义siRNA作为对照。应用2 mg/L嘌呤霉素建立FTO敲除及过表达稳定的细胞系。
1.6 实时定量PCR检测mRNA的表达 使用TRIzol试剂(invitrogen,美国)提取细胞总RNA,之后使用逆转录试剂盒(invitrogen,美国)将其制备成cDNA文库。在Q5实时PCR检测系统(ABI,美国)上用相应的引物和 PowerUp SYBR Green Master Mix(2x)试剂(Thermo Fisher,美国)检测FTO、METTL14、METTL3、FOXO1、FASN、G6PC和DGAT2的mRNA表达。见表1。

表1 检测mRNA相应的引物
1.7 蛋白质印迹检测 蛋白样品在10% SDS-PAGE凝胶中分离并转移到PVDF膜。5%脱脂牛奶封闭,在4℃下将膜与一抗[兔抗FTO(27226-1-AP,ProteinTech)、兔抗GAPDH(10494-1-AP,ProteinTech)]孵育过夜。经TBST洗涤3次后,膜在室温下用二抗孵育2 h。化学发光法显影,并用imageJ软件检测条带相对灰度值。
1.8 统计学方法 应用SPSS 11.0软件进行统计学分析,使用GraphPad Prism 5对数据统计并作图。将均数SE作为连续变量,用t检验评价各组变量的差异。P<0.05为差异有统计学意义。
2 结果
2.1 T2DM组血糖、血脂水平及甲基化酶和去甲基化酶改变 T2DM组患者空腹血糖、TC、TG及LDL-C水平显著高于健康对照组,HDL-C低于对照组,差异均有统计学意义(P<0.05),见表2。为观察高糖刺激是否对mRNA甲基化和去甲基化的表达水平有所影响,qPCR检测了实验中部分患者和健康对照组的白细胞中METTL14、METLL3、WTAP和FTO的表达水平,结果显示T2DM患者的METTL14、METLL3、FTO表达升高,与对照组比较差异有统计学意义(P<0.05),见图1A。但对用含有5.5 mM和16.7 mM的葡萄糖的培养基孵育的HepG2细胞检测发现,高糖刺激显著提高了FTO mRNA的表达量(P<0.05),但是却对METTL3、WATP和METTL14无明显影响,见图1B。总结以上数据,在T2DM患者和HepG2细胞中,葡萄糖刺激确实促进了FTO的mRNA表达。但为何METTL3、WATP和METTL14在体内和体外检测不一致,可能是机体内有更为复杂的调控机制。但首先明确高血糖可以直接刺激FTO表达的升高,为确定该结论,又分别检测了3例低血糖急症T2DM患者、高血糖急症T2DM患者和空腹血糖正常健康对照者的FTO mRNA,结果显示高血糖急诊患者中FTO mRNA的表达水平明显高于在低血糖急诊的患者,见图1C。
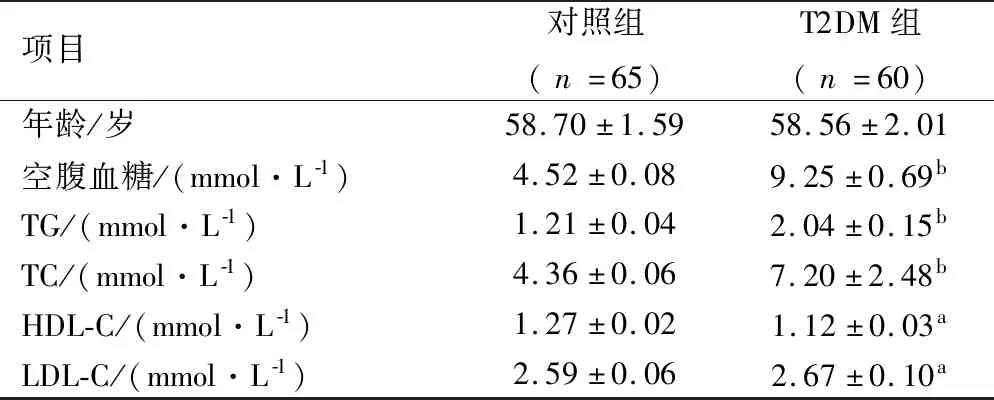
表2 T2DM组患者与健康对照组血糖和血脂水平比较
2.2 去甲基化酶FTO的升高导致m6A的含量下降 FTO是mRNA中m6A修饰的去甲基化酶之一,实验结果显示T2DM患者m6A含量明显下降(P<0.01),见图2A,表明FTO在m6A下降中起重要作用。在HepG2细胞中检测到类似的结果,即m6A在FTO敲除的细胞中随FTO表达减少而增多,而m6A在FTO过表达细胞中随FTO的表达增多而减少,见图2B、图2C。这些数据进一步表明m6A含量的改变极大概率是由于FTO的操纵。 然而,在FTO过表达HepG2细胞中,METTL3、METTL14和WTAP的mRNA表达量无显著的变化,见图2D。这些结果的差异显示了FTO对mRNA甲基化以及其它m6A甲基转移酶的影响在体内存在复杂的发生机制。

注:图1A:T2DM患者和对照组甲基转移酶和去甲基酶 mRNA的表达;图1B:高糖刺激HepG2细胞后,FTO mRNA表达含量的变化;图1C:FTO mRNA在3例空腹正常血糖患者(P1~P3)(空腹血糖<3.9~6.1 mmol/L)和3例空腹低血糖患者(P4~P6)(空腹血糖<2.5 mmol/L)和3例高血糖急症患者(P7~P9)(空腹血糖>22.5 mmol/L)中表达情况,以正常血糖的第一位患者的FTO mRNA相对表达量为基准。与对照组比较,*:P<0.05,**:P<0.01。图1 高血糖促进FTO mRNA表达
注:图2A:T2DM病人和正常人血液白细胞中m6A含量值的变化;图2B:在敲出或过表达FTO的HepG2细胞中,m6A含量值的变化;图2C:在敲出或过表达FTO的HepG2细胞中FTO蛋白表达的Western blot分析;图2D:FTO过度表达HepG2细胞甲基转移酶mRNA表达水平。与对照组比较,*:P<0.05。图2 高血糖和FTO敲低或过表达后HepG2细胞中m6A和甲基转移酶的表达情况
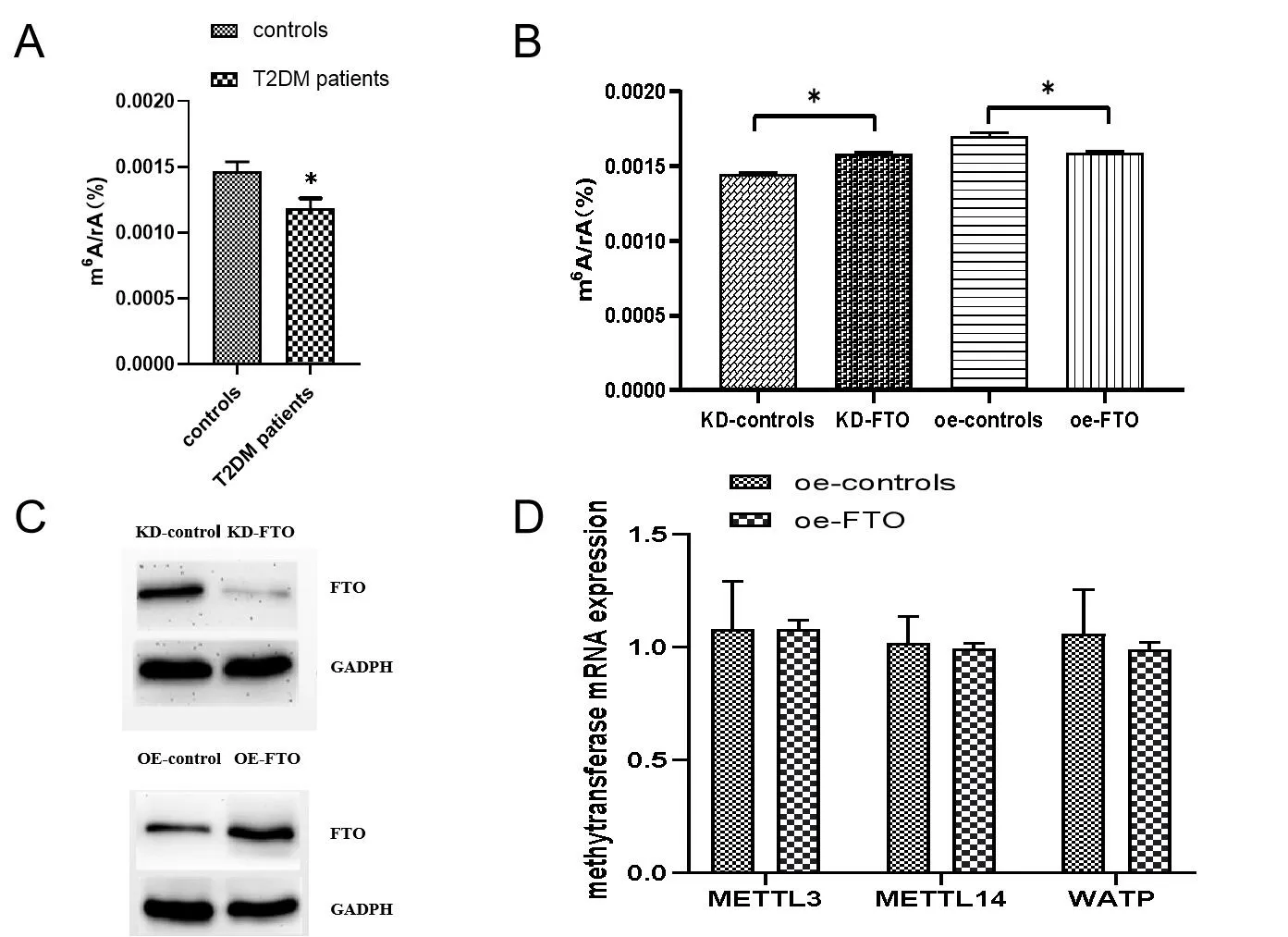
2.3 观察 FTO对FOXO1、FASN、G6PC和DGAT2的mRNA表达的影响 为了探究T2DM患者中FTO与调控糖脂代谢的关键基因之间的关系,qPCR法检测了FOXO1、FASN、G6PC和DGAT2的mRNA表达水平。数据显示,在T2DM患者中,FOXO1、FASN、G6PC、DGAT2的相对mRNA表达水平均比对照组高,见图3A。为了再次验证FTO的调控作用,在FTO被敲除的HepG2细胞中,FXO1和DGAT2的mRNA表达水平显著降低,见图3B。此外,FXO1、FASN、G6PC和DGAT2在FOT过度表达HepG2细胞中表达有一定程度的升高,但差异无统计学意义(P>0.05),见图3C。总结这些数据,对于这些基因的正常调控,FTO是非常必要的。
注:图3A:T2DM患者和正常人的FOXO1、FASN、G6PC和DGAT2的mRNA表达水平;图3B:FTO敲除HepG2细胞中FOXO1、FASN、G6PC和DGAT2的mRNA表达(n=3);图3C:FTO过表达HepG2细胞中FOXO1、FASN、G6PC和DGAT2的mRNA表达水平。与对照组比较,*:P<0.05,**:P<0.01。图3 FTO诱导脂质和葡萄糖代谢相关基因mRNA表达
3 讨论
真核细胞中存在一种可逆的、广泛的mRNA修饰-m6A修饰,表达异常的m6A修饰会导致mRNA的功能发生障碍,这可进一步引发动物和人的许多疾病[18]。T2DM严重危害我国公众的健康安全问题,具有很高的发病率,据有关研究显示,到2020年我国的T2DM患者可能会达到8000万[19]。然而,对于RNA的表观转录调控改变在T2DM病理过程中的作用和影响,现在对此知之甚少。在高血糖的影响下,细胞的mRNA甲基化水平有什么改变,以及这种改变的机制是怎样的,相关研究都还比较缺乏。本研究表明,T2DM患者的外周血白细胞m6A修饰呈现动态变化,T2DM患者去甲基酶FTO mRNA表达与m6A水平相反。为了再次证实T2DM高血糖急症患者FTO mRNA表达可能会明显比低血糖急症患者升高,通过对选取的正常血糖、高血糖急症和低血糖患者的数据分析表明,高血糖和病人FTO表达水平之间的关系,同时,在体外的HepG2细胞高糖实验结果,其更直观地展现了葡萄糖有促进FTO表达的作用。这些结果显示高糖会促进FTO的表达,从而进一步诱导m6A在T2DM中的降低作用。同时,检测T2DM患者血样中几种甲基转移酶METTL3、METTL14、WTAP mRNA表达水平,结果显示,T2DM患者METTL3和METTL14 mRNA表达水平明显高于正常对照组。但在体外的高血糖刺激实验中,并未发现METTL3和METTL14 mRNA表达水平有显著的变化。同时,在过表达的FTO细胞中也观察不到METTL3和METTL14 mRNA表达水平含量有显著的改变。这种差异表明高血糖对RNA的m6A修饰表达调控水平,在体内有着更为复杂的机制。但是无论在体内还是体外我们都可以看到较高的FTO表达水平和降低的m6A含量之间有着很明显的关联。
在T2DM的病理过程中,FOXO1、FASN、G6PC和DGAT2是参与糖脂代谢的重要酶,有着非常重要的作用[20-24]。本研究T2DM患者FTO mRNA表达上升与FOXO1、FASN、G6PC和DGAT2 mRNA表达上调有关,并且虽然在FTO过表达的细胞实验中没有看到明显的增强作用,但在FTO敲除的HepG2细胞中观察到对应一致的结果。这些数据表明,FTO可能提高FOXO1、FASN、G6PC和DGAT2 mRNA表达水平。在来自HepG2细胞的m6A-Seq的数据中表明,FXO1有5个m6A位点,FASN有2个m6A位点[25],并且抑制m6A甲基转移酶,显著影响基因的表达和选择性剪接方式,在这些基因的转录后调控中表明m6A起着重要作用。因此,通过充当 m6A“橡皮擦”的FTO可以用来调节这些基因的表达水平。而这些基因能够进一步影响葡萄糖和脂质的代谢。尤其是,在糖异生和糖原分解中,G6PC是其中的关键酶,FOXO1还促进肝糖的异生,这在很大程度上表明了T2DM患者的血糖升高与代谢酶的mRNA甲基化调控相联系[26]。另一种可能的机制是胰岛素抵抗(IR)。FOXO1是Forkhead家族的成员,在胰岛素和胰岛素样生长因子1(IGF-1)的信号传导途径中,作为极其必要的转录因子,在所有组织细胞中广泛表达[27]。FASN是一种脂肪酸合成酶,可以催化形成新的脂肪酸,其在代谢性疾病中可以通过IR发挥关键的作用[28]。而在小鼠肝脏中DGAT2的过度表达,会产生严重的肝脏IR。所以这些基因的升高必然会影响葡萄糖和脂质的代谢水平。
综上所述,高糖刺激可以增加FTO表达水平,从而导致m6A水平降低,T2DM病人的FOXO1、FASN、G6PC和DGAT2的mRNA表达水平显著升高,并且FTO敲低后FOXO1和DGAT2的mRNA表达水平显著降低,表明FTO这些基因mRNA的水平有明显影响。但高血糖是怎么刺激FTO水平增加,其体内机制还需要更进一步的研究。
致谢:该项目得到河南省自然科学基金“Sirt6经LKB1/AMPK/PGC1a/NRF上调线粒体生物合成”(编号202300410325)支持。
说明:本次研究对象选取南京中医药大学附属医院的病例,是因为笔者单位与南京中医药大学附属医院有合作。
