抗菌肽MAF-1A衍生物体外抗白念珠菌生物膜活性及机制研究
2021-07-16邓思波黄敏慧张迎春李彩多吴建伟陈峥宏
邓思波,黄敏慧,张迎春,李彩多,吴建伟,陈峥宏,王 涛
白念珠菌(Candidaalbicans)是常见的条件致病性真菌,当机体菌群失调、免疫功能降低或机体处于应激、严重感染时,可导致皮肤黏膜感染或侵袭性真菌感染的发生。据统计,C.albicans所致的侵袭性感染的死亡率高达60%[1-2]。抗真菌药物的使用对真菌感染性疾病的控制起到了重要作用,但随着耐药菌株的不断增加,耐药性已成为临床抗真菌感染治疗失败的重要原因。C.albicans在生长繁殖的过程中,不但能以浮游状态存在,还可以形成生物膜(biofilm)[3-4],而生物膜的形成是导致C.albicans产生耐药性的主要因素之一。文献[5-6]报道,生物膜状态C.albicans对临床常用抗菌药物的耐受性较浮游菌显著增强。因此,寻找新型药物抑制或破坏生物膜已成为临床抗真菌治疗的必然要求。
抗菌肽(antimicrobial peptides,AMPs)是机体抵抗细菌、真菌、病毒等多种病原体感染的小分子先天免疫功能多肽。由于AMPs抗病原微生物范围广、不易产生耐药性、低毒等特性,具备新型抗菌药物开发的潜力[7-8]。家蝇抗真菌肽-1A (Musca domestica antifungal peptide-1A,MAF-1A) 是来源于家蝇幼虫的小分子阳离子活性多肽,课题组以MAF-1A的氨基酸序列为基础,采用氨基酸分子突变法设计获得了一个MAF-1A衍生物。前期研究表明[9],MAF-1A衍生物是一种稳定性高、抗菌活性强的人工合成AMPs,其不仅对C.albicans浮游菌的抑杀效果优于其模板肽MAF-1A,且对C.albicans生物膜也具有明显抑制作用,但该衍生物对C.albicans生物膜抑制活性及作用机制尚不清楚。本文在此基础上,进一步探讨MAF-1A衍生物的抗C.albicans生物膜活性和作用机制,为抗生物膜药物研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 MAF-1A衍生物的化学合成 MAF-1A衍生物的氨基酸序列为 KKFLKTAKLLIKSALLLLKSLALKMK,委托生工生物工程(上海)股份有限公司采用FMOC固相合成法合成,高效液相色谱(HPLC)纯化、液相色谱-质谱(LC-MS)验证,多肽合成纯度≥98%。
1.1.2 菌株 白念珠菌(Candidaalbicans,ATCC10231)由贵州医科大学病原生物学特色重点实验室保存。
1.1.3 主要试剂 四甲基偶氮唑盐(methyl thiazolyl tetrazolium, MTT)购自北京博奥拓达科技有限公司; RNAiso Plus试剂盒、逆转录试剂盒(PrimeScriptTMRT Master Mix)、荧光定量PCR试剂盒(SYBR Premix Ex TaqTMⅡ)均购自TaKaRa(大连)有限公司;沙氏葡萄糖琼脂培养基(Sabouraud Dextrose Agar, SDA)、酵母浸出粉胨葡萄糖(Yeast Peptone Dextrose, YPD)液体培养基、氟康唑(FLC)、两性霉素B(AMB)、活性氧(ROS)检测试剂盒、FITC-Annexin-V/PI细胞凋亡检测试剂盒均购自Solarbio(北京)有限公司;JC-1线粒体膜电位测定试剂盒购自MCE(上海)有限公司。
1.1.4 引物合成 使用SnapGene软件设计引物序列,并在NCBI上进行引物序列比对,选择特异性引物序列,委托生工生物工程(上海)股份有限公司合成生物膜形成相关基因(ALS3、HWP1、SUN41、UME6)和内参基因(ACT1)引物,相关引物序列见表1。

表1 荧光定量PCR引物Tab.1 Primers for Quantitative Real-time PCR
1.2 方法
1.2.1 菌株活化及菌悬液制备 无菌操作下取C.albicans冻存物划线接种于SDA 平板,置于37 ℃温箱培养18~24 h后,挑取菌株单菌落接种于5 mL YPD液体培养基中,于37 ℃、180 r/min震摇培养16 h;离心收集菌体,用无菌PBS洗涤2次,以RPMI 1640培养基制成2×106CFU/mL菌悬液备用。
1.2.2 MAF-1A衍生物抗C.albicans活性检测 参考CLSI(Clinical and Laboratory Standards Institute)M27-A3方法[10],采用微量稀释法检测MAF-1A衍生物的抗C.albicans最小抑菌浓度(minimal inhibit concentration,MIC)以及最小杀菌浓度(minimum fungal concentration,MFC);参考文献[11],用XTT法检测MAF-1A衍生物对C.albicans生物膜80%的抑制浓度(SMIC80),同时以FLC(4 μg/mL)为药物对照。
1.2.3 MAF-1A衍生物对生物膜形成的影响
1.2.3.1 衍生物对C.albicans黏附的影响 将衍生物与菌液(2×106CFU/mL)各100 μL混合于96孔板中,使MAF-1A衍生物终浓度分别为0、62.5、125、250、500和1 000 μg/mL;混合液37 ℃孵育2 h后,于倒置显微镜下观察白念珠菌黏附情况;参考文献[12],采用XTT法检测其生物活性。同样方法作FLC(4 μg/mL)为药物对照。
1.2.3.2 MAF-1A衍生物对C.albicans菌丝形成的影响 将100 μL菌液(2×106CFU/mL)置于96孔板中,37 ℃恒温培养2 h后,用无菌PBS洗去浮游菌;加入终浓度分别为0、62.5、125、250和500 μg/mL的MAF-1A衍生物100 μL,继续培养16 h后,弃上清液,无菌PBS洗涤2次,倒置显微镜下观察菌丝形成情况。同样方法以FLC(4 μg/mL)为药物对照。
1.2.4 MAF-1A衍生物对生物膜形成相关基因转录水平的影响 将1 mL MAF-1A衍生物与等体积菌悬液(2×106CFU/mL)混匀,使MAF-1A衍生物的终浓度分别为0、62.5、125和250 μg/mL,将混合液于37 ℃培养24 h后,5 000 r/min离心5 min收集菌体;参照RNAiso Plus和逆转录试剂盒使用说明书, 提取菌细胞 Total RNA 并逆转录为cDNA;参考文献[13],使用 qRT-PCR 反应试剂盒以管家基因ACT1为内参, 采用2-ΔΔCt法对C.albicans生物膜形成相关基因 mRNA 水平进行相对定量。反应条件为:95 ℃ 15 s,55 ℃ 15 s,72 ℃ 45 s,共40个循环。
1.2.5 MAF-1A衍生物抗成熟生物膜活性 将200 μL菌液(2×106CFU/mL)置于96孔板中,37 ℃恒温培养2 h后,无菌PBS洗去浮游菌,加入RPMI 1640培养基200 μL,37 ℃培养24 h后,弃上清液,无菌PBS洗涤3次,获得C.albicans成熟生物膜;向成熟生物膜加入终浓度分别为0、62.5、125、250、500和1 000 μg/mL的MAF-1A衍生物200 μL,培养24 h后,弃上清液,无菌PBS洗涤2次,参考文献[12],以XTT法检测生物膜活性;采用扫描电镜观察衍生物对成熟生物膜结构的影响。同样方法以FLC(4 μg/mL)为药物对照。
1.2.6 生物膜细胞凋亡检测 将MAF-1A衍生物(终浓度分别为0、62.5、125和250 μg/mL)处理24 h后的C.albicans成熟生物膜细胞重悬于400 μL Annexin V结合液,加入Annexin V-FITC染液5 μL,混匀后于37 ℃避光孵育15 min,再加入PI染液10 μL继续孵育5 min;采用激光共聚焦扫描显微镜观察生物膜细胞凋亡。同样方法以AMB(2 μg/mL)为药物对照。
1.2.7 活性氧(Reactive oxygen species, ROS)水平检测 以终浓度为0、62.5、125、250和500 μg/mL的MAF-1A衍生物分别处理C.albicans成熟生物膜24 h后,按试剂盒说明加入DCFH-DA荧光试剂,于37 ℃避光孵育20 min后,无菌PBS洗涤2次,流式细胞仪检测荧光强度。
1.2.8 线粒体膜电位检测 以终浓度为0、62.5、125、250和500 μg/mL的MAF-1A衍生物分别处理C.albicans成熟生物膜24 h后,按试剂盒说明加入JC-1染色工作液,37 ℃避光孵育15 min,无菌PBS洗涤2次,多功能酶标仪检测JC-1的荧光转变,通过计算FL2/FL1比值得出线粒体膜电位的变化。
2 结 果
2.1 MAF-1A衍生物抗C.albicansATCC10231活性 检测结果显示,MAF-1A衍生物对C.albicans浮游菌的MIC为62.5 μg/mL,MFC为125 μg/mL;对C.albicans生物膜的SMIC80为62.5~125 μg/mL。而其模板肽对C.albicans的MIC、MFC和SMIC80值均高于MAF-1A衍生物,分别为600 μg/mL、800 μg/mL以及 1 000 μg/mL。
2.2 MAF-1A衍生物减少C.albicansATCC-10231的黏附 镜下可见,当浓度达250 μg/mL时,MAF-1A衍生物可明显降低C.albicans的黏附(图1)及其生物活性(t=3.680,P<0.05),并且这一作用随MAF-1A衍生物浓度增加而更加明显(图2)。
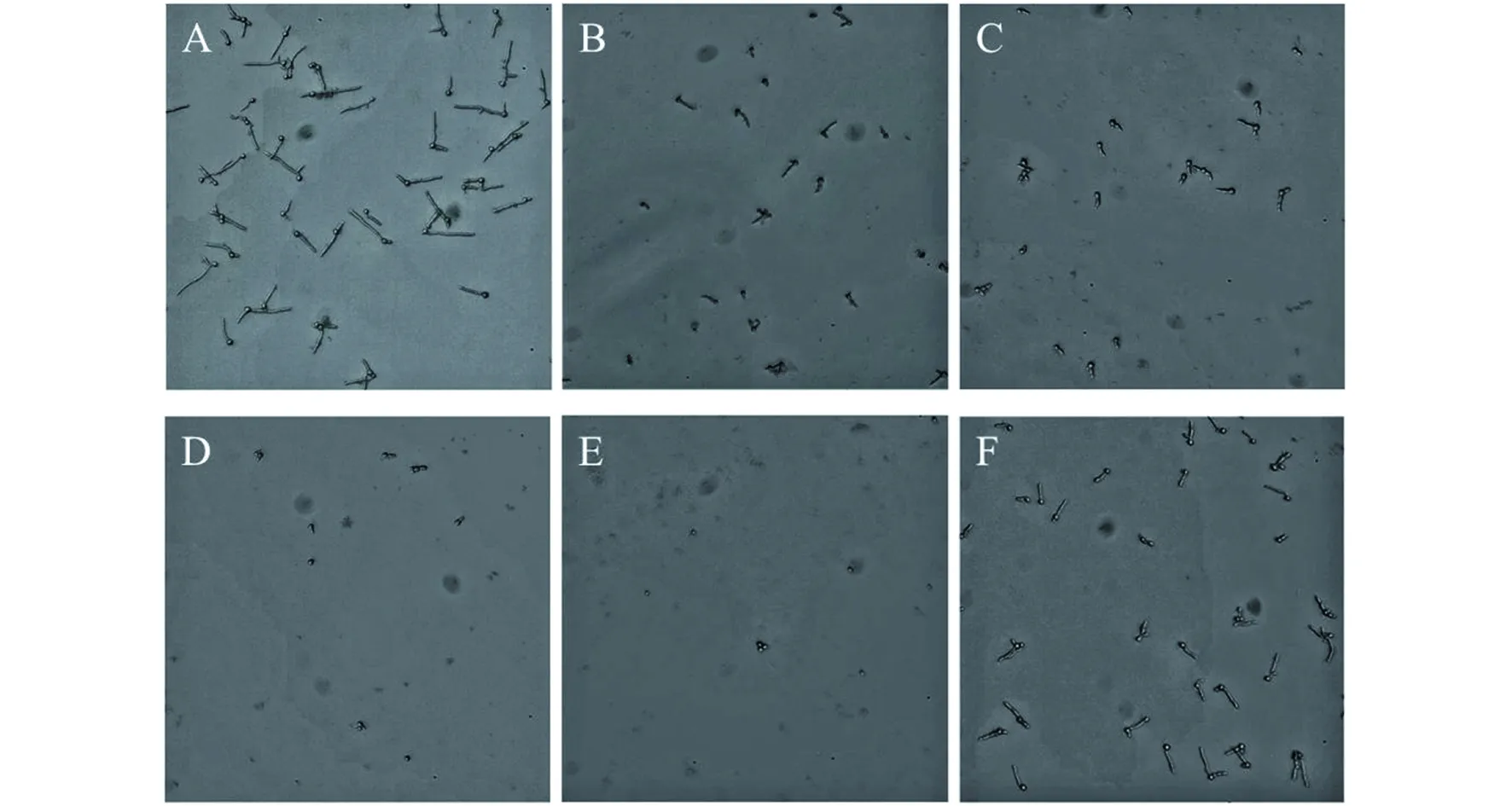
MAF-1A衍生物浓度为A: 0 μg/mL; B: 62.5 μg/mL; C: 125 μg/mL; D: 250 μg/mL; E: 500 μg/mL; F: 为FLC对照4 μg/mL图1 MAF-1A衍生物对白念珠菌黏附的影响(×200)Fig.1 Effects of MAF-1A derivatives on the adhesion of C. albicans (×200)
2.3 MAF-1A衍生物对C.albicansATCC10231菌丝形成的影响 镜下可见,阴性对照组的C.albicans可以正常形成菌丝,其菌丝较多,菌丝细长、纵横交错;但62.5μg/mL的MAF-1A衍生物即可明显抑制C.albicans菌丝的形成,且随着浓度的增加,C.albicans菌丝明显变短、稀疏,甚至不能形成菌丝(图3)。
2.4 MAF-1A衍生物下调白念珠菌生物膜形成相关基因的表达 qRT-PCR结果显示(图4),与未经处理的对照组相比,62.5 μg/mL 的MAF-1A衍生物即可使生物膜形成相关基因UME6、ALS3、SUN41、HWP1的mRNA表达量明显下调(tUME6=12.42,P<0.001;tALS3=12.20,P<0.001;tSUN41=7.206,P<0.001;tHWP1=22.52,P<0.001)。
2.5 MAF-1A衍生物抗C.albicansATCC10231成熟生物膜活性 通过扫描电镜观察可见,未经MAF-1A衍生物处理的成熟生物膜结构完整,生物膜细胞未出现破损现象,细胞外基质丰富;但浓度为62.5 μg/mL的MAF-1A衍生物作用后,即可导致生物膜结构被破坏,生物膜细胞皱缩溶解,菌丝断裂,细胞外基质减少(图5)。成熟生物膜活性检测发现,当MAF-1A衍生物浓度为500 μg/mL时,与未经处理组相比,成熟生物膜的生物活性明显降低(t=1.19,P<0.05)(图6)。

注:①代表与阴性对照相比P<0.05,②代表与阴性对照相比P<0.01图2 MAF-1A衍生物对白念珠菌黏附期生物活性的影响Fig.2 Effect of MAF-1A derivatives on the biological activity of C. albicans in the adhesion stage

MAF-1A衍生物浓度为A: 0 μg/mL; B: 62.5 μg/mL; C: 125 μg/mL; D: 250 μg/mL; E: 500 μg/mL; F: 为FLC对照4 μg/mL图3 MAF-1A衍生物对白念珠菌菌丝形成的影响 (×200)Fig.3 Effect of MAF-1A derivatives on the formation of C. albicans hypha (×200)
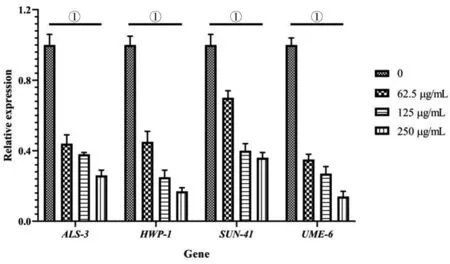
注:①与阴性对照相比P<0.001图4 MAF-1A衍生物对白念珠菌生物膜形成相关基因mRNA表达的影响Fig.4 Effects of MAF-1A derivatives on mRNA expression of genes related to biofilm formation in C. albicans
2.6 MAF-1A衍生物诱导C.albicansATCC10231成熟生物膜细胞凋亡 激光共聚焦显微镜检测结果显示:与阴性对照相比,经不同浓度的MAF-1A衍生物处理之后,生物膜细胞磷脂酰丝氨酸外翻,生物膜细胞细胞膜的通透性发生改变,细胞膜的完整性被破坏,成熟生物膜中凋亡细胞的数量明显增多(图7)。
2.7 MAF-1A衍生物对C.albicansATCC10231生物膜细胞内ROS的影响 经不同浓度的MAF-1A衍生物处理后,生物膜细胞内ROS的含量较阴性对照均明显增加,且随着MAF-1A衍生物浓度的增加,生物膜细胞内的ROS含量不断增加(图8)。
2.8 对C.albicansATCC10231生物膜细胞线粒体膜电位的影响 经不同浓度的MAF-1A衍生物处理之后,线粒体膜电位较阴性对照组明显降低(t62.5=17.59、t125=33.26、t250=35.48、t500=41.27, 均P<0.000 1)(图9),且随着MAF-1A衍生物浓度的增加,线粒体膜电位也随之降低,呈浓度依赖性。

MAF-1A衍生物浓度为A: 0 μg/mL; B: 62.5 μg/mL; C: 125μg/mL; D: 250 μg/mL; E: 500 μg/mL; F: 为FLC对照 4 μg/mL;1表示: ×500;2表示: ×5 000图5 MAF-1A衍生物对白念珠菌成熟生物膜形态结构的影响Fig.5 Effect of MAF-1A derivatives on the morphological structure of mature biofilm of C. albicans

注:①与阴性对照相比P<0.05;②与阴性对照相比P<0.01图6 MAF-1A衍生物对白念珠菌成熟生物膜活性的影响Fig.6 Effect of MAF-1A derivatives on the mature biofilm activity of C. albicans
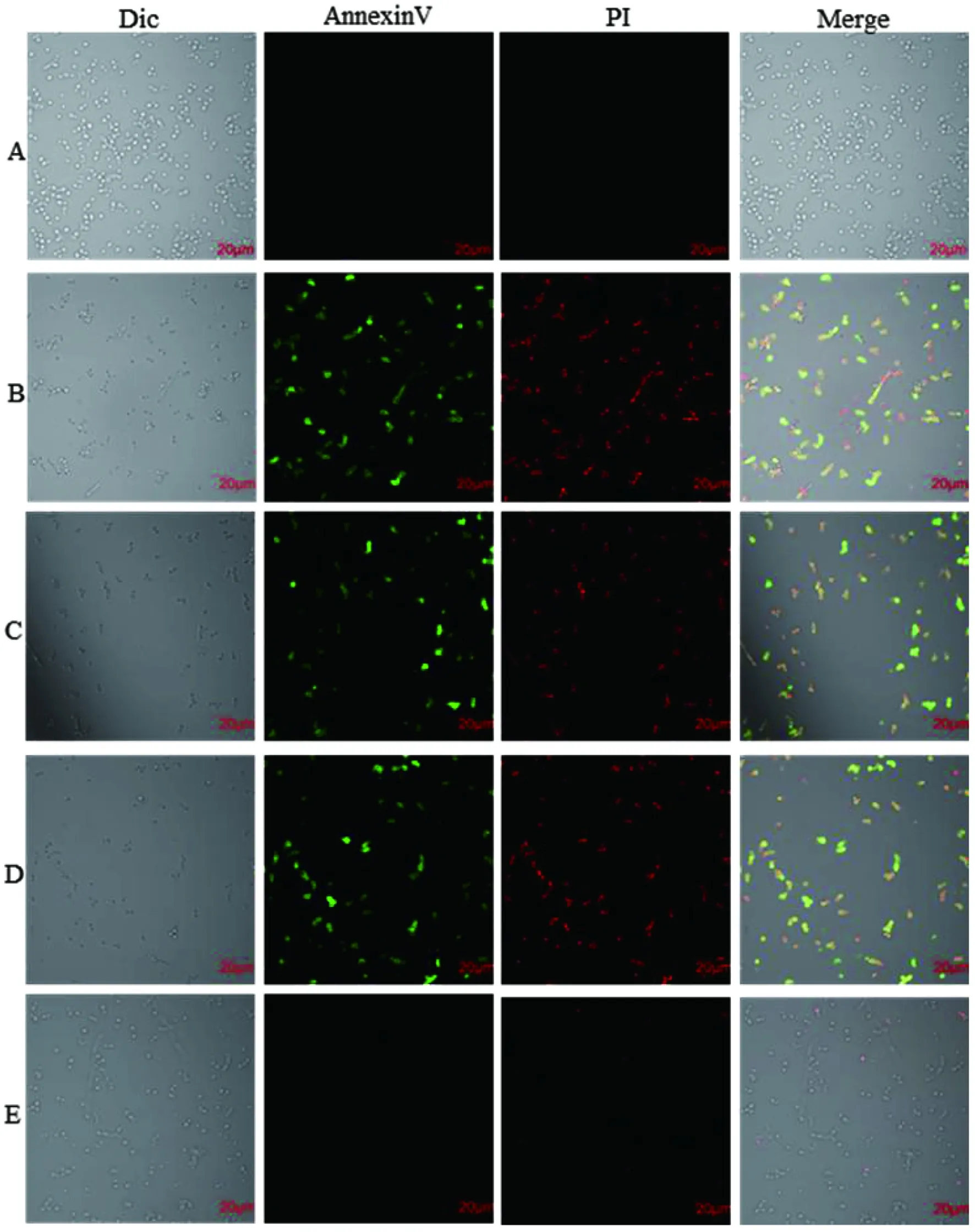
MAF-1A衍生物浓度为A: 0 μg/mL; B: 62.5 μg/mL; C: 125 μg/mL; D: 250 μg/mL; E: 为 AMB对照 2 μg/mL图7 CLSM检测白念珠菌成熟生物膜细胞凋亡Fig.7 Detection of cell apoptosis in mature biofilms of C. albicans by CLSM

MAF-1A衍生物浓度为A: 0 μg/mL; B: 62.5 μg/mL; C: 125 μg/mL; D: 250 μg/mL; E: 500 μg/mL; F: 为AMB对照 2 μg/mL图8 白念珠菌成熟生物膜细胞内活性氧检测Fig.8 Detection of ROS in mature biofilm cells of C. albicans
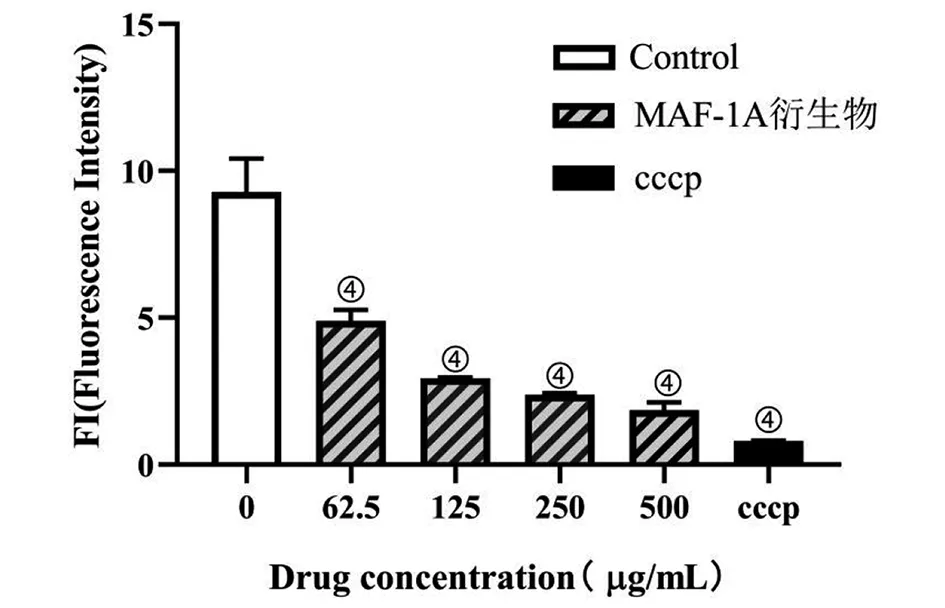
注:cccp为氧化磷酸化解偶联剂(阳性对照),分子式为C9H5ClN4,④与阴性对照相比P<0.000 1图9 MAF-1A衍生物对成熟生物膜细胞线粒体膜电位的影响Fig.9 Effect of MAF-1A derivatives on mitochondrial membrane potential of mature biofilm cells
3 讨 论
C.albicans在机体内及物体表面常以生物膜的形式存在,生物膜的形成可以提高C.albicans的环境适应能力和耐药性,导致C.albicans疾病治疗的难度增加,目前临床抗C.albicans治疗失败的一个重要原因是生物膜的形成[14]。因此,迫切需要能够有效抑制生物膜的新型抗真菌药物。实验研究发现,AMPs除具有广谱高效的抗菌活性外,对多重耐药微生物的生物膜也表现出很强的抑杀活性[15-17],因此,AMPs作为新型抗生物膜制剂的研究已引起国内外学者的普遍关注[16-18]。本研究结果显示,MAF-1A衍生物对C.albicans的MIC、MFC及 SMIC80为62.5 μg/mL、125 μg/mL和62.5 μg/mL均小于模板肽,结果表明MAF-1A衍生物对C.albicans浮游菌和生物膜具有抑杀活性,且抑杀效果优于模板肽,提示其具有抗生物膜药物开发的研究价值。
C.albicans生物膜是由细胞外基质包裹菌体、假菌丝、菌丝形成的具有三维立体结构的微生物群落,其形成大致分为黏附(1~2 h)、菌丝形成(2~18 h)、成熟(24~72 h)3个阶段[19-20]。由此可见,C.albicans细胞对物体表面的粘附和菌丝的形成是生物膜形成的关键。倒置显微镜下观察其形态学改变发现,MAF-1A衍生物可明显减少C.albicans的黏附和菌丝的形成,且作用呈剂量依赖性,表明MAF-1A衍生物可以通过抑制菌体黏附和菌丝形成而阻止生物膜形成。文献报道,ALS3、HWP1所编码的蛋白与C.albicans细胞的黏附密切相关,而SUN41,UME6的编码产物有促进C.albicans菌丝形成的作用[21-24]。本实验用qRT-PCR 方法检测了MAF-1A衍生物上述基因在转录水平的表达,结果表明,相较于阴性对照,MAF-1A衍生物可使上述基因的mRNA表达水平明显下调(P<0.000 1),从而影响相应蛋白的表达,提示MAF-1A衍生物可能通过降低C.albicans细胞黏附及菌丝形成相关基因的表达来抑制生物膜的形成。
实验研究证明,AMPs不仅能通过抑制微生物细胞黏附等方式以干扰生物膜的早期形成,少数AMPs还能通过杀死生物膜细胞或使生物膜细胞脱落的方式来破坏成熟生物膜[25-26]。扫描电镜结果显示,MAF-1A衍生物作用后,生物膜细胞皱缩溶解,菌丝断裂,细胞外基质稀少,当MAF-1A衍生物的浓度为500 μg/mL时,C.albicans成熟生物膜的生物活性明显降低(t=1.19,P<0.05),表明MAF-1A衍生物可杀伤生物膜内的C.albicans细胞,提示MAF-1A衍生物可以破坏成熟生物膜。
文献报道,AMB等抗真菌化学药物及AMPs均可诱导C.albicans细胞凋亡[27-29]。本研究在进一步探讨MAF-1A衍生物破坏成熟生物膜的机制时发现,MAF-1A衍生物作用后,C.albicans成熟生物膜细胞磷脂酰丝氨酸外翻,生物膜细胞细胞膜的通透性发生改变,细胞膜的完整性被破坏,而在细胞凋亡过程中,细胞膜磷脂酰丝氨酸外翻是细胞早期凋亡的标志[30-31],结果表明MAF-1A衍生物可以诱导成熟生物膜细胞凋亡。细胞内ROS失衡已被证明是细胞凋亡的关键步骤之一,细胞内ROS的积累在酵母细胞凋亡中起着重要作用[30,32]。本实验研究发现,经MAF-1A衍生物作用后,成熟生物膜细胞内的ROS明显增加,且呈剂量依赖性,表明MAF-1A衍生物能通过提高成熟生物膜细胞内ROS含量,进而诱导细胞凋亡。线粒体在C.albicans的正常代谢活动中起着至关重要的作用,由于细胞氧化应激可引起线粒体膜去极化,导致线粒体功能障碍,功能受损的线粒体可以通过caspase等途径引起细胞凋亡[33]。本研究发现,相较于阴性对照,MAF-1A衍生物可明显降低线粒体膜电位(t62.5=17.59、t125=33.26、t250=35.48、t500=41.27,P<0.000 1),使线粒体膜电位去极化,提示MAF-1A衍生物可能通过线粒体损伤机制引起细胞凋亡。
综上所述,MAF-1A衍生物不仅可以通过抑制细胞黏附、菌丝形成来干扰C.albicans生物膜的早期形成,还能通过直接损伤及ROS累积、线粒体膜电位去极化所引发的细胞凋亡来破坏C.albicans成熟生物膜,提示 MAF-1A衍生物是通过多途径发挥抗生物膜效应,但其抗生物膜作用的关键机制及具体途径尚需进一步探讨。本实验研究为该衍生肽的深入研究和开发、利用奠定了基础,为抗生物膜药物的研发提供参考。
利益冲突:无
