结核分枝杆菌Rv3621c原核表达及免疫功能研究
2021-07-16毛莉蓉许礼发王晓春
毛莉蓉,许礼发,王晓春,张 健
结核病(tuberculosis,TB)是由结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)感染引发的重大呼吸道传染病,其病程长、传染性强、易迁延不愈。2018年世界卫生组织(WHO)估算全球TB新发病例数和死亡病例数约为1 000万和124万。再加上耐药性TB的急剧增加,TB的全球控制面临严重威胁。
尽管卡介苗(Bacille Calmette-Guerin,BCG)可有效预防婴幼儿TB,但其免疫保护期短、保护水平参差不齐且效价逐年下降,经10~20年后降至保护力不显著[1-2],且WHO不推荐重复接种。因此筛选并检测M.tb基因组中具有免疫保护性潜力的特定基因,已成为TB疫苗研究策略的重要方向。多方研究发现,RD区抗原有助于维持TB感染时的免疫自稳状态,可一定程度加强BCG的免疫效力[3]。本课题构建M.tb感染分泌期表达的RD9区抗原Rv3621c并进行纯化,通过人群外周血试验和小鼠试验检测rRv3621c的特异性和免疫原性,旨在筛选可做BCG初免的增强疫苗的靶抗原。
1 材料与方法
1.1 实验动物和伦理声明 SPF级C57BL/6雌性小鼠购自北京华阜康生物科技有限公司[动物合格证号:SCXK(京)2014-0004],6~8周龄,体重12~20 g。动物饲养与试验流程严格遵循《实验动物管理条例》,所有动物实验经安徽理工大学医学院动物伦理与试验委员会批准后进行。
1.2 菌株和主要实验材料M.tbH37Rv灭活毒株由山西长治医学院附属和平医院检验科惠赠;E.coliDH5α、BL21(DE3)株购自上海昂羽生物科技有限公司;Ni-NTA蛋白纯化系统购自德国QIAGEN公司;人IFN-γ ELISA购自深圳Dakewe公司;鼠相关细胞因子检测试剂盒购自杭州MULTI SCIENCES;单磷酰脂质A(MPLA)、人工合成海藻糖6,6′-二分枝菌酸(TDB)均购自Sigma公司;鼠源性His单抗、SYBR Green Kit试剂盒购自TIANGEN公司;限制性核酸内切酶BamHⅠ、XhoⅠ购自thermo scientific公司;母牛分枝杆菌(M.vaccae)裂解液由本室培养获得。
1.3 引物设计 检索GenBank获得Rv3621c基因序列。以pPROEX载体图谱及Rv3621c全序列为依据,借助DNAMAN软件确定最优多克隆酶切位点BamHⅠ、XhoⅠ,并通过Primer Preimer 5软件进行特异性引物设计(P1:TTCGGATCCCTGGACTTTGCTCAGTTACCGCCG,P2:ATCTCGAGTCCGCCAGCCGGCGGTTGGG)。PCR扩增条件:94 ℃ 5 min,94 ℃ 40 s,64 ℃ 40 s,72 ℃ 80 s,30 Cycles,72 ℃ 10 min。
1.4 重组质粒构建、表达及纯化 借助分子克隆法导入Rv3621c基因片段至原核表达载体pPROEX中,构建重组载体pPROEX-Rv3621c,以BamHⅠ和XhoⅠ进行双酶切鉴定。过夜连接后,以热休克法转化重组质粒至E.coliBL21(DE3)感受态细胞中,借助终浓度为0.5 mmol/L的IPTG进行诱导表达。经超声破碎后,再以Ni-NTA柱在变性条件下纯化蛋白,4 ℃梯度透析36 h后,根据内毒素清除试剂盒操作要求清除内毒素(<0.1 EU/mL)。蛋白纯化之后,以SDS-PAGE进行分析。进行Western blot分析,以鼠源性His单抗作为一抗,以HRP标记羊抗鼠IgG作为二抗,借此鉴定蛋白,并借助BCA试剂盒进行蛋白定量。
1.5 WBIA检测不同人群外周血Rv3621c抗原特异性IFN-γ水平 在安徽省淮南市肿瘤医院中进行病史采集、问卷调查及全身体检,以随机数表法随机选取感染者和健康者共40例,均需符合临床诊断标准。活动性结核(ATBs)和潜伏性结核(LTBIs)均属于TB感染者:有(或无)典型TB感染症状、有TB感染者密切接触史、痰涂片培养结果阳性(或阴性)、肺部X光片出现可疑阴影(或正常)和结核菌素试验(TST)结果阳性(≥5 mm)。健康对照者:无与TB患者密切接触史、TST结果阴性(<5 mm)。采集受试者全血0.5 mL,置于肝素管中保存,以5 μg/孔rRv3621c蛋白对其进行刺激,置37 °C温箱孵育18~24 h,以植物血凝素(PHA)和PBS作为阳、阴性对照以人IFN-γ ELISA试剂盒检测各孔IFN-γ浓度,计算各孔最终值时需考虑PBS刺激的本底值。
1.6 免疫小鼠的分组及免疫方式 6周龄C57BL/6雌性小鼠共30只,分成为PBS组、BCG组、佐剂MTM(M.vaccae裂解液、TDB、MPLA)组、Rv3621c/MTM组和BCG+Rv3621c/MTM组,每组6只小鼠。具体免疫方式如下:①PBS组:200 μL PBS/只;②BCG组:200 μL/只(含菌1.2×106CFU)BCG免疫1次;③佐剂MTM组:100 μL MTM混合100 μL PBS/只;④Rv3621c/MTM组:含40 μg rRv3621c蛋白溶液100 μL混合100 μL MTM/只;⑤BCG+Rv3621c/MTM组:先以200 μL BCG在0周注射1次,再以40 μg rRv3621c蛋白溶液+100 μL MTM/只在3周、6周各注射1次。注射方式:所有分组均为皮下注射,PBS组和BCG组分别为0周注射1次;佐剂MTM组免疫共3次,间隔2周;Rv3621c/MTM组同上;BCG+Rv3621c/MTM组需在0周时注射BCG,3周后,以Rv3621c/MTM注射2次进行增强免疫,每3周注射1次。
1.7 小鼠血清IgG、IgG1、IgG2a水平的检测 待小鼠免疫9周之后摘除眼球取血并收集血清,开展间接ELISA检测血清中特异性抗体分泌水平,出现阳性结果的最高稀释倍数的倒数即可表示抗体滴度。小鼠血清结果用log10(抗体滴度)表示。确定各组抗体滴度的平均值和标准差,并进行相应统计分析。以IgG2a和IgG1实际测得的稀释倍数计算IgG2a/IgG1比值。
1.8 ELISA检测脾细胞中抗原特异性IFN-γ、TNF-α、IL-2和IL-4分泌水平 超净工作台内无菌摘取小鼠脾脏,并分离计数,对100 μL的2.5×107/mL脾细胞进行重悬,并将重悬后溶液加入24孔板中。阳性对照、阴性对照及实验组中分别加入PPD工作液(10 μg/孔)、RPMI1640培养基及Rv3621c蛋白(10 μg/孔)。37 ℃孵育72 h后,离心并收集上清,参考鼠ELISA检测试剂盒(购自杭州MULTI SCIENCES,鼠IFN-γ ELISA试剂盒批号:A28090243;鼠TNF-α ELISA试剂盒批号:A28281211;鼠IL-2 ELISA试剂盒批号:A20290342;鼠IL-4 ELISA试剂盒批号:A20490434)进行试验。
1.9 qRT-PCR检测肺脏组织细胞因子表达水平 超净工作台内无菌摘取小鼠肺脏,借助TRIzol法实现RNA样本提取,将IFN-γ、TNF-α、IL-10和iNOS序列作为模板设计逆转录引物。参考SYBR Green Kit试剂盒(购自北京TIANGEN,批号:S8217)进行逆转录以及定量PCR试验。操作时需以GAPDH作为内参,并计算其差异水平。
1.10 统计学分析 使用SPSS18.0软件进行数据分析。采用非参数U检验进行人群实验数据分析,采用单因素方差检验进行小鼠免疫原性相关指标分析。检验水准α=0.05。
2 结 果
2.1 重组质粒pPROEX-Rv3621c构建和鉴定 经PCR扩增出序列片段,大小为1 242 bp,插入空载体pPROEX后,重组质粒pPROEX-Rv3621c成功构建(图1A),经BamHⅠ和XhoⅠ双酶切鉴定无误(图1B)。

A:construction pattern of recombinant plasmid pPROEX-Rv3621c;B:pPROEX-Rv3621c restriction enzyme digestion图1 重组质粒pPROEX-Rv3621c构建和酶切鉴定Fig.1 Construction and identification of recombinant plasmid pPROEX-Rv3621c
2.2 重组质粒pPROEX-Rv3621c表达、纯化和免疫印迹分析 重组质粒pPROEX-Rv3621c转入E.coliBL21(DE3)感受态细胞后经IPTG诱导培养,表达的rRv3621c蛋白经超声破碎后,再以变性条件经Ni-NAT柱进行纯化,获得蛋白产物,分子量为45.5 kDa,与预计结果相符(图2A),之后经Western blot鉴定其表达成功(图2B)。

A: Expression and purification of rRv3621c (M: protein marker, 1: recombinant bacteria without induction, 2: whole bacterial fluid of recombinant bacteria under the induction of IPTG, 3: supernatant of recombinant bacteria induced by IPTG after sonication, 4: effluence of rRv3621c through a chromatographic column, 5: effluence after washing with 8 M urea-binding solution, 6-9: eluted rRv3621c protein after chromatography); B: Identification of rRv3621c by western blotting (M: protein marker, 1: pPROEX empty vector, 2: purified rRv3621c and the relative antibodies)图2 rRv3621c表达、纯化和免疫印迹分析Fig.2 Expression, purification, and western blot analysis of rRv3621c
2.3 ATB、LTBI和健康人群接受Rv3621c诱导后特异性IFN-γ分泌水平比较 委托安徽省淮南市肿瘤医院检验科筛选40例受试者(健康对照者10例、ATB患者14例和LTBI受试者16例),均符合临床诊断标准。与健康对照者相比,ATB患者外周血中淋巴细胞接受rRv3621c诱导后分泌IFN-γ水平明显较高(t=4.813,P<0.01),与LTBI人群相比,ATB患者外周血中淋巴细胞分泌IFN-γ水平明显较高(t=4.442,P<0.01);接受PHA诱导时,M.tb感染者和健康对照者分泌IFN-γ水平差异无统计学意义(t=0.736,P>0.05)(图3)。
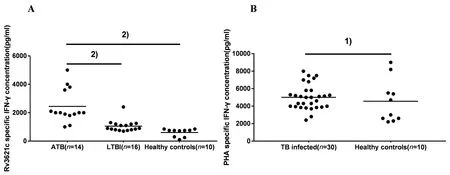
A: Specific IFN-γ concentration of rRv3621c-WBIA; B: Specific IFN-γ concentration of PHA-WBIA; 1) P>0.05; 2) P<0.01图3 人群外周血淋巴细胞接受rRv3621c蛋白和PHA诱导后分泌的IFN-γ水平Fig.3 IFN-γ levels in peripheral blood lymphocytes after induction by rRv3621c protein or PHA
2.4 小鼠血清中特异性IgG、IgG1、IgG2a抗体滴度水平比较 BCG+Rv3621c/MTM组产生的特异性抗体水平高于Rv3621c/MTM组(q(IgG)=16.52,q(IgG1)=9.033,q(IgG2a)=7.189,均P<0.01)和BCG组(q(IgG)=41.85,q(IgG1)=30.12,q(IgG2a)=32.3,均P<0.01),差别均具有统计学意义;Rv3621c/MTM组和BCG+Rv3621c/MTM组的IgG2a/IgG1明显高于BCG组和MTM组(q(Rv3621c/MTM组vsBCG组)=7.87,q(Rv3621c/MTM组vsMTM组)=6.288,q(BCG+Rv3621c/MTM组vsBCG组)=7.624,q(BCG+Rv3621c/MTM组vsMTM组)=6.041,均P<0.01),IgG2a/IgG1比值>1,表明rRv3621c蛋白主要诱导CD4+Th1型细胞反应的免疫应答(图4)。
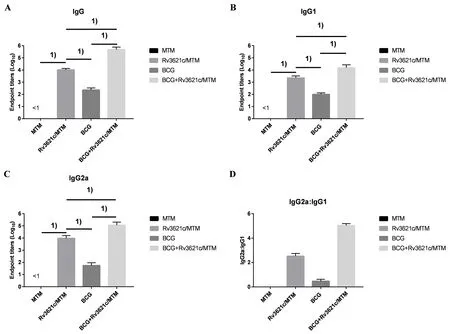
Endpoint titers of A: IgG, B: IgG2a, C: IgG1, D: IgG2a:IgG1 in mice serum after different treatments; 1) P<0.01图4 小鼠血清特异性IgG、IgG1、IgG2a抗体滴度Fig.4 Specific IgG, IgG1, and IgG2a antibody titers in mouse serum
2.5 小鼠脾细胞内特异性Th1型细胞因子分泌水平比较 各组小鼠以PPD或rRv3621c刺激后,IFN-γ、TNF-α和IL-2分泌水平最高为BCG+Rv3621c/MTM组,最低为PBS组(F(PPD-IFN-γ)=1514.9,F(PPD-TNF-α)=2672.3,F(PPD-IL-2)=147.48,F(rRv3621c-IFN-γ)=2395.2,F(rRv3621c-TNF-α)=10049,F(rRv3621c-IL-2)=153.16,均P<0.01),且Rv3621c/MTM组明显高于MTM组(q[PPD-IFN-γ(Rv3621c/MTM组vsMTM组)]=27.07,q[PPD-TNF-α(Rv3621c/MTM组vsMTM组)]=43.59,
q[PPD-IL-2(Rv3621c/MTM组vsMTM组)]=8.207,
q[rRv3621c-IFN-γ(Rv3621c/MTM组vsMTM组)]=61.31,
q[rRv3621c-TNF-α(Rv3621c/MTM组vsMTM组)]=142.1,
q[rRv3621c-IL-2(Rv3621c/MTM组vsMTM组)]=12.78,均P<0.01)。接受PPD刺激时,BCG组小鼠IFN-γ、TNF-α和IL-2分泌水平明显高于Rv3621c/MTM组(q[PPD-IFN-γ(Rv3621c/MTM组vsBCG组)]=23.33,
q[PPD-TNF-α(Rv3621c/MTM组vsBCG组)]=32.16,
q[PPD-IL-2(Rv3621c/MTM组vsBCG组)]=3.447,均P<0.05),差异有统计学意义;小鼠接受rRv3621c刺激时则反之(q[rRv3621c-IFN-γ(Rv3621c/MTM组vsBCG组)]=24.09,
q[rRv3621c-TNF-α(Rv3621c/MTM组vsBCG组)]=65.98,
q[rRv3621c-IL-2(Rv3621c/MTM组vsBCG组)]=8.178,均P<0.01)。小鼠接受诱导后,各组IL-4表达水平无统计学意义(F(PPD-IL-4)=2.4161,F(rRv3621c-IL-4)=1.9117,均P>0.05),PBS组明显低于其他各组(q[PPD-IL-4(MTM组vsPBS组)]=3.802,
q[PPD-IL-4(Rv3621c/MTM组vsPBS组)]=6.339,
q[PPD-IL-4(BCG组vsPBS组)]=7.638,
q[PPD-IL-4(BCG+Rv3621c/MTM组vsPBS组)]=6.672,
q[rRv3621c-IL-4(MTM组vsPBS组)]=3.845,
q[rRv3621c-IL-4(Rv3621c/MTM组vsPBS组)]=5.787,
q[rRv3621c-IL-4(BCG组vsPBS组)]=5.263,
q[rRv3621c-IL-4(BCG+Rv3621c/MTM组vsPBS组)]=7.282,均P<0.05)(图5)。
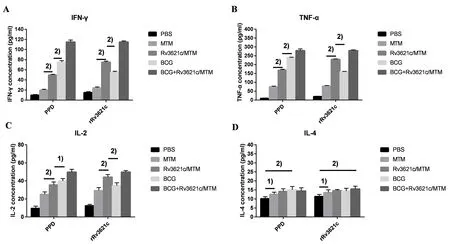
A: IFN-γ, B: TNF-α, C: IL-2, and D: IL-4 concentrations in the splenocytes of mice after different treatments; 1) P<0.05; 2) P<0.01图5 小鼠脾细胞抗原特异性IFN-γ、TNF-α、IL-2和IL-4分泌水平Fig.5 Antigen-specific IFN-γ, TNF-α, IL-2, and IL-4 secretion levels in splenocytes of mice
2.6 小鼠肺脏组织细胞因子IFN-γ、TNF-α、IL-10和iNOS表达水平比较 小鼠肺脏组织中IFN-γ、TNF-α和iNOS等细胞因子的表达水平呈差异性(F(IFN-γ)=4604.8,F(TNF-α)=830.49,F(iNOS)=369.3,均P<0.01)。其中,MTM组表达水平最低,而BCG+Rv3621c/MTM组表达水平最高。对于IFN-γ、TNF-α而言,Rv3621c/MTM组表达水平均明显高于BCG组(q(IFN-γ(Rv3621c/MTM组vsBCG组))=36.75,q(TNF-α(Rv3621c/MTM组vsBCG组))=9.306,均P<0.01)。此外,各组小鼠肺脏组织中IL-10表达水平均较低,且差异无统计学意义(F(IL-10)=3.166 1,均P>0.05)(图6)。

mRNA expression levels of A: IFN-γ, B: TNF-α, C: iNOS, D: IL-10 in the lungs of mice after different treatments; 1) P<0.01图6 小鼠肺脏IFN-γ、TNF-α、IL-10和iNOS的mRNA表达水平Fig.6 mRNA expression levels of IFN-γ, TNF-α, IL-10, and iNOS in the lungs of mice detected by qRT-PCR
3 讨 论
BCG的诞生和应用在TB的预防史中具有里程碑意义,但由于环境以及基因型的改变,BCG无法长期有效地提供免疫保护力。因此需要研发新型TB疫苗以弥补BCG之不足。而如何筛选具有较高水平免疫原性的特异性M.tb抗原,则是TB疫苗研制策略的重中之重。本课题靶向具有重要意义的RD区抗原,成功构建并原核表达M.tbRD区基因Rv3621c,通过人群外周血实验和免疫小鼠实验验证其是否能够被人及小鼠T细胞识别、机体是否可以产生较高水平的Th1型免疫应答及rRv3621c是否可以作为BCG初免后的理想增强疫苗。
遗传学研究表明,RD区基因虽然处于M.tb菌株中,但在所有BCG菌株中均不表达。近年来RD区抗原(尤其是RD1和RD2区抗原)在TB诊断及疫苗改良方面的研究较为深入。如Lewis等[4]从M.tb菌株的H37Rv中敲除RD1区基因,检测其毒力与BCG对照组相当,从而揭示RD1内或受RD1控制的基因对维持M.tb的毒力必不可少,其缺失对BCG的衰减具有重要影响。Mustafa[5]发现RD2区编码的Rv1980c(MPT64)和Rv1984c(CFP21)均可诱导机体产生强烈的细胞免疫应答。M.tb基因组RD9区家族具有重要的研究价值。Teo等[6]发现对RD9区基因进行PCR有便于检测BCG效果。李明等[7]通过表达RD9区Mb1230序列得到重组蛋白,有助于高特异性TB诊断。
Rv3621c亦属于RD9区家族,我们通过研究证实了rRv3621c可使得ATB患者外周血淋巴细胞受诱导从而分泌高水平IFN-γ,其明显高于LTBI感染者和健康对照者,提示Rv3621c可被M.tb感染者外周血T淋巴细胞特异性识别。本研究提示Rv3621c在M.tb感染者尤其是ATB患者中具有较高特异性,可作为候选靶抗原应用于TB疫苗和诊断研究中。有研究表明,TB免疫力越强,Th1型免疫应答水平越高,主要表现为高水平的抗原特异性IFN-γ,而IFN-γ、IFN-γ/IL-2等多功能应答效应更强烈时,效应性和记忆性CD4+及CD8+T细胞直接受到影响,提示其是评价候选疫苗靶抗原免疫原性的重要依据[8]。本研究发现,在Rv3621c/MTM组和BCG+Rv3621c/MTM组中,Rv3621c特异性Th1型细胞因子水平明显上升,提示其可为M.tb感染者提供较高的保护力。本研究同时证实,免疫小鼠6周后,Rv3621c/MTM和BCG+Rv3621c/MTM组小鼠血清IgG2a/IgG1>1,提示Rv3621c/MTM组小鼠体内Th1型免疫应答更加强烈。此外,试验结果证明,BCG+Rv3621c/MTM组小鼠体内肺脏中IFN-γ、TNF-α和iNOS表达水平最高。其中,iNOS有助于巨噬细胞分泌NO,从而吞噬细菌[9]。IL-10表达水平提示体液免疫应答水平,二者呈正比[10]。各组小鼠IL-10均呈较低表达水平且无显著差异,说明rRv3621c更加趋向Th1型细胞免疫应答反应,基本符合ELISA结果。本研究证实了Rv3621c作为靶抗原,可用于构建融合多阶段抗原的TB增强型疫苗,从而增强BCG的保护效力。
总之,本研究明确了淮南市M.tb感染者可对Rv3621c进行T细胞识别,并通过小鼠试验证明了Rv3621c的Th1型免疫应答作用。以上试验结果提示Rv3621c作为RD区抗原,可作为具有潜力的靶抗原应用于构建TB增强型新型疫苗(尤其是构建包含多个不同感染阶段抗原的融合亚单位疫苗),从而获得更高水平的保护力。本研究为研制具有高度抗M.tb感染保护性的疫苗奠定了免疫学基础。
利益冲突:无
