一种汉滩病毒和汉城病毒双重实时荧光定量RT-PCR检测方法的建立
2021-07-16刘师文李健雄
刘师文,熊 英,施 勇,李健雄,王 倩,龚 甜
汉坦病毒(hantavirus, HV)是世界范围内分布的对人类有严重不良影响的人兽共患病原体[1],其基因组由大(L)、中(M)、小(S) 3个分段的负义单链RNA组成。根据基因结构特点,已从动物和人类中发现的HV可分为50 多种基因型[2],它们在自然宿主中不引起症状性感染,但是在人类中经常引起两类急性发作传染病,即肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)和汉坦病毒肺综合征。据统计这两类疾病病死率分别可达15%和50%[3]。研究发现,HV感染严重程度与病毒型别、病毒RNA载量有关[4-5]。 中国是世界上HFRS疫情最严重国家,年报告病例数最高达到全世界90%,全国31 个省市自治区均有病例报告[6]。在我国,最主要流行的HV 为HTNV和SEOV。早诊断、早治疗对控制HFRS病死率非常关键。因此,建立HTNV 和SEOV双重实时荧光定量检测方法对病毒进行快速、准确、分型、定量检测,对指导HFRS临床救治、降低病死率有重要意义。目前HFRS病原荧光定量Realtime-PCR检测方法都存在一定的局限性。本研究在前期HV病毒分离、全基因组测序及构建的HTNV和SEOV 株S基因重组质粒菌株的基础上[7-8],以纯化的重组质粒作为定量标准品,选择汉坦病毒的S基因为目的基因设计引物探针,建立可以快速对HTNV和SEOV进行分型和定量检测的双重实时荧光定量RT-PCR方法为HFRS早期诊断、疾病防控提供技术手段。
1 材料与方法
1.1 菌、毒株及样品 pGEM®-T-SEOV和pGEM®-T-HTNV重组质粒DH5a菌株菌株为本实验室保存,分别以AYW89-15株(HTNV)和JiangxiXinjianRn-07-2011(SEOV)全S基因构建的重组菌株。血清样本为2017年HFRS 监测项目收集并于-80 ℃保存。
1.2 主要设备和试剂 荧光定量PCR仪(ABI7500型),超微量蛋白核酸分析仪(BioDrop),AgPath-ID TMOne-step RT-PCR Kit(Thermo fisher Scientific)、质粒纯化试剂盒(TAKARA)巢式RT-PCR反应液 :PrimScriptTMOne Step rt-pcr Kit Ver.2(TAKARA)、GoTaq®Green Master Mix (Promega)。
1.3 引物设计与合成 从GenBank 下载HTNV 和SEOV 全S基因参考序列,分别与AYW89-15株,JiangxiXinjianRn-07-2011株基因比对选定相对保守区域、应用CLC软件设计Taqman荧光引物探针,由上海生物工程有限公司合成。引物探针序列见表1。
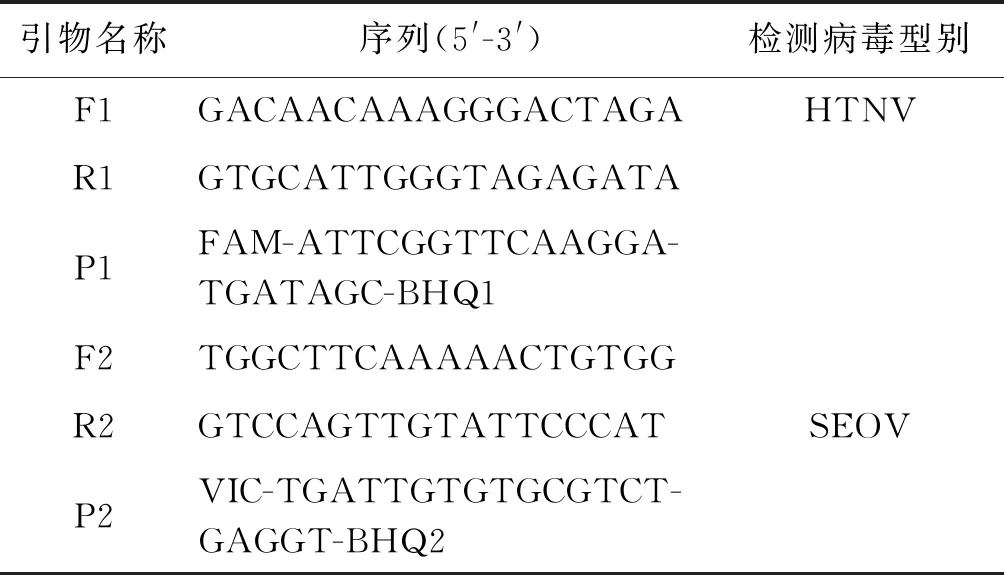
表1 HTNV和SEOV S基因引物探针序列Tab.1 Primer and probe sequences of the HTNV and SEOV S gene
1.4.1 重组质粒标准品制备 采用质粒纯化试剂盒提取pGEM®-T-SEOV和pGEM®-T-HTNV重组菌株的质粒, 通过BioDrop超微量蛋白核酸分析仪测得重组质粒浓度,然后根据阿伏伽德罗常数计算其拷贝数。
1.4.2 引物探针浓度及退火温度的优化 以1.0×104copies/μL阳性质粒为模板。体系总体积25 μL,其中RT-PCR buffer 12.5 μL;Enzyme Mix 1 μL,引物探针终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 μmol/L,其余用ddH2O补足;通过比较Ct值、扩增曲线和ΔRn值确定引物和探针终浓度。确定引物探针浓度,选择不同的延伸温度50 ℃、55 ℃、60 ℃进行测试、通过比较Ct值、扩增曲线和ΔRn值确定延伸温度。
1.4.3 标准曲线建立 将阳性质粒从107→10-1copies/μL的10倍系列稀释物作为模板,设阴性对照,按照优化后的PCR反应体系进行荧光RT-PCR检测。由荧光PCR检测软件绘制标准曲线,确定最低检出限。
1.4.4 重复性实验 选取102、103、104copies/μL的阳性质粒用建立的方法进行检测,每个浓度平行做3管,计算每个浓度Ct值的批内变异系数。每个浓度标准品分别进行3次重复试验,计算每个浓度Ct值的批间变异系数。
1.4.5 特异性实验 以本实验室保存的甲型流感病毒、登革热病毒、新布尼亚病毒、寨卡病毒、新冠病毒阳性核酸为模板,同时设阳性对照(阳性质粒104copies/μL)和阴性对照,进行检测,验证所建立方法的特异性。
1.5 血清样本检测 选取10份2017年江西省HFRS急性期血清样本(样本编号:JXhu04-17、JXhu10-17、JXhu14-17、JXhu27-17、JXhu11-17、JXhu33-17、JXhu39-17、JXhu46-17、 JXhu47-17、JXhu51-17),进行核酸提取,用建立方法和巢式RT-PCR方法进行检测分型,分析所建立方法对临床样本的适用性。HV M基因巢式RT-PCR分型方法参照《肾综合征出血热监测方案(试行)》,第一次RT-PCR采用HV通用外引物,引物序列为HVF: 5′-AAAGTAGGTGITAYATCYTIACAATGTGG-3′,HVR: 5′-GTACAICCTGTRCCIACCCC-3′,反应条件: 50 ℃ 30 min; 94 ℃ 2 min;(94 ℃ 30 s、52 ℃ 45 s、72 ℃ 1 min)35循环;72 ℃,10 min。第一次RT-PCR结束后以扩增产物为模板,分别采用HTNV/SEOV分型引物进行二次PCR,HTNV分型引物序列HTNVF: 5′-GAATC-GATACTGTGGGCTGCAAGTGC-3′, HTNVR: 5′-GGATTAGAACCCCAGCTCGTCT-3′,目的产物382 bp。SEOV分型引物序列SEOVF: 5′GTGGACTCTTCTTCTCATTATT-3′, SEOVR: 5′T-GGGCAATCTGGGGGGTTGCATG-3′,目的产物 417 bp。二次PCR条件:95 ℃,4 min;(94 ℃ 30 s、56 ℃ 30 s、72 ℃ 45 s)35循环;72 ℃,10 min。通过1.2%琼脂糖凝胶电泳结果判断样品病毒基因型。
2 结 果
2.1 重组质粒标准品制备 经BioDrop超微量蛋白核酸分析仪测得HTNV 和SEOV重组质粒标准品浓度分别为140.4 μg/mL、120.2 μg/mL,换算成拷贝数分别为2.72×1010copies/μL,2.28×1010copies/μL。
2.2 引物探针浓度及退火温度的优化 根据Ct值最低、ΔRn值最高的原则确定体系引物探针终浓度均为0.5 μmol/L,延伸温度为55 ℃。优化后反应体系: RT-PCR buffer 12.5 μL;Enzyme Mix 1 μL,HTNV和SEOV引物探针各0.5 μL(共3 μL),ddH2O 3.5 μL,模板5 μL。PCR反应条件:45 ℃ 10 min;95 ℃ 10 min;95 ℃ 15 s,55 ℃ 45 s(采集荧光),45个循环。
2.3 标准曲线建立 HTNV和SEOV重组质粒标准品扩增曲线见图1,随着核酸浓度的降低呈现明显的下降的荧光信号,9个浓度(107→10-1copies/μL)标准品中,HTNV 和SEOV均有7个(107→10 copies/μL)浓度出现扩增曲线。HTNV 和SEOV检测标准曲线见图2和图3。方程式分别为Y(Ct)=-3.985X(对数值)+41.982,(HTNV扩增效率:95.4,相关系数R2为0.998);Y(Ct)=-4.291X(对数值)+43.03, (SEOV扩增效率:92.1,相关系数R2为0.999)。HTNV 和SEOV最低检出限均为10 copies/μL。
在描述学校的校园氛围时,使用频率最多的为欢快的交响曲(29.51%)、文化盛宴(24.36%),认为学校的校园氛围很快乐和温馨、文化气息浓厚。而选一潭死水(21.78%)、枯藤朽木(24.36%)的学生认为学校的校园氛围整体不好,缺乏活力。

图1 HTNV 和SEOV重组质粒标准品(107→10-1 copies/μL)扩增曲线Fig.1 Amplification curves of nine 1∶10 dilutions ranging from 107 copies/μL to 10-1 copies/μL of recombined plasmid

图2 HTNV和SEOV阳性质粒(107→10 copies/μL)标准曲线图Fig.2 Standard curves for HTNV and SEOV were constructed with seven 1∶10 dilutions ranging from 107 copies to 101 copies of recombined plasmid
2.4 重复性实验 不同浓度阳性质粒的Ct平均值和批内变异系数见表2,不同浓度各做3管,每个浓度Ct值的批内变异系数小于2%。每个浓度进行3次重复试验,计算每个浓度Ct值的批间变异系数,结果见表3, 批间差异小于2%。

表2 不同浓度阳性质粒批内Ct平均值和变异系数Tab.2 Ct variations of three 1∶10 dilutions ranging from 102 copies to 104 copies/μL in the same assay
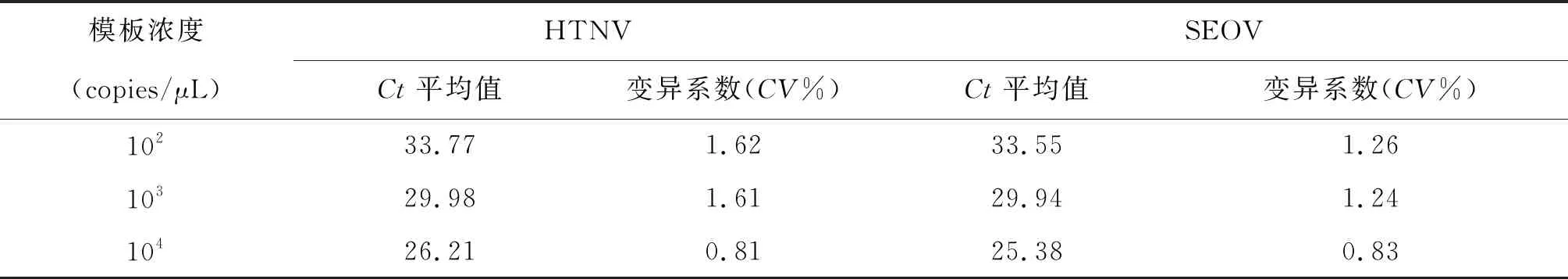
表3 不同浓度阳性质粒批间Ct平均值和变异系数Tab.3 Ct variations of three 1∶10 dilutions ranging from 102 copies to 104 copies/μL in different assays
2.5 特异性实验 以甲型流感病毒、登革热病毒、新布尼亚病毒、寨卡病毒、新冠病毒阳性核酸为模板,同时设阳性对照(阳性质粒)和阴性对照进行荧光定量RT-PCR测定方法的特异性,结果见图3,由图可见除SEOV和HTNV阳性对照外,其他5种病毒均无非特异性扩增。

图3 HTNV和SEOV双重实时荧光定量RT-PCR特异性实验Fig.3 Specificity of HTNV and SEOV duplexes in real-time quantitative RT-PCR
2.6 血清样本检测 10份血清标本经双重实时荧光RT-PCR检测,扩增曲线图见图4,其中阳性对照出现扩增曲线,阴性对照未出现扩增曲线, 9份为HTNV型(图4-B), 1份为SEOV型(图4-C,JXhu11-17)。巢式RT-PCR电泳结果见图5,除JXhu11-17为SEOV ,其余9份均为HTNV。2种方法检测结果一致。
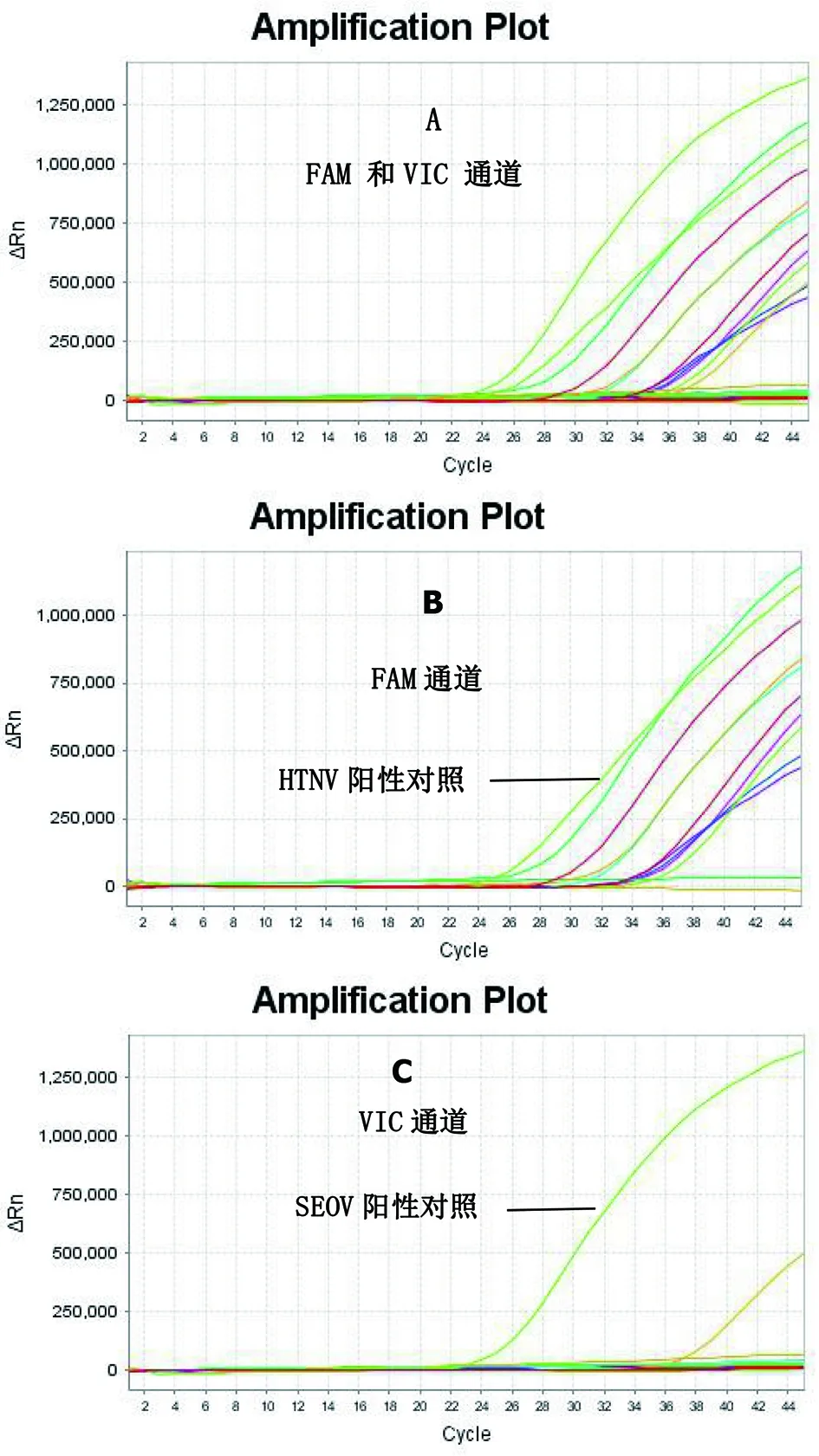
图4 10份肾综合征出血热病例血清样本双重实时荧光RT-PCR扩增曲线图Fig.4 Amplification curves of 10 serum samples of HFRS patients by duplex real-time RT-PCR assay

泳道1、12为DL2000Maker,泳道2-11依次为JXhu04-17、JXhu10-17、JXhu14-17、JXhu27-17、JXhu11-17、JXhu33-17、JXhu39-17、JXhu46-17、 JXhu47-17、JXhu51-17,HTNV分型引物PCR的产物,泳道13-22依次为上述10个样品SEOV分型引物PCR的产物图5 10份HFRS血清样本巢式RT-PCR产物电泳图Fig.5 Electrophoresis of nested RT-PCR products of 10 HFRS serum samples
3 讨 论
HFRS病情复杂,临床表现多样,漏诊率及误诊率高[9]。疾病早期有效的诊断方法对HFRS患者早发现、早治疗,降低病死率,减轻疾病负担起到非常重要的作用。目前HFRS早期诊断主要包括血清学检测和基因检测2个方面。血清学检测常用的方法酶联免疫吸附试验(ELISA),免疫层析试纸条等,主要是检测HV特异性IgM和IgG。血清学检测有快速、简便的优点,因抗体易在病毒亚型之间产生交叉反应,不能用于病毒的分型,而且血清学检测存在窗口期。基因检测主要采用RT-PCR[10],大多数HV RT-PCR均采用巢式PCR方法[11],克服了普通RT-PCR灵敏度低的特点,但是检测时间长,操作步骤多也增加了污染的风险[12]。荧光定量Realtime-PCR具有快速、灵敏、特异性高且污染小、可实时定量并易于标准化的特点已经成为病毒分子诊断中最常用的技术[13]。
目前市场上HFRS汉坦病毒双重荧光PCR试剂非常少且价格昂贵,文献报道的荧光定量Realtime-PCR检测方法都存在一定的局限性。杨鹏飞 等[14]建立了汉坦病毒通用型实时荧光定量RT-PCR 方法,该方法采用一对引物一条探针可实现对5种不同基因型别汉坦病毒进行检测,广谱性好,但是该方法不能实现病毒的分型检测;何芳等[15]报道新型实时荧光定量RT-PCR方法,灵敏度高、对HTNV 的最低检出限为4.08 copies/μL,该方法仅能检测HTNV,不适合HTNV和SEOV混合疫区使用;胡丹等[16]建立的汉坦病毒实时荧光定量PCR方法,能分型检测,HTNV和SEOV最低检测限为10 copies/μL,但是不能实现同一反应管HTNV和SEOV双重靶标检测,不能有效的节约试剂成本,也未见临床样本的应用情况。
本研究根据HV S基因设计引物探针,建立HTNV和SEOV双重实时荧光定量RT-PCR检测方法,对2种型别病毒的最低定量限均为10 copies/μL, 灵敏度高;不同浓度质粒标准品Ct批内和批间差异均小于2%,重复性好;与甲型流感病毒、登革热病毒、新布尼亚病毒、寨卡病毒、新冠病毒均无交叉反应,特异性强;对10份血清样本进行检测,结果与巢式RT-PCR一致,说明建立的方法适用于临床肾综合征出血热HTNV和SEOV的检测。本方法的试剂成本仅为商品化的双重荧光RT-PCR试剂盒的1/5左右,检测成本低廉,适用于大规模检测。
综上,本研究建立的双重荧光定量RT-PCR方法可以快速准确地对HTNV和SEOV进行分型和定量检测,适用于肾综合征出血热临床早期诊断。
利益冲突:无
