一株茶渣分解菌Fb的分离及其应用
2021-07-16缪伏荣陈鑫珠李忠荣
缪伏荣,陈鑫珠,李忠荣,刘 景
(福建省农业科学院畜牧兽医研究所,福建 福州 350013)
0 引言
【研究意义】茶渣是茶饮料、速溶茶和茶单宁产业等加工茶叶后产生的残渣,据统计,仅茶饮料和速溶茶公司每年产生的茶渣就达16万t[1]。研究表明,干基的茶渣粗蛋白质含量为17%~25%,是一种良好的蛋白质饲料资源[2-4]。日本的佐野满昭[5]在饲料中添加3%的茶渣喂养肉鸡,可提高鸡肉的嫩度和脂溶性抗氧化物(VE、VC)含量,降低鸡肉脂质过氧化物含量。徐瑞等[6]研究表明,在日粮中添加2%的茶叶渣能提高育肥猪的生长性能,改善猪肉的色泽和保水性能。吴慧敏[7]研究发现在蛋鸡的日粮中添加1%~2%的茶渣不仅显著增加产蛋数和蛋重观察蛋鸡的生产性能,还能显著提高血清中的GSH-Px,T-SOD,IgA,IgM含量,同时显著的降低血清中的胆固醇含量。马帮军[8]研究表明,猪日粮中添加茶粉1%~3%会降低猪的平均日增重,但显著降低猪背膘厚度,减少脂肪在猪胴体中的沉积。潘发明[9]等则认为饲粮中添加茶渣比例过高,会影响适口性,降低绵羊采食量。主要原因是茶渣粗纤维含量高,畜禽纤维素酶活力低,不利于消化吸收;另一原因,刚出产的茶渣水分达到80%不易储藏和运输,因此仅有小部分的茶渣作为饲料源利用,绝大部分茶渣被丢弃或掩埋;这不仅造成资源浪费,而且造成生态环境污染[10-11]。【前人研究进展】为了更好利用茶渣资源,刘姝等[12]利用木霉等组合微生物发酵茶渣,在30 ℃下发酵4~8 d后发现,饲料中粗蛋白测定含量>25%,比对照提高了20%,其营养价值达到了仔猪配合饲料中粗蛋白的含量。胡桂萍等[13]以提取茶多酚后的茶渣为发酵原料,利用乳杆菌、枯草芽孢杆菌、酵母菌和米曲霉菌进行常温(25~35 ℃)的厌氧固态发酵5~7 d,测定发现发酵产品中粗蛋白含量达29.49%。倪星虹[14]以混合菌种经温度28 ℃发酵7 d后,测定发现茶渣发酵产物中蛋白质含量提高了60.78%。朱飞等[1]利用黑曲霉在添加5%玉米粉的茶渣中进行固态发酵,经自然pH、37 ℃、8 d条件下发酵后,茶渣的营养价值显著提高。贝莱斯芽孢杆菌(Bacillus velezensis)是2005年由Ruiz-Garcia等[15]新命名的一种生防菌,是芽孢杆菌属的一个新种[16-19]。国内外已有学者研究表明Bacillus veiezensis能产生具有广谱抗菌活性的次生代谢产物,包括纤维素酶、蛋白酶以及多种抗菌的活性物质,是用来增加作物产量、维护生态环境和农业生态系统的首选生物药剂[20-26]。贝莱斯芽孢杆也作为水产养殖的益生菌[27]。 Liu X Y等[28]对从海洋微生物中筛选到菌株Bacillus velezensis H3的发酵培养基和拮抗物质进行研究,发现该菌株的活性物质是一种替代性的表面活性素,有较高的研究价值。【本研究切入点】茶渣经发酵后虽然能在一定程度上提高茶渣的营养价值,但发酵温度均不超过37 ℃,发酵效率低,时间长,易被杂菌污染。因此有必要筛选能适合高效分解茶渣的高温菌株。但鲜见贝莱斯芽孢杆菌(Bacillus velezensis)在降解工农业副产物的研究报道。【拟解决的关键问题】本研究从堆积废弃茶渣中分离获得既耐高温又能产生高酶活的贝莱斯芽孢杆菌Fb,对其进行形态学、生理生化以及分子生物学鉴定,同时研究其最适的生长条件,分解茶渣的效果,为后续的茶渣开发研究奠定理论的基础。
1 材料与方法
1.1 试验材料
LB培养液(L):酵母粉10 g,蛋白胨10 g,牛肉浸膏5 g,NaCl 10 g,pH 5.5~6.0。
纯化固体培养基:LB培养液中时加入20 g琼脂粉。
分离固体培养基:取新鲜茶渣50 g加蒸馏水500 ml蒸煮30 min,过滤后的茶渣液定容到200 ml,加入4 g琼脂粉。
液体发酵培养基:同LB培养液。
茶渣:采集于某地的茶饮料车间。将发酵前后的茶渣烘干,粉碎并过0.25 mm孔径筛,用四分法取样100 g。
主要仪器:LRH-250A生化培养箱,CRY-200恒温摇床,Multiskan MK3酶标仪,FOSS全自动凯氏定氮仪Kjeltec8400,FOSS2010纤维测定仪,menbarPureA300全自动氨基酸分析仪。
试剂:酵母粉、蛋白胨、NaCl等均为AR级、茚三酮染色剂、缓冲液、氨基酸标准液和稀释液均为 德国menbarPure公司。
1.2 试验方法
1.2.1 菌株的培养与分离 从某地多年堆积的茶渣处取样品10 g,加入盛有50 mL LB培养液的250 mL锥形瓶中,在42 ℃、120 r·min-1条件下富集培养24 h,取2 mL培养物接种到新鲜的LB培养液,以相同的条件重复培养3次。富集培养物在分离固体培养基上划线培养,42 ℃培养24 h。挑取生长明显的菌落进行复筛。将初筛菌落在纯化固体培养基上划线分离3次,以获得纯培养物,并依据菌种在分离固体培养基的生长情况,挑取有不同形态特征的单菌落,于42 ℃ LB培养基上分别扩繁后加20%甘油混匀 ,于-80 ℃条件下保存。
本研究对2016年1月1日—2017年12月31日于哈尔滨医科大学附属肿瘤医院腔镜科使用超细鼻胃镜的患者进行回顾性分析,共计160例,年龄36~91岁,男性136例,女性24例,平均年龄分别为61.54±10.34岁和61.38±10.00岁,包含门诊与住院患者,患者均一般状态尚可,在清醒状态下完成内镜下诊疗,无术后并发症。病变狭窄类型主要为消化道癌症、术后吻合口良性与复发性狭窄、外压性狭窄及不明原因性狭窄等,所有患者均因标准胃肠镜无法通过狭窄处而使用超细鼻胃镜。电子内镜均为奥林巴斯生产,标准胃镜的外径≤9.8 mm,标准肠镜的外径≤12.9 mm,而鼻胃镜的外径≤5.8 mm(表1)。
1.2.2 菌株产酶能力测定 将菌株活化24 h后挑取1环至液体发酵培养液中,42 ℃、120 r·min-1条件下培养48 h后,测定发酵液的蛋白酶、纤维素酶的活力。采用蒽酮比色法测定纤维素酶(CL)催化羧甲基纤维素钠降解产生的还原糖的含量[29]。每mL样本每分钟催化产生1 μg葡萄糖定义为一个酶活力单位(U)。酸性蛋白酶(ACP)、中性蛋白酶(NP)和碱性蛋白酶(AKP)的测定按照GB/T 23527—2 009和相关文献[30-31]执行。
1.2.3 菌落与菌体形态特征观察 菌株平板划线42 ℃分别培养16 h和25 h,在自然光下观察菌落形态 ;革兰氏染色后,观察菌株形态[32-33]。
1.2.4 菌株生理生化特性 试验参照文献[34-35]进行。
1.2.5 分子鉴定 菌株的分子鉴定用16S rDNA和gyrB基因进行[36]。利用NCBI网站的BLAST功能对所测的16S rDNA和gyrA序列进行同源性分析,确定亲缘关系,使用MEGA 5.0软件Neighbor-Joining[37-38]构 建系统发育树,进行1 000次的相似度重复计算。
1.2.6 菌株生长特性 测量菌株的生长曲线,判断最适生长温度[39];对其生长条件进行单因素试验如表1方案,分析不同因素对菌株生长的影响,其他培养条件和培养基相同,间隔2 h取样用酶标仪在波长630 nm测吸光度。每组设3个重复。
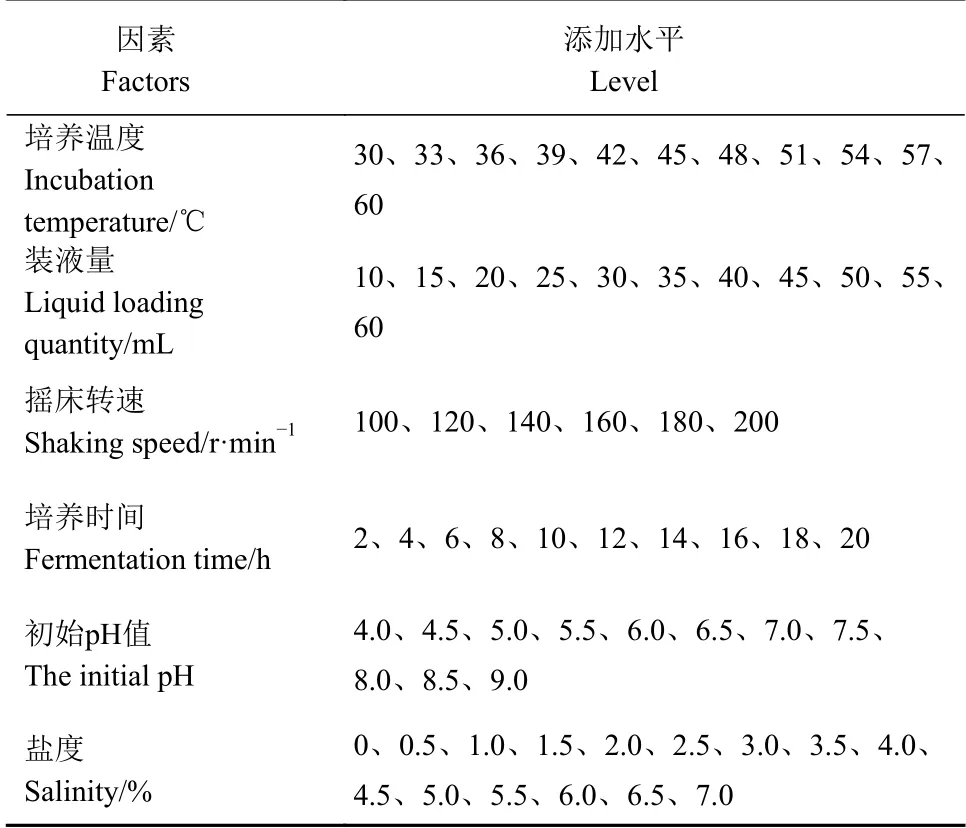
表1 菌株生长条件单因素试验Table 1 Single factor test on growth conditions of bacteria
1.2.7 茶渣降解分析 用回接方法,验证菌株对茶渣降解效果:对照组不添加菌剂;发酵组用LB菌株培养液进行扩大培养制成种子,将培养好的种子接入新鲜茶渣中,搅拌均匀使其菌浓度约为1×106CFU·g-1;对照组和发酵组各装入9个1 L的三角瓶,每瓶装量200 mg。两组同时放入42~45 ℃下的培养箱中;每天摇动三角瓶5 s,发酵7 d结束测定茶渣营养成分的变化。
常规成分测定[40]:粗蛋白、粗纤维和粗灰分分别按GB/T 6432—1994、GB/T 6433—2006和GB/T 6438—2007规定的方法执行。纤维的成分测定[40]:中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)和酸性洗涤木质素(ADL)测定根据GB/T 20806—2006和GB/T 20805—2006方法。氨基酸测定[41]:按GB/T 18246—2000方法,采用全自动氨基酸分析仪 (menbarPureA300)进行测定。
1.2.8 数据分析 所得数据用SPSS 16.0软件进行分析,F检验分析;采用氨基酸分析仪自带软件处理数 据。
2 结果与分析
2.1 菌株产酶能力比较
对5株菌的发酵液进行分析,产纤维素酶(CL)活力由高到低分别是DJ、8106、Fb、8116、HLH;酸性蛋白酶(ACP)活力由高到低分别是8106、8116、DJ、HLH、Fb;中性蛋白酶(NP)活力由高到低分别是8106、HLH、8116、DJ、Fb;碱性蛋白酶(AKP)活力由高到低分别是Fb、8116、8106、DJ、HLH(表2)。可见Fb菌产四种酶的活力均较强。

表2 菌株酶活力比较Table 2 Enzyme activities of selected strains
2.2 菌落与菌体形态特征
Fb菌在自然光下,LB培养基,42 ℃培养16 h,其菌落浅黄色,圆形,表面干燥,不透明,边缘不整齐,如图1。菌体呈杆状,(0.4~0.6) μm×(0.9~4.0) μm,单个或成对排列,菌体形态如图2;芽胞近圆形,近中部生见图3圆圈标记。
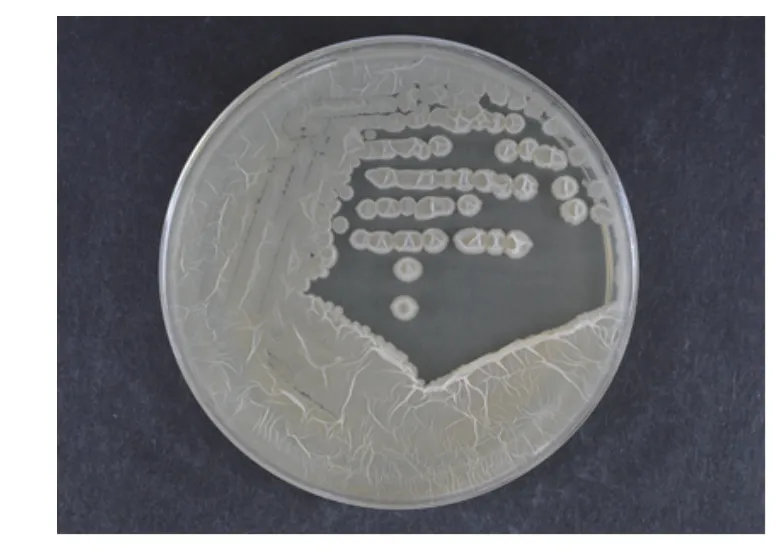
图1 FB菌落形态Fig. 1 Colony morphology (FB)
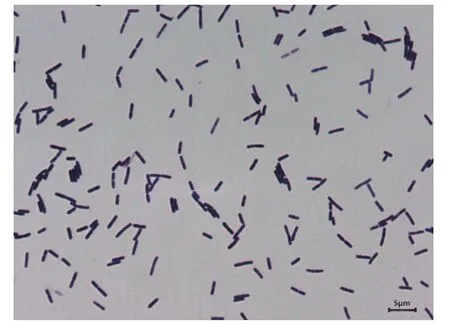
图2 菌体形态Fig. 2 Thallus morphology
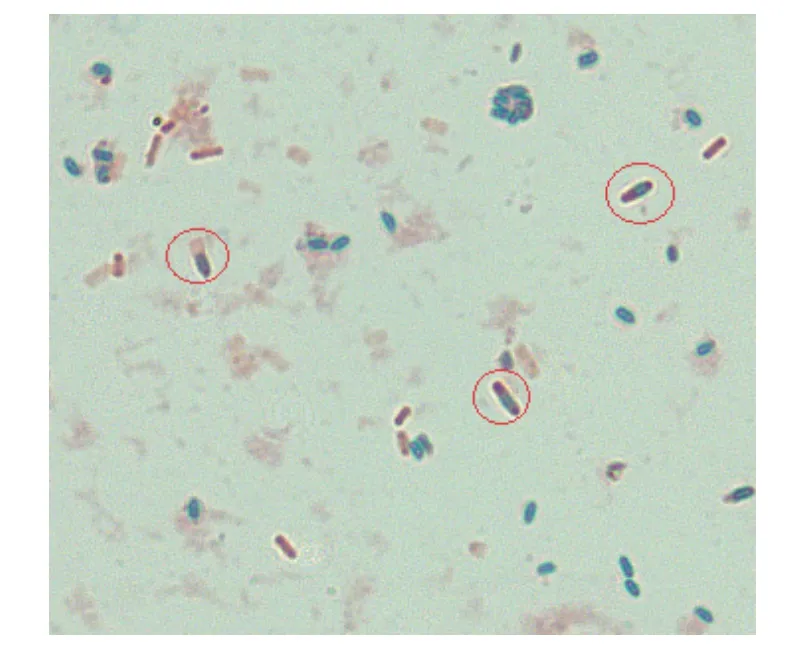
图3 芽孢形态Fig. 3 Strain morphology
2.3 菌株生理生化特性
由表3可知,Fb菌株能水解七叶苷;吲哚试验阳性;可在β-木糖苷酶、苯丙氨酸芳胺酶、α-半乳糖苷酶、丙氨酸-苯丙氨酸-脯氨酸芳胺酶、L-吡咯烷酮芳胺酶等酶中生长;能利用D-甘露醇、D-甘露糖、古老糖、D-海藻糖、D-葡萄糖、D-核糖等多种糖作为碳源生长;但不能利用肌醇、L-鼠李糖、菊粉、环糊精、N-乙酰-D-氨基葡萄糖、D-塔格糖、糖原、麦芽三糖、D-松三糖等。Fb菌株能在低剂量的抗生素中生长,不能在高剂量的卡那霉素耐药(0.2 g·L-1)、竹桃霉素耐药(0.1 g·L-1)、多粘菌素B耐药 (0.031 g·L-1)等培养基生长。

表3 Fb菌株生理生化特性Table 3 Characteristics of Fb
2.4 菌株的分子鉴定
利用NCBI数据库中的Blast程序分析结果表明,Fb菌株与Bacillus siamensisKCTC 13613T(AJVF 01000043)和Bacillus amyloliquefaciensDSM 7T(FN 597644)菌株的同源性最高,相似性达到99.93%。采用MEGA 5.0软件,邻位链接法显示Fb菌株与相关种的16S rDNA序列系统发育树(图4)。菌株gyrB测序分析表明,序列长1 176 bp。MEGA 5.0软件分析结果表明,其与Bacillus velezensisBCRC 17467T(DQ903176)的同源性较高,相似性达到100%。同理将该菌株与其他种属明确的10株菌的gyrB基因构建系统发育树(图5)。
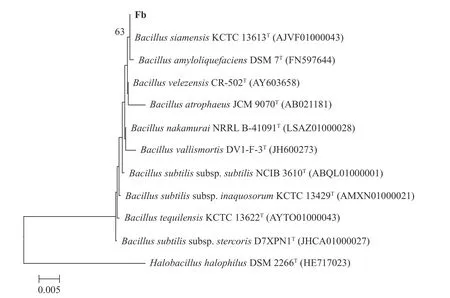
图4 基于16S rDNA的相似菌株系统发育树Fig. 4 Phylogenetic tree of strains based on 16S-rDNA differentiation

图5 基于gyrB的相似菌株系统发育树Fig. 5 Phylogenetic tree of strains based on gyrB homologies
结合菌株形态学、生理生化特性以及16S rDNA和gyrB的序列比较分析,将Fb菌株鉴定为贝莱斯芽孢 杆菌(Bacillus velezensis)。
2.5 菌株生长特征
2.5.1 Fb菌的生长曲线 从图6可以看出,随着培养温度的提高,菌株的细胞分裂加快,吸光值增加;Fb菌可在30~60 ℃下生长,其最适的生长温度 为39~54 ℃。
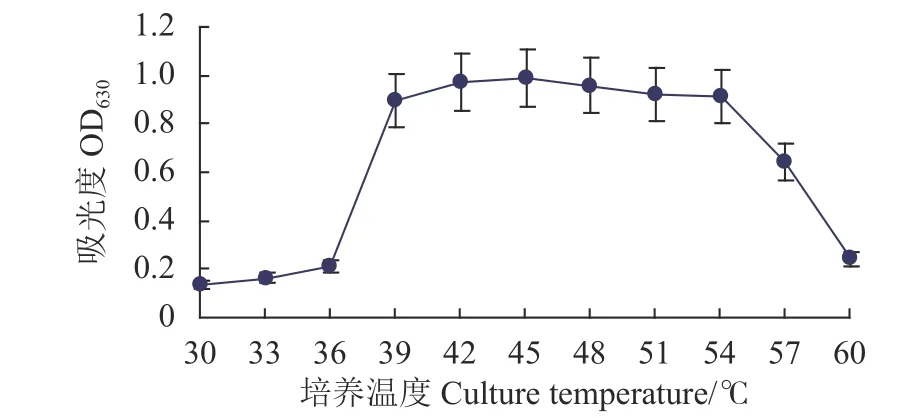
图6 培养温度对菌株生长的影响Fig. 6 Effect of temperature on Fb growth in culture
2.5.2 装液量和摇床转速对Fb菌生长的影响 摇床转速120 r·min-1时,随着装液量的增加,菌液的吸光值升高,至装液量30 mL时,Fb菌的吸光值达最高:0.97;再提高装液量,吸光值逐渐降低(图7)。从图8可知,装液量30 mL时,随着摇床转速的提高,吸光值升高,摇床转速为120 r·min-1时,Fb菌的吸光值达最高:0.98;再提高摇床转速,吸光值逐渐降低。表明Fb菌液体培养最佳装液量和摇床转速分 别为30 mL和120 r·min-1。

图7 装液量对菌株生长的影响Fig. 7 Effect of liquid volume on Fb growth in culture
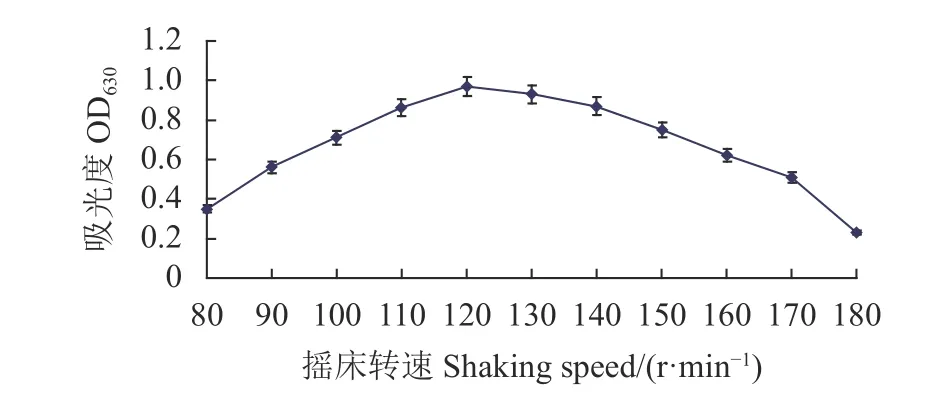
图8 摇床转速对菌株生长的影响Fig. 8 Effect of flask shaking speed on Fb growth in culture
2.5.3 培养时间对Fb菌生长的影响 图9为Fb菌在培养温度42 ℃下的生长曲线。0~6 h是菌体适应新环境的迟缓期,细胞分裂增殖缓慢;6~16 h为生长繁殖迅速的对数生长期;16 h的菌体吸光值最高0.974;16~18 h为稳定生长期;18 h后由于自溶酶作用或有毒代谢产物积累,细胞进入衰亡期裂解菌体吸 光值随之下降。表明Fb菌的最适培养时间为16 h。
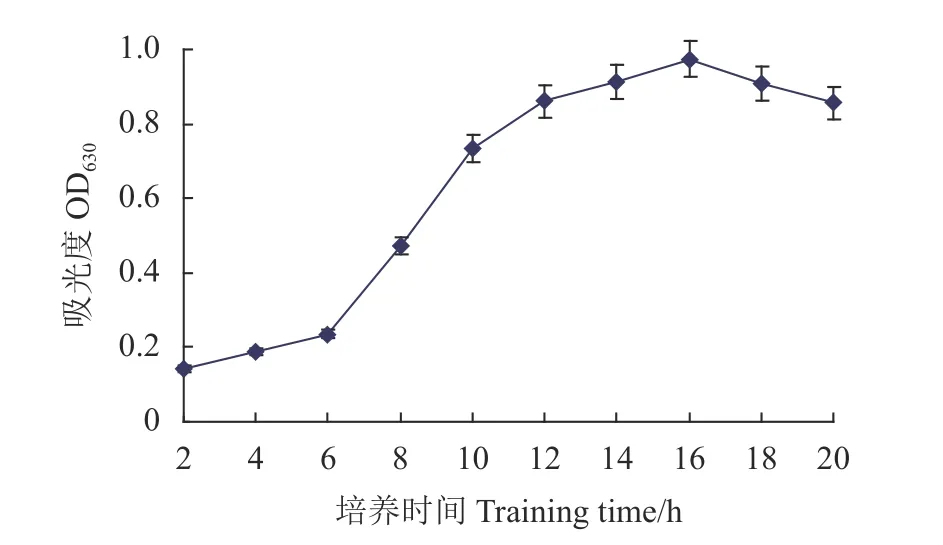
图9 培养时间对Fb菌生长的影响Fig. 9 Growth curve of cultured Fb
2.5.4 初始pH对Fb菌生长的影响 从图10可以看出,培养基初始pH 4.0~5.0时,菌体吸光值随pH的提高而提高;培养基初始pH 5.0~7.0范围内,Fb菌生物量较高且各组间差异不显著,均高0.93;再逐渐提高培养基的初始pH培养时,菌体吸光值随之下降;表明Fb菌的培养基最适初始pH为5.0~7.0。

图10 初始pH对Fb菌生长的影响Fig. 10 of initial pH on enzyme production of Fb
2.5.5 盐度对Fb菌生长的影响 从图11可以看出,培养液的盐度从0.0增加到1.0%,菌株的吸光值也从0.46增加到0.92;培养液的盐度为1.0%~6.0%,菌株的吸光值均大于0.92,无显著差异;6.0%~7.0%菌 株的吸光值下降至0.81。
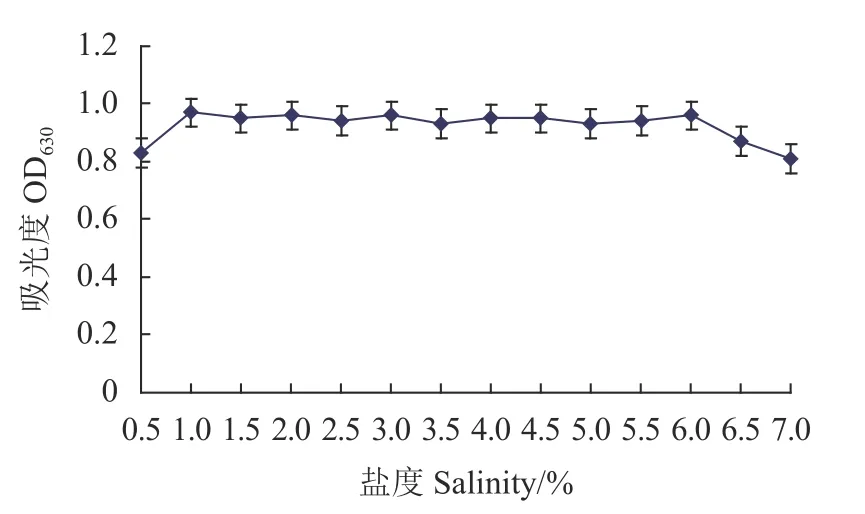
图11 盐度对菌株生长的影响Fig. 11 Effect of salinity on Fb growth in culture
2.6 菌株对茶渣降解效果
从茶渣常规营养成分分析看出(表4),发酵组比对照组粗蛋白提高14.88%,水分和粗纤维分别下降42.06%和9.69%,均存在显著差异。

表4 茶渣常规营养成分的变化(n=9)Table 4 Changes in nutritional composition of tea dregs with Fb inoculation (dry base, n=9) (单位:%)
从茶渣纤维成分分析发现(表5),发酵组比对照组的中性洗涤纤维、酸性洗涤纤维和木质素分别下降10.72%、4.47%和11.37%,均存在显著差异。
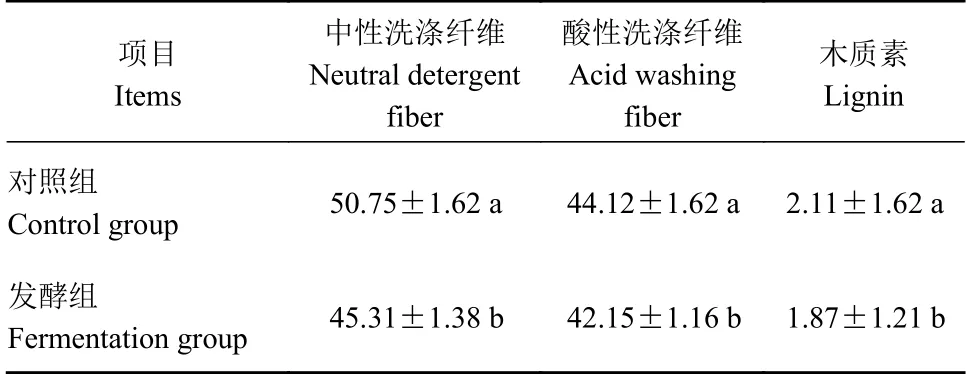
表5 茶渣纤维成分的比较(干基, n=9)Table 5 Change on fiber composition of tea dregs by treatment (dry base, n=9) (单位:%)
从茶渣氨基酸的组分和含量可以看出(表6),除胱氨酸、蛋氨酸和组氨酸发酵前后无差异外,两组均为谷氨酸含量最高,其次天冬氨酸;除胱氨酸、蛋氨酸和组氨酸发酵外,其他14种氨基酸含量均显著提高(P<0.05);氨基酸总量的变化与粗蛋白的变化一致,发酵后其含量提高5.98%,差异显著。
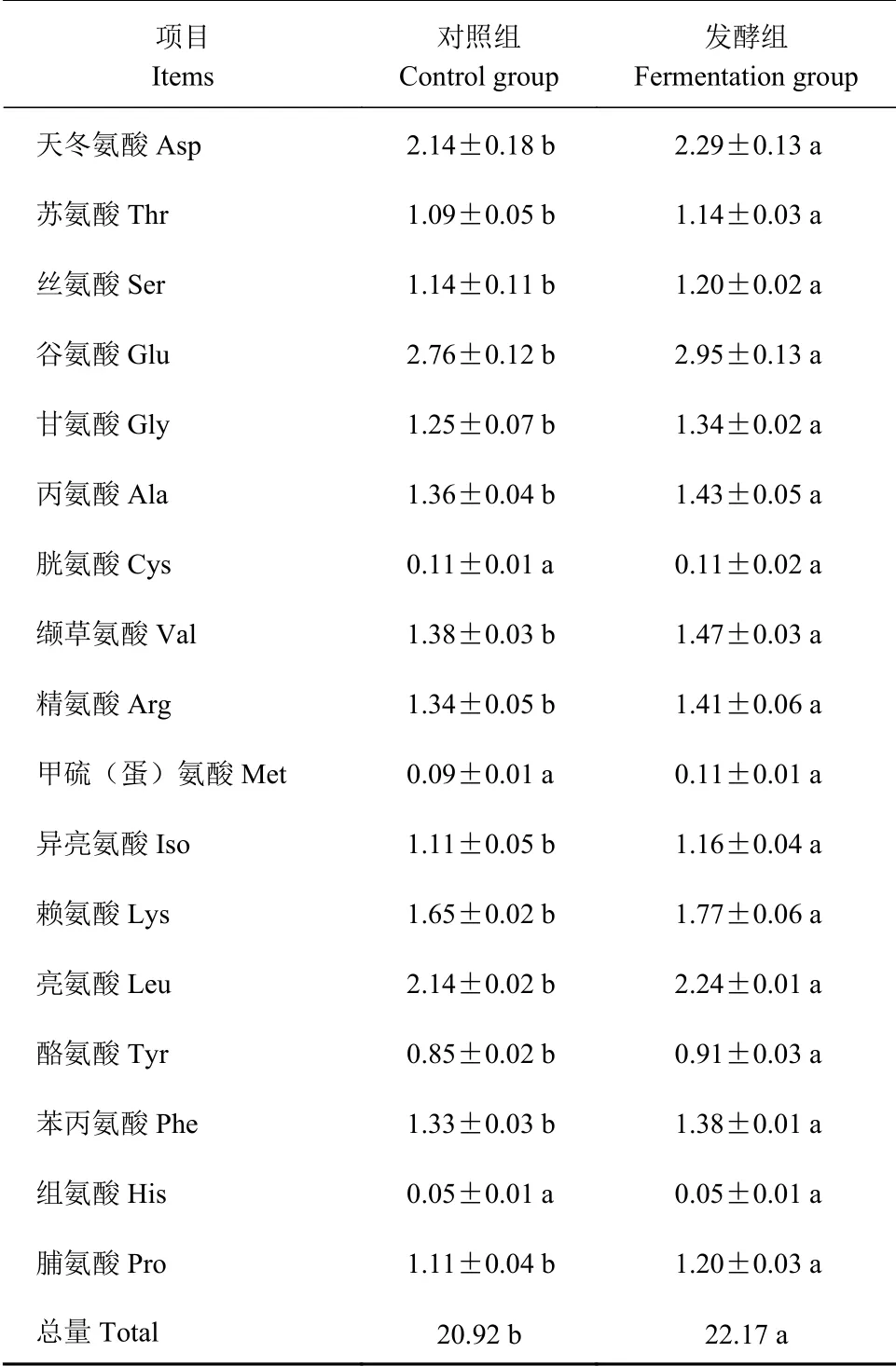
表6 茶渣处理前后氨基酸含量的比较(干基, n=9)Table 6 Change on amino acid composition of tea dregs by treatment (单位:%)
以上结果表明Fb菌能高效分解茶渣,显著提高茶渣的营养价值,更好实现茶渣饲料资源化利用。
3 讨论与结论
研究表明,在固态发酵中,适宜的水分和原料粒度能够保证发酵基质深层微生物对氧气的需求,疏松多孔的基质能促进微生物的代谢废物及时排出,基质内部的养分也可随着自由水通过原料间隙扩散到基质表面,满足基质表面微生物对营养的需求,有利于微生物正常繁殖并保持高产酶活性状态[1,42]。对于含水率高的物料,一般选择吸水性强的铺料如麦麸等来降低物料的含水率;或选择中高温菌发酵利于物料中水分蒸发。刘姝等[12]、胡桂萍等[13]、倪星虹[14]和朱飞等[1]均在茶渣中添加不同种类和比例的铺料进行发酵。本研究获得贝莱斯芽孢杆菌Fb属高温菌,在不添加任何铺料条件下,新鲜茶渣茶渣经其7 d发酵后水分下降了42.06%(P<0.05),可有效解决水分过高的问题。这种利用高温菌发酵分解高水分茶渣的方法不仅能降低生产成本,而且能发酵产生的生物热加大物料水分蒸发鲜见报道。
本研究中,利用高温特殊生境分离方法,从废弃茶渣中分离到有分解茶渣作用的高温菌5株,其中Fb菌能产生具有较强酶活力的纤维素酶、酸性蛋白酶、中性蛋白酶和碱性蛋白酶;与胡宝东等[43]从酱香型大曲中分离获得的甲基营养型芽孢杆菌(即贝莱斯芽孢杆菌)FBKL1.0190相似。Fb菌经菌落形态、菌株形态、生理生化特性的研究及分子鉴定为贝莱斯芽孢杆菌(Bacillus velezensis);可耐受55 ℃的高温,最适生长条件为:42~45 ℃、pH 5.0~7.0、16 h、盐度1.0%~6.0%、装液量0.12 mL·min-1、摇床转速120 r·min-1。茶渣经Fb菌株发酵后,与对照组比,粗蛋白提高14.88%(P<0.05);除胱氨酸、蛋氨酸和组氨酸发酵外,其他14种氨基酸含量均显著提高(P<0.05),且氨基酸总量提高5.98%(P<0.05);这与朱飞等[1]的结果一致,与李芳蓉[44]和张沛[45]的结果相近。另,本研究中茶渣经Fb菌株发酵后与对照组相比粗纤维及其中性洗涤纤维、酸性洗涤纤维和木质素分别下降9.69%、10.72%、4.47%和11.37%(P<0.05),这与张楠[46]和陈奕业[47]研究的结果相似。此外,本研究分离的Fb菌株的生长温度均高于他们的发酵菌株,这不仅可减少其他杂菌生长,而且可提高发酵效率。由此可见,Fb菌能有效分解茶渣,提高茶渣的营养价值。但该菌株在发酵分解茶渣的过程中能否产生一些抗菌的活性物质或表面活性素还有待后续的研究。
