柳叶蜡梅真菌病害分离鉴定及生物学特性
2021-07-16彭成彬王泽榕阮俊峰魏日凤陈美霞
彭成彬,王泽榕,阮俊峰,3,魏日凤,薛 岚,陈美霞,3 ,刘 伟,3
(1. 宁德师范学院生命科学学院,福建 宁德 352100;2. 福建农林大学园艺学院,福建 福州 350002;3. 福建省产学研合作示范基地,福建 宁德 352100;4. 宁德师范学院化学与材料学院,福建 宁德 352100)
0 引言
【研究意义】柳叶蜡梅(Chimonanthus salicifoliusS. Y. Hu)是我国特有的树种,属于樟目蜡梅科蜡梅属的木兰类植物,多年生半常绿灌木,在森林群落生态系统中属于优势灌木树种[1]。柳叶蜡梅生长于福建省寿宁县、安徽省黄山市、江西省修水县、浙江省丽水市等地的山区[2]。柳叶蜡梅花期较长,在南方地区常作为庭院绿化和园林观赏植物。柳叶蜡梅叶片作为畲族民间常用的药材之一,揉碎即芳香,含有多种生物活性成分(挥发油类、倍半萜类、黄酮类、香豆素、蒽醌与生物碱类等),具有抗氧化、消炎、增强免疫调节等药理作用[1,3]。人们对柳叶蜡梅的需求量不断增加,造成对野生资源的无节制采摘,现有的野生资源已近枯竭。近年来,人工引种栽培种植数量提升,但是田间种植管理不到位,关于柳叶腊梅病害报道甚少,尚缺乏对柳叶腊梅病害的深入系统研究。柳叶腊梅真菌病害多发生在叶片上,产生病斑叶片,不能作为加工原料使用,造成产量减少和经济损失,该病害的发生发展没有引起足够的重视,对于绿色防控柳叶腊梅报道甚少,针对引起柳叶腊梅叶部病害的病原菌尚未见报道,生产上迫切需要明确引起其致病的病原菌株才能采取有效针对性措施去防控病害。【前人研究进展】由真菌引起的植物叶斑病的病原菌种类繁多,如烟草茎点霉叶斑病[4]、龙牙百合叶尖干枯病[5]、非洲楝拟茎点霉叶斑病[6]、苜蓿匍柄霉叶斑病[7]等,明确病原菌种类显得尤为重要,但种与亚种之间的差异越来越小,仅靠形态学鉴定菌株是不准确的,同时分析菌株基因型和表现型,鉴定快速、结果准确。已有研究者利用核糖体DNA非转录区(18sRNA、28sRNA、5.8sRNA)的基因序列开发ITS(Internal Transcribed Spacer)标记和β-微管蛋白由β-tubulin基因所编码基因序列开发成β-tubulin标记,二者的序列相识度较高且生物进化具有高度保守基因片段,这二种标记已被诸多研究者用于菌类鉴定[8-10]。【研究的切入点】对于侵染柳叶腊梅的病原菌种类尚待进一步研究。【拟解决问题】本研究结合传统的鉴定方法和分子方法ITS序列、β-tub序列对柳叶腊梅的病原菌进行分离鉴定,并对其生物学特性进行了初步研究,以明确其病原菌种类,探究其生物学特性,以期为柳叶腊梅叶斑病的综合防治、抗性种质资源筛选 和抗病品种选育提供理论参考。
1 材料与方法
1.1 供试材料
供试致病菌分离自柳叶蜡梅叶部病斑,采集自宁德寿宁县福瑞泰生物技术有限责任公司的种植基地 。经室内无菌条件下分离纯化得到供试菌株1013-1。
1.2 供试试剂
供试3种培养基,包括PDA琼脂培养基,PD液体培养基,OA培养基和查氏琼脂培养基(Czapek Agar)。上述培养基参照文献[11]配置,置于115 ℃高 压灭菌20 min 后备用。
1.3 试验方法
1.3.1 柳叶腊梅病斑致病菌分离纯化 参照植病研究方法[11],采用常规组织分离法进行柳叶腊梅叶斑病病原菌的分离纯化,分离纯化5代后,即得到病原 菌菌株。
1.3.2 致病性鉴定 将分离自柳叶腊梅病原菌株分别接种至PDA 平板上,置于培养 5 d后,用无菌的5 mm 的打孔器分别打取菌饼和空白琼脂平板分别接入进行离体柳叶腊梅叶片回接侵染。26 ℃保湿培养,逐日观察叶片的发病情况,若发病,则对柳叶腊梅叶片发病部位再重新组织分离,得到与原始接种菌株真菌形态一致的菌株,则可确定为该病的病原 菌。
1.3.3 致病菌形态学鉴定 接种纯化的1013-1菌株至PDA 培养基和OA培养及中央,28 ℃黑暗条件下培养,定期观察记录菌落培养特征,在培养5 d的菌落边缘滴加适量1 mol·L-1的 NaOH溶液,在10 min和2 h后观察并记录培养基的颜色变化。通过显微镜观察分生孢子形态特征并拍照保存。根据菌落形态特 征和分生孢子特征确定病原菌种类。
1.3.4 分子鉴定 1013-1病原菌基因组DNA按照试剂盒提取的方法进行(天根生化科技有限公司,北京),分别扩增 rDNA-ITS 序列和微管蛋白延伸因子(β-Tub)片段。2对引物序列分别为ITS1(5′-TCCG TAGGTGAACCTGCGC-3′)/ITS4(5′-TCCTCCGCT TATTGATATGC-3′)和β-Tubf(5′-GACCCTTGGC CCAGTTGTTTCCAG-3′)/β-Tubr(5′-CAGAAAGCA GCACCGTTTTTGGTT-3′),引物合成委托福州铂尚生物技术有限公司完成。PCR反应体系扩增程序见表1,分别取5 μL上述PCR扩增产物于1%琼脂糖凝胶电泳(120 V,15 min),检测ITS和β-Tub的PCR 产物片段大小,符合结果的PCR 扩增产物送到福州铂尚生物技术有限公司委托进行测序。所测序列结果提交到NCBI的GenBank进行BLAST搜索比对,采用软件 MEGA 5.0 的Neighbour-Joining法(简称:N J)构建ITS和Tub联合序列的系统发育树分析。

表1 ITS和β-Tub PCR扩增反应程序Table 1 Primer ITS and β-Tub PCR amplification procedures
1.3.5 温度对菌丝生长的影响 用无菌的5 mm直径打孔器打取培养5 d的1013-1菌落边缘菌饼备用,分别将菌饼接种置于 PDA培养基中央(皿的直径为9 cm,下同),分别置于5~40 ℃条件下(每5 ℃为一个梯度,共8个不同温度条件)恒温培养,7 d后用十字交叉法分别测定1013-1病原菌的菌落直径 。每处理重复3次。
1.3.6 pH对菌丝生长的影响 用0.1 mol·L-1HCl和0.1 mol·L-1NaOH调配pH 3~12的PDA培养基。灭菌后接入5 mm菌饼,菌饼获取方法同1.3.5,置于28 ℃恒温培养,7 d后用十字交叉法测定1013-1病原 菌的菌落直径。每处理重复3次。
1.3.7 光照对菌丝生长的影响 用灭菌后PDA培养基,接入5 mm菌饼菌饼,获取方法同1.3.5,分别置于连续光照、12 h光照12 h黑暗交替、完全黑暗3种光照条件下,28 ℃恒温培养,7 d后用十字交叉法 测定1013-1病原菌的菌落直径,每处理3次重复。
1.3.8 不同碳源对菌丝生长的影响 以查式培养基为基础培养基,将其中的蔗糖以葡萄糖、果糖、甘露醇、木糖、蔗糖、乳糖、麦芽糖、可溶性淀粉、山梨醇、肌醇、木糖醇等量替换,即成含糖量相同而碳源不同的培养基,灭菌后接入5 mm菌饼,菌饼获取方法同1.3.5,置于28 ℃恒温培养,7 d后用十字交叉法测定1013-1病原菌的菌落直径,每处理3 次重复。
1.3.9 不同氮源对菌丝生长的影响 以查式培养基为基础培养基,将其中的硝酸钠以硝酸钾、酵母粉、蛋白胨、硝酸钠、尿素、氯化氨、甘氨酸和硫酸铵等量替换,即成含氮量相同而氮源不同的培养基,灭菌后接入5 mm菌饼,菌饼获取方法同1.3.5,28 ℃恒温培养,7 d后用十字交叉法测定1013-1病原 菌的菌落直径,每处理3次重复。
1.3.10 菌丝体的致死温度测定 将5 mm菌饼置于5 mL无菌试管中,加入 2 mL 灭菌ddH2O。分别在40 、45 、50 、55 、60 ℃水浴锅中处理10 min 后,将试管内菌丝块置于 PDA 培养基中央,置于28 ℃下 培养,5 d 后观察其生长情况。每处理重复 3次,1.3.11 数据统计与分析 数据统计与分析采用 SPSS 17.0软件对菌落直径数据进行统计分析处理,并利用 Duncan氏新复极差法进行多重比较。
2 结果与分析
2.1 柳叶腊梅田间病斑和致病性测定
田间柳叶腊梅的叶片发病症状:表现为褐色病斑,略凹陷,叶正、背面均可受害。多呈圆形或不规则形,病斑部位有黑色颗粒,病健界限明显呈现黑褐色,发病后期叶片脱落,田间采集病叶见图1-a。采用常规组织法分离得到1株致病分离物,编号为1013-1,分别取5 mm纯化后的菌饼和空白琼脂块,分别接种离体柳叶腊梅叶片,对照组不发病见图1-b,4 d开始发病,形成褐化病健界限明显,结果见图1- c。重 新分离纯化可得到相同的病原菌,进行后续试验。
2.2 形态特征观察
1013-1分离物在PDA培养基上培养7 d的菌落形态特征见图1-d和图1-e。正面菌落棕色相间,边缘白,前期菌落中部凸起,后期菌落展开扁平,气生菌丝发达,棉絮状、绒毛状,非常致密,边缘整齐,前期白色,后期出现不同层次的棕色环带。背面和棕色且深浅颜色交替,呈现同心轮纹状。孢子见图1-f,形体呈现多数为梨形和椭圆形,单孢,或者多具 2个油球,1.8~5.4(4.1)×1.5~2.2(2)μm,其分生孢子器见图1-i,不规则形,末端于菌丝相连。1013-1接种于OA培养基5 d后的菌落,使用1 mol·L-1的 NaOH溶液处理,10 min后见图1-g,菌落边缘呈现墨绿色,2 h后见图1-h,菌落边缘呈现棕色,综合 上述结果,结合文献资料初步判断为高粱附球菌[12]。

图1 菌落形态和致病性鉴定Fig. 1 Colony morphology and pathogenic assay
2.3 PCR克隆及测序分析序列分析
分别提取病原菌株的基因组DNA进行特异性引物ITS和β-tub扩增1%琼脂糖凝胶电泳检测(120 V电压下15~20 min),结果(图2)可知扩增的ITS和β-tub条带单一、清晰明亮、分子量分别在500~750 bp和250~500 bp,与预期大小一致。测序分析结果经NCBI比对,下载同种属序列[13],序列同源性分析和进化树结果见图3,1013-1菌株的ITS序列与登录号MN493119为Epicoccum sorghinum相似度达100%,β-tub序列与登录号MN512426为Epicoccum sorghinum相似度达100%,综合形态学结果和分子鉴定结果,得 出该病原菌为高粱附球菌E. sorghinum。
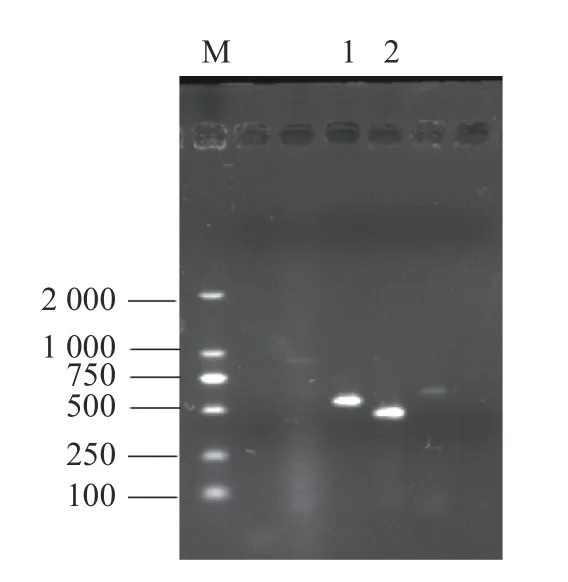
图2 PCR结果Fig. 2 Result of PCR
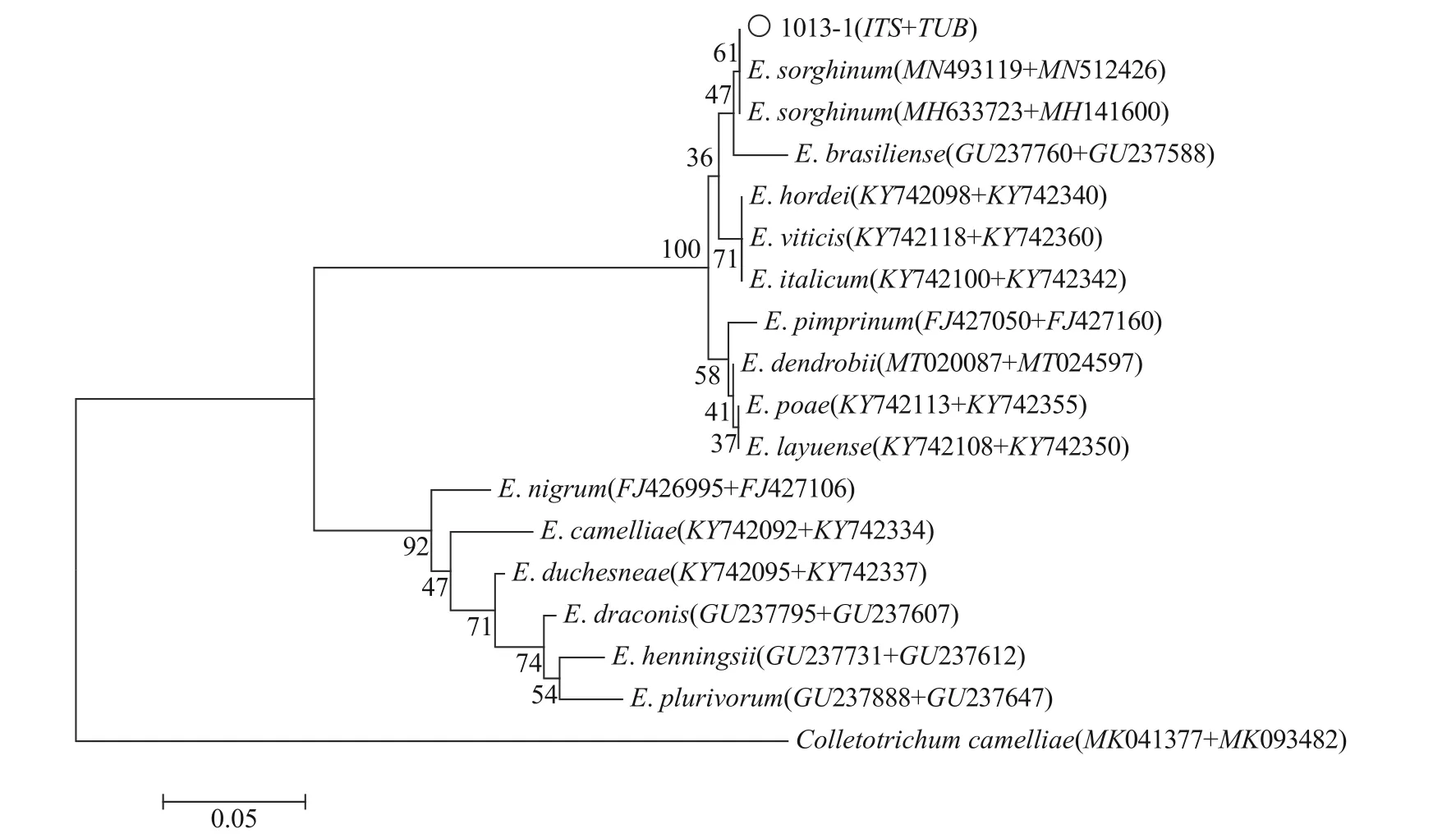
图3 基于ITS+TUB序列联合分析构建NJ-系统树Fig. 3 NJ-system tree derived from ITS and β-Tub sequence analysis
2.4 不同条件下菌丝生长影响
2.4.2 pH对菌丝生长的影响 培养7 d后测量菌落直径,由表2可知,1013-1病原菌在pH 3~11下均可生长,适宜生长范围是 pH 值为5~9时,菌丝生长较好,菌丝直径达到最大值8 cm。病原菌在弱酸到中性到弱碱环境下有利菌丝生长,酸性或碱性过强 都会抑制病菌的生长。
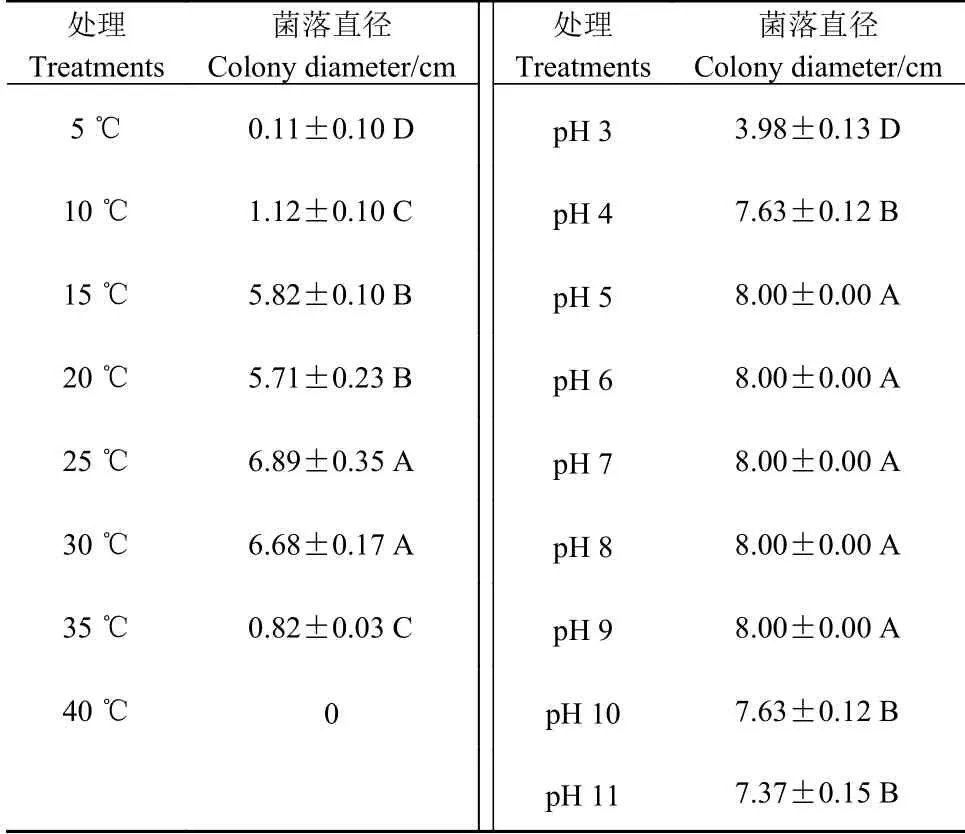
表2 不同温度和pH处理病原菌的菌落直径Table 2 Diameters of pathogen colonies at different temperatures and pHs
2.4.3 光照对菌丝生长的影响 培养7 d后测量菌落直径,由表3可知,病原菌在连续光照、12 h光照12 h黑暗交替、完全黑暗,这3种光照条件下均可生长,三者菌丝直径差别不显著。光照处理对菌丝生 长影响不大。

表3 光照对生长影响Table 3 Effect of light on mycelial growth
2.4.4 不同碳源对菌丝生长的影响 在碳源测定中,培养7 d的结果从表4可知,病原菌在不同碳源上均能生长,在供试的11种碳源中,该菌在以蔗糖和麦芽糖为碳源的培养基中生长最快,其菌落直径最大,为 8 cm,极显著高于其余碳源,其次为葡萄糖,病原菌以蔗糖和麦芽糖为最佳碳源。在以可溶性淀粉为碳源的培养基,其菌落直径最小,为6.02 cm,菌 丝生长较慢。
2.4.5 不同氮源对菌丝生长的影响 在氮源测定中,培养7 d的结果从表4可知,氮源对病原菌生长(菌落直径)的影响不显著,在供试的8种氮源中,其中,硝酸钾、酵母粉、蛋白胨、硝酸钠和甘氨酸的菌落直径均为8 cm,以氯化氨为氮源的培养基其菌丝生长慢,菌落直径为4.25 cm,对氯化氨利用 率低,尿素作为氮源不适合1013-1病原菌生长。
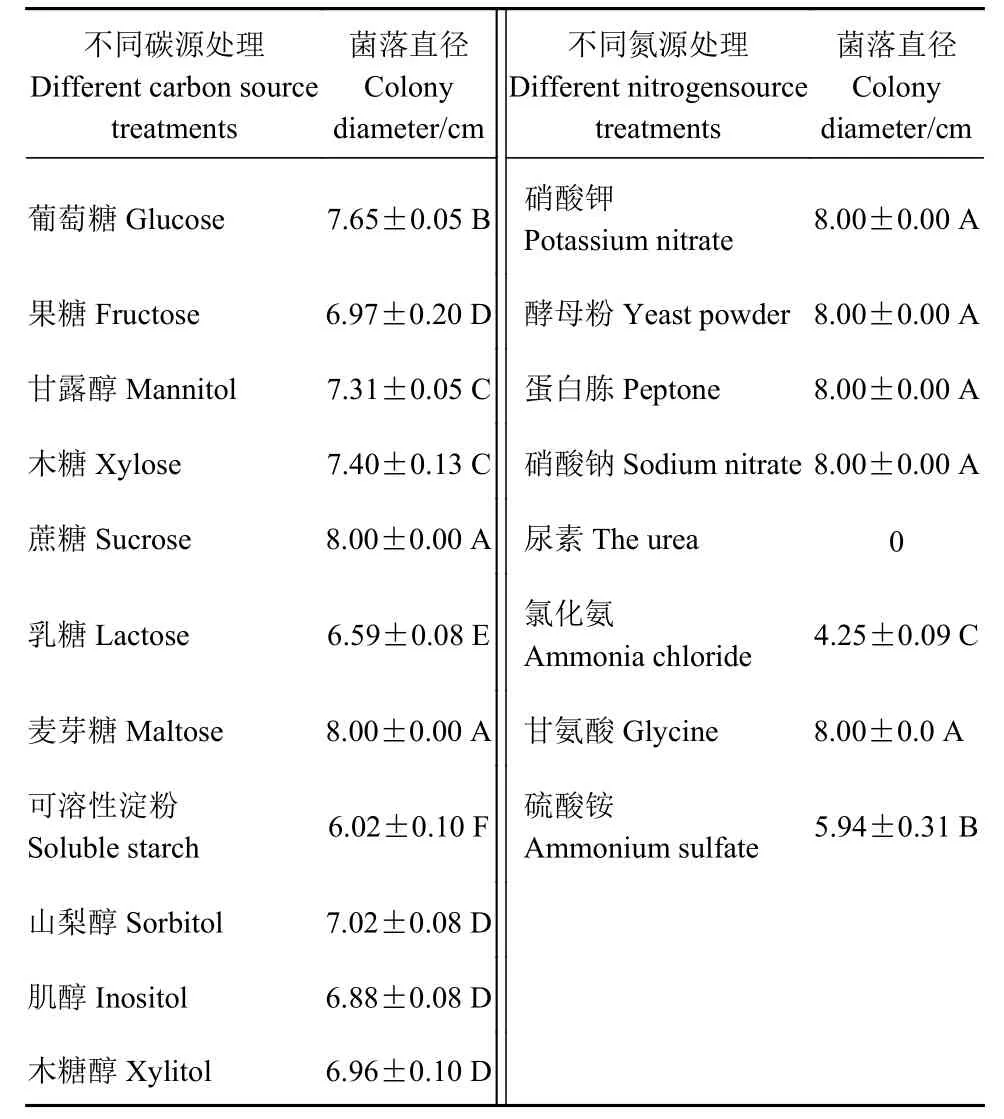
表4 病原菌在不同碳源和氮源处理下的菌落直径Table 4 Diameters of pathogen colonies on media of different carbon and nitrogen sources
2.4.6 菌丝体的致死温度测定 5 mm菌块在40~50 ℃的水浴温度处理后,病原菌1013-1仍然能在 PDA 培养基上生长,55~60 ℃,病原菌1013-1在PDA培养基上不再生长,菌饼在51 ℃的水浴温度处理后能在PDA培养基生长,而菌饼在52~54 ℃的水浴温度处理后,病原菌1013-1不再生长,表明病原菌1013-1致 死温度为52 ℃。
3 讨论
近年来,由于柳叶腊梅的叶片价值最高,诸多研究多集中于叶片成分药用价值开发上,国内外对其病害防控研究报道甚少。柳叶腊梅病害发生,形成病斑占据叶片面积,引起植物防御反应,叶片自身程序性凋谢脱落,影响树势生长,进而导致产量减少,带来经济效益损失。本研究分离柳叶腊梅叶斑病所得的病原菌株为高粱附球菌(E. sorghinum),研究表明,E. sorghinum最早是在高粱叶片上分离得到[14],后面陆续在玉米[15]、百合[5]、燕麦[16]被发现。该病原菌是一个较有争议的病原菌,既能作为致病菌侵染植物,同时又能作为内生菌存在,分泌的代谢产物之一细交链孢菌酮酸是一种天然毒素,被列为食品安全检测作为重点监测对象[17],分泌的另一种代谢产物是新型蒽醌衍生物,具有杀菌、除草及抗肿瘤的作用[13,15,18]。E. sorghinum很有应用开发价值,已有报道以内生菌用于抑菌实验[19]。而本研究对E. sorghinum的理化性质和分泌代谢物方面的研究少,我们在后续将尝试引入多种植物病原真菌进行拮抗实验验证,尝试开发E. sorghinum相关代谢物质作为抑菌剂的应用。在对E. sorghinum的生物学特性进行探究的过程中我们发现,受玻璃培养皿的大小限制影响,在氮源上硝酸钾、酵母粉、蛋白胨、硝酸钠和甘氨酸的菌落直径均为8 cm,但是发现第3~5 d菌落培养情况和菌落直径记录发现蛋白胨的菌落直径均优于其他氮源,研究结果综合考虑蛋白胨是该菌的最适氮源,本研究的生物学特性结果与LIU研究的E. nigrum的温度和氮源结果一致,但是在pH和碳源都存在略微的差异,LIU等[20]研究表明最适碳源是麦芽糖和葡萄糖,pH适宜范围在6 ~9,而本研究最适碳源是麦芽糖和蔗糖,pH适宜的范围在5~9,推测可能是由于不同种之间会存在差异所致,还有待深入研究。柳叶腊梅其活性成分在长期自然进化过程形成的,这些物质对人类有益,对于天敌而言却是致命,而E. sorghinum在长期侵染柳叶腊梅叶片中是否也发生协同进化如细胞壁加厚,细胞液泡浓度增高等还有待后续深入研究。
4 结论
柳叶蜡病害防治研究方面相对空缺,本研究首次报道了寿宁县柳叶腊梅的一种新病害,叶斑病病原菌经形态特征观测和rDNA-ITS和TUB序列在NCBI数据库的分析比对,鉴定为子囊菌门,格孢腔目,附球真菌属,高粱附球菌E. sorghinum。该病原菌的最适生长温度为25 ℃,最适pH值范围为5~9,最适碳源为蔗糖,最适氮源为蛋白胨(综合第5 d的培养菌落直径),光照对该菌株的生长没有影响,菌丝体致死温度为 52 ℃。本研究为柳叶腊梅叶斑病的综合防治、抗性种质资源筛选和抗病品种选育提供理论参考。
