响应面法优化海洋细菌NTa产琼胶酶的发酵条件
2021-07-16陈艳红王海琪马芮萍姜泽东倪辉朱艳冰
陈艳红,王海琪,马芮萍,姜泽东,倪辉,朱艳冰
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;3.厦门市食品生物工程技术研究中心,福建 厦门 361021;4.厦门市南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021)
0 引言
琼脂是红藻细胞壁的主要成分,主要由琼脂糖和硫琼胶组成[1]。琼脂糖是不含有硫酸酯盐的非离子型多糖,由D-半乳糖(G)和3,6-内醚-α-L-半乳糖(LA)以α-1,3-糖苷键和β-1,4-糖苷键反复交替连接形成的线性大分子,是形成凝胶的组分[1-2]。硫琼胶和琼脂糖的二糖单位类似,其中一些羟基被硫酸基、甲氧基和丙酮酸残基等替代[1-2],是非凝胶组分。
琼胶酶属于糖苷水解酶家族,它将琼脂降解为具有重复二糖单位的寡糖。根据酶解类型,琼胶酶分为α-琼胶酶(EC 3.2.1.158)和β-琼胶酶(EC 3.2.1.81)。α-琼胶酶作用于琼脂糖的α-1,3-糖苷键,产物是以3,6-内醚-α-L-半乳糖为还原性末端的琼寡糖(agaro-oligosaccharide,AOs);β-琼胶酶作用于琼脂糖的β-1,4-糖苷键,产物是以D-半乳糖为还原性末端的新琼寡糖(neoagaro-oligosaccharides,NAOs)[3]。琼胶水解产生的寡糖表现出多种生物学活性[4],如益生元效应、增白效应、保湿效应和抗氧化作用等,在食品、医药和化妆品行业有广泛的潜在应用。琼胶酶除了用于制备寡糖外,也可以用于琼脂糖凝胶DNA的回收、海藻原生质体的制备、海藻中生物物质的提取等[3]。
琼胶酶主要从海洋微生物和海洋软体动物的消化道中获得,其中许多琼胶酶已经从细菌物种中被鉴定出来[5-10]。由于琼胶酶的生产率低,琼胶酶的商业用途受到限制,已经有一些研究进行产琼胶酶微生物的培养条件或培养基组成的优化[11-15]。
在先前的研究中,本课题组从厦门的海洋泥土样品中分离出琼胶酶的高产菌株Stenotrophomonassp.NTa[16],并进行了该菌株发酵产琼胶酶条件的初步优化,利用单因素优化的方法确定了菌株 NTa 产琼胶酶的最佳碳源是琼脂、氮源是酵母浸膏,培养基中NaCl的最佳质量分数为5%,产酶的最佳温度为28 ℃[17]。在此基础上,本研究拟应用一些统计设计包括Plackett-Burman试验(Plackett-Burman design,PBD)、最陡爬坡试验(steepest ascent method,SAM)和响应面分析法(response surface methodology,RSM),进一步建立Stenotrophomonassp.NTA发酵产酶的优化方法,并鉴定菌株NTa琼脂酶的酶解产物。
1 材料与方法
1.1 材料与试剂
种子培养基(g/L):NaCl 50.0,KNO35.0,MgSO4·7H2O 5.0,CaCl20.2,K2HPO40.1,FeSO4·7H2O 0.02,蛋白胨5.0,酵母浸膏1.0,琼脂2.0。
基础发酵培养基(g/L):NaCl 50.0,KNO35.0,MgSO4·7H2O 5.0,CaCl20.2,K2HPO40.1,FeSO4·7H2O 0.02,琼脂2.0。通过1 mol/L NaOH将培养基的初始pH值调至7.5。
新琼二糖(NA2)、新琼四糖(NA4)、新琼六糖(NA6)和新琼八糖(NA8)等新琼寡糖标准品,上海ZZBIO有限公司,其他试剂均为分析纯产品。
1.2 仪器与设备
WFJ型可见分光光度计,尤尼柯仪器有限公司;3 ku超滤离心管,Millipore,USA;Labconco FreeZone 6 plus冷冻干燥机,ThermoFisher,USA;Waters Maldi Synspt Q-TOF质谱仪,Waters Corp,USA。
1.3 方法
1.3.1 琼胶酶粗酶样品的制备 将产琼胶酶细菌NTa单菌落接种于5 mL种子培养基中,28 ℃、180 r/min 培养24 h。将1 mL上述培养物接种到50 mL种子培养基(在250 mL锥形瓶)中,28 ℃、180 r/min培养12 h。将制备的接种物以质量比为1∶50的比例转移到50 mL基础发酵培养基中(在250 mL锥形瓶),28 ℃、180 r/min 条件下培养36 h。
1.3.2 琼胶酶粗酶样品的制备 发酵液于4 ℃、12 000 r/min离心10 min,上清液即为发酵粗酶液。
1.3.3 琼胶酶活力的测定 琼胶酶的活力测定参照文献[16]进行。在40 ℃、pH= 7.0条件下,以每分钟释放1 μmol还原糖(以葡萄糖计)所需的酶量定义为一个酶活力单位(U)。
1.3.4 生物量的测定 取1 mL发酵液,在12 000 r/min条件下离心10 min,弃去上清液,保留菌体沉淀,加入去离子水至 3 mL,充分混匀后,测定其在600 nm 处的吸光度值,以去离子水为空白对照,检测微生物的生物量。
1.3.5 总糖的测定 取稀释10倍的发酵液1 mL于试管中,加入2 mL蒽酮试剂,混匀,沸水浴反应10 min,冷却至室温后,放置10 min,在620 nm处测定吸光度值。
1.3.6 PBD 采用PBD试验选择影响琼胶酶活力的因素,对琼脂质量分数(A)、酵母浸膏质量分数(B)、MgSO4·7H2O质量分数(C)、CaCl2质量分数(D)、 培养基初始pH值(E)、装液量(F)及接种量(G)7个因素进行考察,分别选择高水平和低水平,因素水平设计如表1所示。 测定样品的琼胶酶活力和生物量,选择置信度高(大于95%)的因素进行进一步考察。
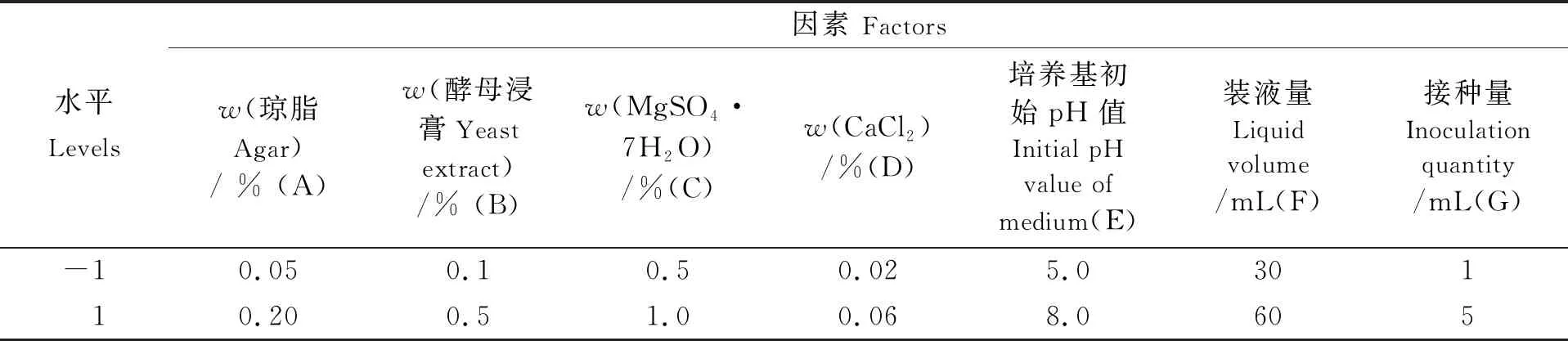
表1 琼胶酶发酵PBD设计因素及水平
1.3.7 SAM 为了接近琼脂酶产量的最高区域,在PBD试验结果的基础上确定最陡上升的方向和合理的步长。
1.3.8 RSM 基于PBD和SAM的结果,使用中心组合试验设计,进一步评估对菌株产琼胶酶有显著影响的变量。变量分别在5个不同的层次进行研究。测定了试验设计中琼胶酶活力的实际值和预测值的响应。对获得的数据应用多元回归分析。系统的行为由式(1)来解释:
(1)
其中:Y是预测的响应值(琼胶酶活力,U/mL);b0,bi和bij是常系数;xi和xj是编码的自变量。使用Design Expert 8.0.5.0对模型进行统计分析以评估方差分析。
1.3.9 酶解产物的制备 将发酵粗酶液通过冷冻干燥机浓缩成粉末,将酶粉末溶于50 mmol/L Tris-HCl(pH=7.0)中,然后用150倍体积的相同缓冲液透析过夜4次。透析样品用作部分纯化的琼胶酶。将5 mL酶溶液(1.2 U/mL)加入15 mL含有1.0%(m/V)琼脂的50 mmol/L Tris-HCl(pH=7.0)中,40 ℃下120 r/min进行振荡反应。每隔一段时间取样,利用DNS法[18]测定释放的还原糖的量。温育72 h后,释放的还原糖量没有变化。在沸水中加热10 min停止反应。反应物在4 ℃下18 000g离心20 min,上清液利用3 ku超滤离心管处理,滤液即为酶解产物。
1.3.10 酶解产物的鉴定 将酶解产物加到硅胶60薄层色谱板上,用V(正丁醇)∶V(乙酸)∶V(水溶液)=2∶2∶1作为溶剂体系展开。利用含体积分数10% H2SO4的乙醇溶液显影产物,并在110 ℃加热10 min。利用质谱仪测定酶解产物的分子质量分布。
1.3.11 数据分析 所有实验是3次平行试验的平均值,数值表示为平均值±标准偏差。 使用Microsoft Excel程序和Design-Expert 8.0.5.0统计软件分析结果。
2 结果与讨论
2.1 7种因素对菌株产琼胶酶的影响
采用PBD考察7种因素对菌株产琼胶酶的影响,结果如表2所示。将这些结果拟合到式(2):
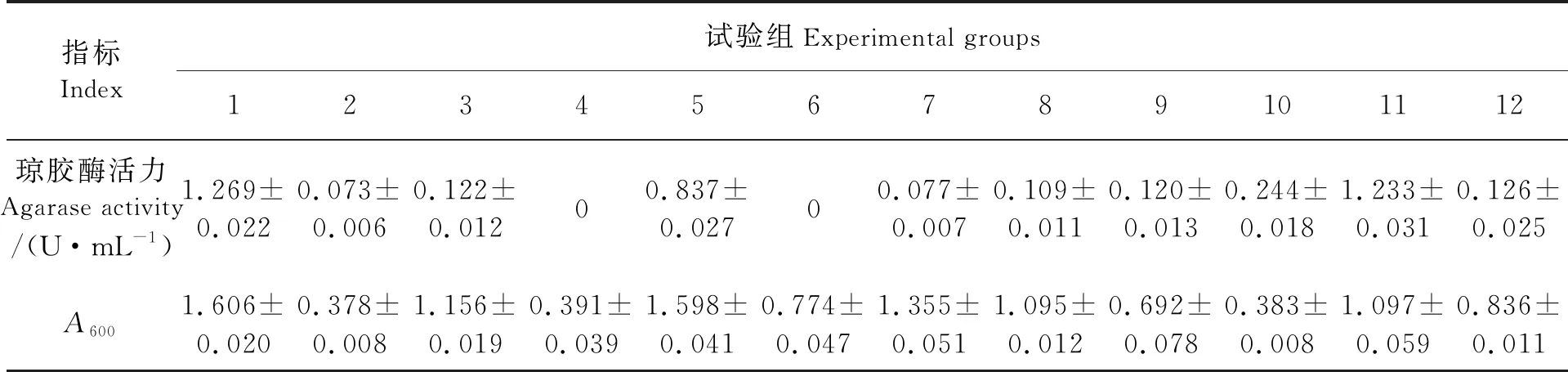
表2 琼胶酶发酵PBD试验结果
Y=0.35-0.067A+0.26B-0.12C+0.12D+0.28E+0.074F+0.037G。
(2)
其中:Y是琼脂酶活力;A、B、C、D、E、F、G分别代表琼脂含量、酵母浸膏含量、MgSO4·7H2O含量、CaCl2含量、培养基初始pH、装液量和接种量。 各因素的方差分析如表3所示,可见,因素B(酵母浸膏含量)和因素E(培养基初始pH值)的P值分别为0.019 9和0.014 6,均小于0.05,说明这两个因素对Stenotrophomonassp.NTa发酵产琼胶酶的活力影响显著。其他5个因素的P值均大于0.05,说明对该菌株产琼胶酶的活力影响不显著。因此,酵母浸膏含量和培养基初始pH值的置信度均大于95%。对这两个因素进行进一步考察,其他5个因素则维持在初始水平。
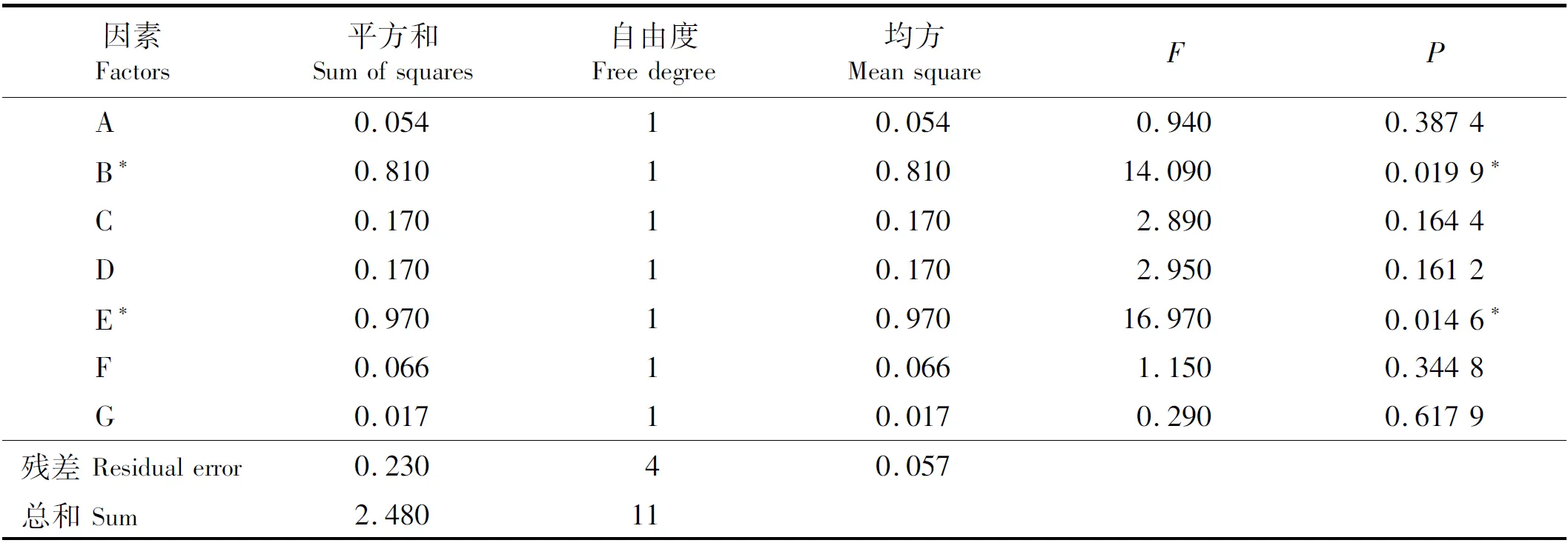
表3 PBD试验方差分析结果
2.2 适当区域的SAM确定
通过氮源酵母浸膏和培养基初始pH值两个因素同时变化的SAM进行最优条件搜索,试验设计组合及结果如表4所示。可见,第2组琼胶酶酶活力达到高峰,而第4组生物量达到峰值。Stenotrophomonassp.NTa的生长需要丰富的营养物质,而酵母浸膏中含有大量氨基酸及多肽,可保证菌株的生长需求,但过高浓度的氨基酸和多肽则会抑制微生物对酶的合成。由于本研究的目的主要是想提高菌株NTa所产琼胶酶的活力,所以选择第2组的条件作进一步的研究。
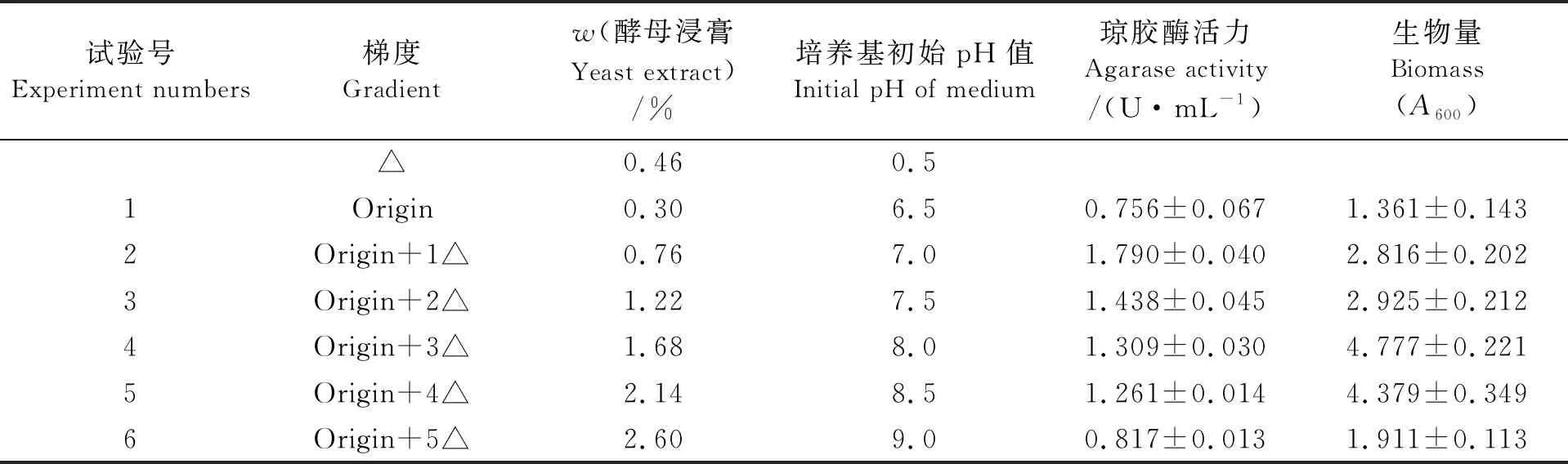
表4 SAM设计及结果
2.3 重要因素的RSM优化
基于PBD和SAM结果,采用RSM对氮源酵母浸膏和培养基初始pH值重要因素的水平及其互作效应进行优化和分析,结果如表5所示。可见,在所有13次实验中,琼胶酶活力在0.241~2.038 U/mL之间变化。数据的统计分析结果见表6。式3被用来解释变量与琼胶酶活力之间的关系:
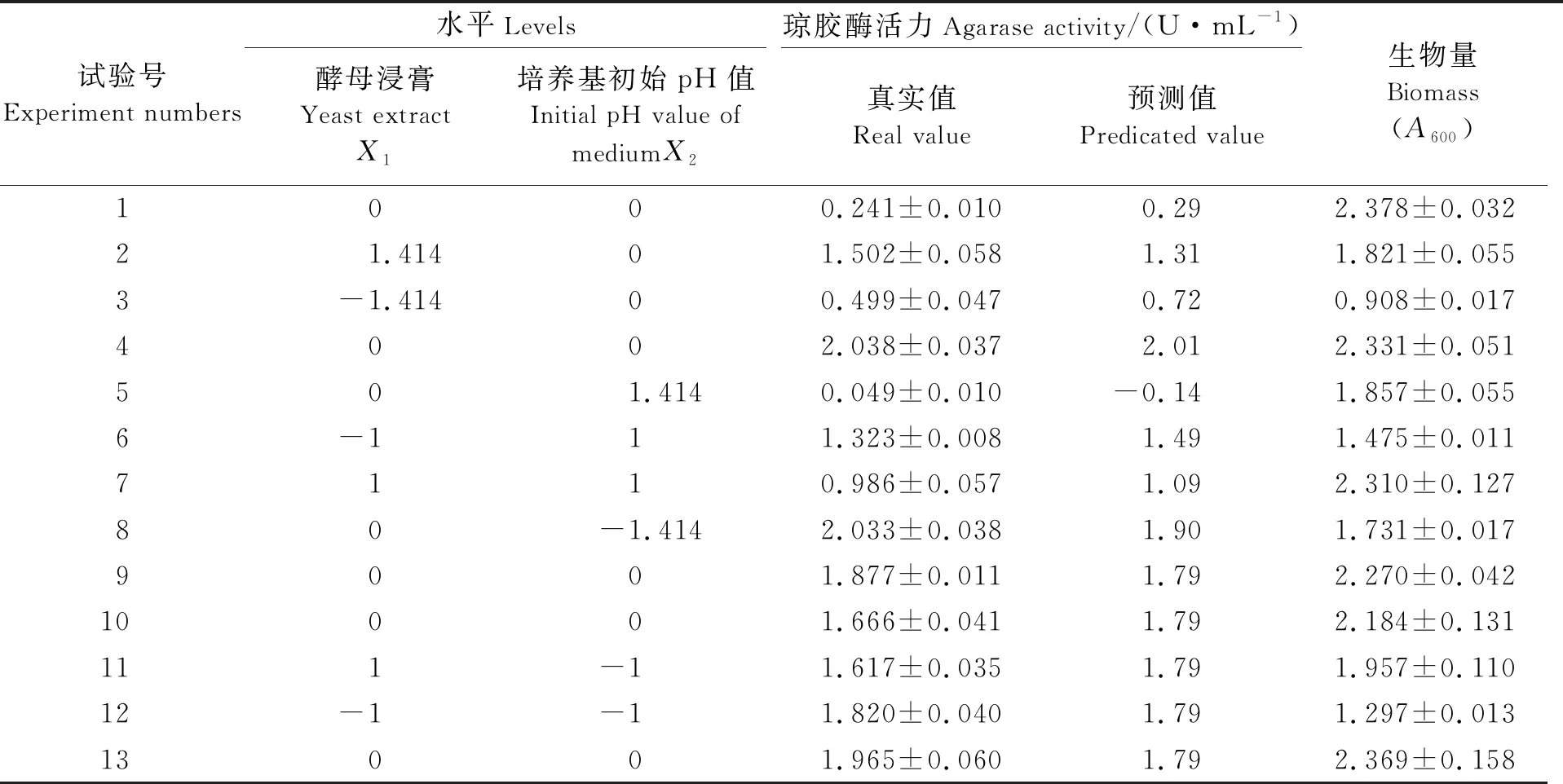
表5 中心组合试验设计及结果

(3)
其中:Y表示琼胶酶活力;X1和X2分别是氮源酵母浸膏和培养基初始pH值。
方差分析结果如表6所示,可见,模型P=0.000 2<0.001,说明模型极显著。失拟项P=0.1634>0.05,失拟项不显著,该模型具有统计学意义。根据决定系数R2的值可知,95.35%的酶活力变化可由此方程来解释,模型拟合程度良好,可以通过回归方程准确描述各因素与响应值之间的关系。根据校正决定系数Radj的值可知,仅有总变异的8%不能由该模型来解释。
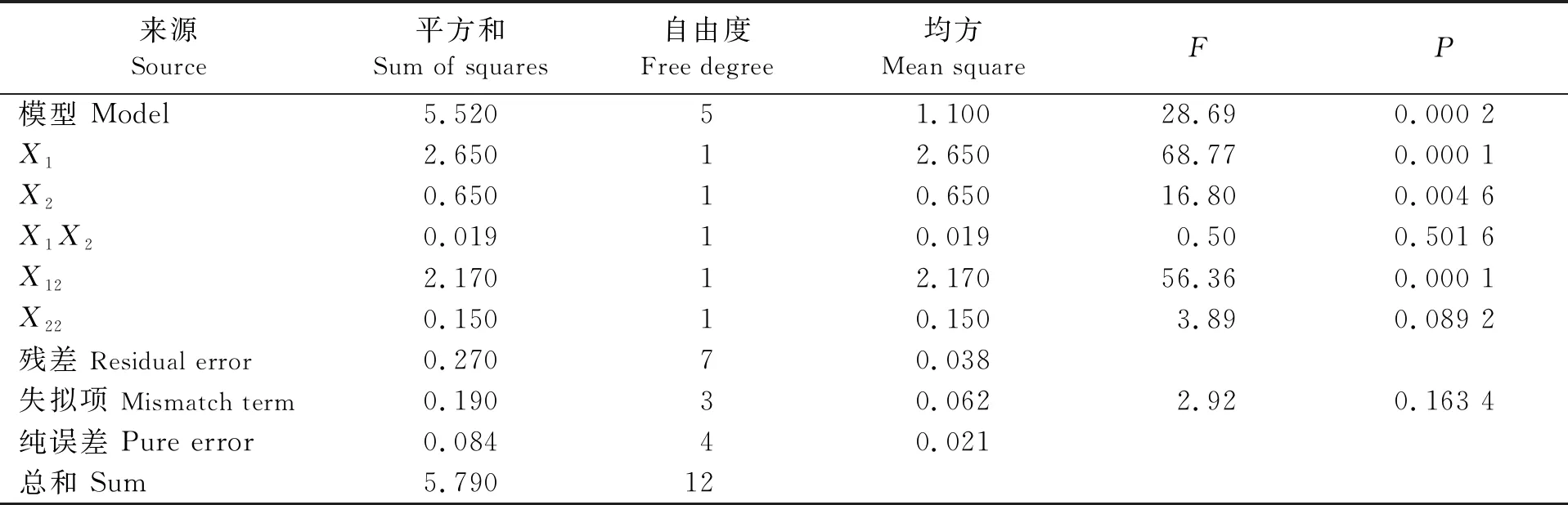
表6 中心组合试验方差分析结果
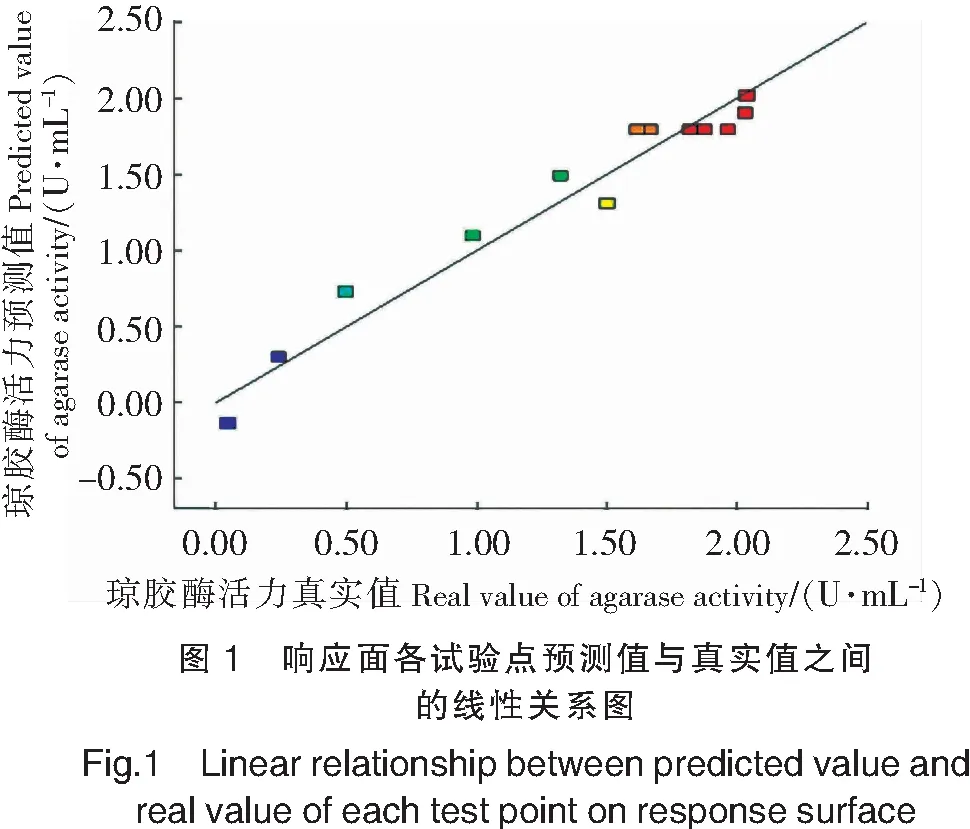
由图1可以看出,软件拟合响应面各试验点的预测值和真实值的线性关系基本在同一条直线上,表明该模型对试验结果进行拟合的程度良好。因此,该模型可用于Stenotrophomonassp.NTa发酵产琼胶酶,通过此模型可以代替真实的试验点对琼胶酶发酵条件优化进行分析和预测。
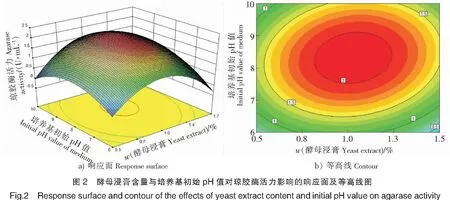
各个变量及对响应值的影响可以通过回归方程软件绘制三维响应面及其对应的等高线图来解释。各因素之间的交互强弱可以通过等高线的形状反映,两因素交互作用显著显示椭圆形,反之则显示圆形。由图2可见,氮源酵母浸膏含量与培养基初始pH值二者的交互作用对琼胶酶活力的影响并不明显,在二者选取一个适中值时,琼胶酶活力将会到最高值,而超出或低于适中值时,酶活力降低。利用软件对回归方程进行规范形分析并结合图2可知,回归模型存在稳定点,响应面预测最大点为稳定点。分析得出,对Stenotrophomonassp.NTa发酵产琼胶酶具有重要影响的因子的最佳水平为:酵母浸膏质量分数为1.03%,培养基初始pH=8.0。在模型分析得到的最适产酶条件下,模型预测到的发酵产琼胶酶的活力为2.113 U/mL。
2.4 验证试验
为了确定结果的准确性,在上述条件的基础上做了5次重复实验进行验证,在实际发酵中,得到琼胶酶活力为(2.628±0.047)U/mL,接近模型预测值,说明该回归方程可以准确地反映菌株NTa发酵产琼胶酶中受到各个因素的影响程度。
2.5 Stenotrophomonas sp.NTa发酵产琼胶酶的动态规律
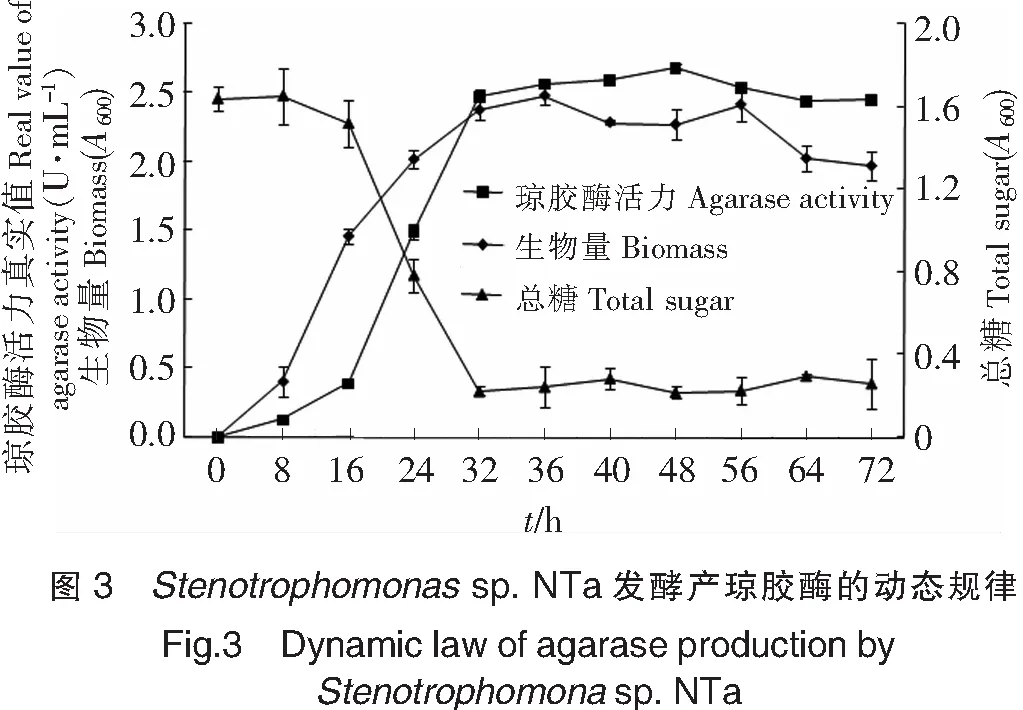
对液态发酵琼胶酶的动态规律进行分析,结果如图3所示。0~8 h,菌株的生长和生物量的增长都比较缓慢,产酶能力微弱,这段时期为细胞生长延滞期;8 h后,琼脂为菌体提供充足的养分,菌株快速生长,菌株细胞进入对数生长期;8~16 h,菌体生长速度迅速,但产酶能力依然微弱;16~32 h,菌体的生长速度减慢,但菌株的生物量继续增大,琼胶酶活力迅速升高,酶活力32 h时达到2.479 U/mL;32~48 h,菌株的生长和产酶能力逐渐趋于稳定,琼胶酶活力在48 h时达到最高为2.688 U/mL;56 h后,菌株的生物量开始下降。培养基总糖含量在在不同时间段有所变化,在0~8 h内基本无变化, 8~16 h内缓慢减少,16~32 h内迅速减少,32 h后趋于稳定。可以通过发酵曲线得出,菌株NTa发酵产琼胶酶的酶活力增加主要在菌体的对数生长中后期(16~32 h)。
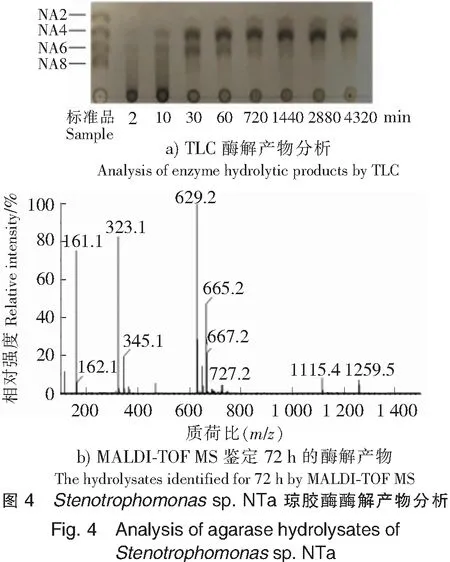
2.6 酶解产物的鉴定
采用TLC对酶解产物进行分析,结果如图4a所示,在反应10 min时可以检测到少量的八糖、六糖和四糖,随着反应时间的增加,八糖逐渐减少,六糖和四糖逐渐增加。30 min时,八糖消失,六糖和四糖明显增多。48 h后产物主要为四糖,72 h后产物不再发生变化。
使用质谱仪对72 h的酶解产物进一步分析,结果见图4b,每个质谱峰被认为是质子化形式的(M-H)-或(M+Cl)-。m/z为161.1(M-H)-时对应的产物是3,6-脱水-α-L-半乳糖,m/z为323.1(M-H)-对应的是二糖,m/z为629.2(M-H)-和665.2(M+Cl)-对应的是四糖。所以,质谱结果显示,菌株NTa琼胶酶水解琼脂的产物包括3,6-脱水-α-L-半乳糖、二糖和四糖。
3 结论
本研究使用统计设计的方法确定Stenotrophomonassp.NTa发酵产琼胶酶的最佳条件。优化后琼胶酶的活力在发酵48 h后高达2.688 U/mL。在发酵过程中,菌株NTa的琼胶酶在对数期迅速合成。通过TLC和MALDI-TOF MS分析显示,菌株NTa琼胶酶水解琼脂主要产生四糖。
