苦木注射液对阿奇霉素在肺炎模型大鼠体内组织分布的影响
2021-07-16孙发鑫许晓蒙冯莹莹郭文娜李志勇
孙发鑫,许晓蒙,冯莹莹,郭文娜,袁 梦,李志勇,许 卉
(烟台大学药学院,新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
临床肺炎多为致病菌感染所致,肺炎克雷伯菌感染的危险性尤为严重。临床上常用碳青霉烯类、大环内酯类、头孢菌素类及青霉素类抗生素治疗肺炎克雷伯菌感染[1]。阿奇霉素(AZM)是目前治疗细菌性肺炎的一线药物,具有广谱抑菌作用和显著的抗炎、免疫调节作用[2-3]。AZM在体内吸收迅速,达峰时间短,半衰期长,生物利用度高,分布广泛,组织浓度明显高于同期血药浓度[4]。然而,AZM存在明显的副作用,如胃肠不适、过敏、免疫紊乱、肝损伤和神经系统损伤,从而限制了AZM的临床疗效[5-6]。研究发现,包括AZM在内的抗生素与常见清热解毒类中药制剂联用,如痰热清注射液、热毒宁注射液、喜炎平注射液[7-9],既清除患者体内致病微生物,又降低药物的不良反应,临床效果评价颇高。
苦木注射液(KM)是由苦木干燥枝或茎制成的,为橙黄色的澄明液体,具有清热、解毒、消炎功效,常用于感冒、上呼吸道感染、急性扁桃体炎、细菌性痢疾等的治疗[10-11]。目前临床上KM与化学抗生素联用还存在空白。本实验以肺炎克雷伯菌构建模型,建立一种灵敏、高效、快速的LC-MS/MS分析方法测定大鼠血浆和组织中AZM的浓度,考察苦木注射液对阿奇霉素在大鼠体内组织分布的影响,为临床苦木注射液与阿奇霉素联用提供科学依据。
1 材料与方法
1.1 仪器、试剂及动物
Agilent 1100高效液相色谱仪;Thremo TSQ Quantum Access三重四级杆质谱仪;TGL-20W台式高速冷冻离心机(上海湘仪实验室仪器开发有限公司);实验室注射泵TYD02-04-CE(保定雷弗流体科技有限公司);XS-105型分析天平(瑞士METTLER TOLEDO)。
苦木注射液(江西青峰药业有限公司),批号:2016072303;注射用阿奇霉素(山东罗欣药业集团有限公司),批号:518013152;阿奇霉素对照品(中国食品药品检定研究院),批号:130593-201303;阿霉素(北京偶合科技有限公司);肺炎克雷伯标准菌株[CMCC(B)46117;中国食品药品检定研究院];甲醇、乙腈均为色谱纯;其余试剂均为市售分析纯;实验用水为娃哈哈纯净水。
健康雄性SD大鼠12只,体重(200±20)g,济南朋悦实验动物繁育有限公司实验动物中心提供[生产合格证书:SCXK(鲁)2014-0007],实验前1周进行适应性喂养。动物相关的所有实验均经烟台大学实验动物伦理委员会审核并批准。
1.2 实验方法
1.2.1 标准溶液的配制 AZM标准溶液:精密称取阿奇霉素对照品1.05 mg,置于10 mL容量瓶中,用甲醇溶解并定容,得质量浓度为0.105 mg/mL的储备液。放置4 ℃贮藏,备用。
阿霉素标准溶液:精密称取阿霉素对照品5.07 mg于10 mL容量瓶中,用甲醇溶解并定溶,得质量浓度为507 μg/mL的储备液,再逐级稀释成质量浓度为250 ng/mL的内标溶液,备用。
1.2.2 大鼠细菌感染性肺炎模型建立 实验动物为SD雄性大鼠,采用气管注入法建立大鼠肺炎模型[12-13]。将大鼠腹腔注射10%水合氯醛(0.3 mL/100 g)使其麻醉,滴入0.05 mL处于对数生长期的肺炎克雷伯菌(4×107CFU/mL),接种后立即竖立于固定台,保持直立位约20 s,以保证接种菌液受重力作用流入支气管和肺泡内进行肺部感染。造模前大鼠全血中白细胞与中性粒细胞的数目分别为(8.61±1.11)×109个/L、(3.02±1.27)×109个/L,造模后全血中白细胞数目及中性粒细胞数分别为(22.07±5.32)×109个/L、(15.55±3.92)×109个/L,显著增加2.6倍和5.1倍,肺组织经HE染色显示有大量炎性细胞浸润,表明造模成功。
1.2.3 动物分组与给药方案 造模成功的大鼠给药处理前禁食不禁水12 h,称重、编号后随机分为对照组和实验组(n=6)。对照组经尾静脉注射AZM,实验组以同样方式给予AZM和KM,剂量均为75 mg/mL,每日1次,连续给药1周。
1.2.4 血浆样品采集与预处理 末次给药24 h后,断尾取血0.5 mL于肝素化EP管中,轻轻振摇,4 ℃下离心10 min(8000 r/min),移取上清液于洁净EP管中,-20 ℃保存。
取血浆50 μL至EP管中,加入内标溶液(250 ng/mL)50 μL、0.02 mol/L Na2CO3300 μL和乙酸乙酯-异丙醇(95∶5)2 mL,涡旋混合2 min,4 ℃下离心10 min(12 500 r/min)。取上清液至洁净EP管中,37 ℃水浴中氮气流吹干,加入流动相200 μL复溶,涡旋离心,取上清5 μL,进样检测。
1.2.5 组织样品采集与预处理 末次给药24 h后,脱颈椎处死大鼠,取出心、肝、脾、肺、肾,用生理盐水洗净组织表面浮血,滤纸吸干残余液体,称重,-20 ℃保存待测。
精密称取组织样品置匀浆机中,按照质量∶体积为1∶5的比例加入纯水,充分匀浆,4 ℃离心10 min(3600 r/min),取组织匀浆上清液50 μL至EP管中,依次加入内标溶液(250 ng/mL)50 μL、0.02 mol/L Na2CO3300 μL和乙酸乙酯-异丙醇(95∶5)2 mL,涡旋混合2 min,4 ℃离心10 min(12 500 r/min)。取上清液至洁净EP管中,37 ℃水浴中氮气流吹干,加入流动相200 μL复溶,涡旋离心,取上清5 μL,进样检测。
1.2.6 色谱条件 色谱柱:WATERS, ACQUITY UPLC BEH C18柱(2.1×50 mm,1.7 μm);流动相:0.1%甲酸水-乙腈(30∶70);柱温:30 ℃;流速:0.2 mL/min;进样量:2 μL。
1.2.7 质谱条件 电喷雾离子源(ESI),正离子方式检测,扫描方式为单反应监测(SRM),用于定量分析的离子反应分别为AZMm/z749.20→591.04、内标阿霉素m/z543.90→396.61,离子喷射电压4 kV,毛细管温度350 ℃,鞘气压力30 psi,辅助气压力5 psi,AZM和内标的碰撞能量(CE)分别为35、17 eV。
1.2.8 方法学考察 参考中国药典(2015版)生物样品定量分析方法验证的指导原则以及文献[14-16],进行了方法学考察,主要包括专属性、线性范围和定量下限、精密度及准确度、回收率、基质效应和稳定性。
2 结 果
2.1 方法学考察
2.1.1 专属性 取空白血浆和组织匀浆、含AZM和内标的空白血浆和组织匀浆以及给药后的大鼠血浆和组织匀浆,按“1.2.4”和“1.2.5”项下方法处理后进行检测。结果显示,血浆和组织中的内源性物质不干扰AZM的测定,方法的专属性良好(图1,仅以肝为例)。

图1 LC-MS/MS测定大鼠肝中AZM浓度的典型色谱图
2.1.2 线性范围与定量下限 取空白血浆制成含AZM质量浓度分别为0.1,1,10,20,50,100 ng/mL的系列样品,加入内标(250 ng/mL)50 μL,按“1.2.4”项下方法处理后测定,记录色谱图,以待测药物浓度为横坐标,待测物与内标的峰面积比值为纵坐标,用加权(W=1/X2)最小二乘法进行回归运算,求得回归方程。结果表明:血浆中AZM在0.1~100 ng/mL范围内线性关系良好(r>0.995 4),最低定量浓度为0.1 ng/mL。
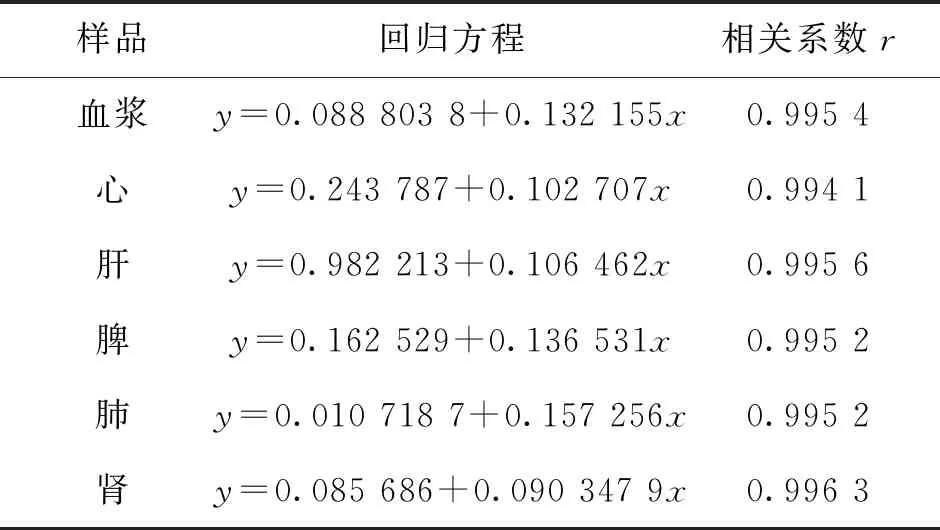
表1 血浆和组织中AZM测定的标准曲线
取空白组织匀浆制成含AZM质量浓度分别为1,10,20,50,100,200,500 ng/mL的系列样品,加入内标(250 ng/mL)50 μL,按“1.2.5”项下方法处理后测定,记录色谱图,以待测药物浓度为横坐标,待测物与内标的峰面积比值为纵坐标,用加权(W=1/X2)最小二乘法进行回归运算得回归方程。结果表明:脾、肺、肾组织中AZM测定的线性浓度范围为1~100 ng/mL,肝、心组织中AZM测定的线性浓度范围分别为1~500 ng/mL和1~200 ng/mL(r>0.99),各组织的最低定量限均为1 ng/mL。
2.1.3 精密度与准确度 按样品处理方法平行制备低、中、高质量浓度含药血浆和组织质控样品各9份(n=3份/批×3批),进样检测后计算日间、日内精密度和准确度,结果见表2。测定结果表明:低、中、高质量浓度AZM测定的日内、日间精密度(RSD)均小于10.8%,准确度(RE)均小于10.1%,满足生物样品定量分析方法要求。

表2 AZM在血浆和组织中的精密度和准确度
2.1.4 回收率与基质效应 按样品处理方法制备低、中、高质量浓度的质控样品,进样检测后的目标分析物的峰面积为A;将空白血浆和组织匀浆按样品处理方法进行预处理,再加入AZM和内标的标准溶液进样分析,得到目标分析物的峰面积B;制备相应质量浓度的标准溶液,得目标分析物的峰面积C。以“(A/B)×100%”计算提取回收率,以“(B/C)×100%”考察基质效应。由表3可见,AZM在大鼠血浆和组织中的回收率均大于80%且无明显的基质效应,符合生物样品定量分析的要求。

表3 AZM在血浆和组织中的回收率和基质效应
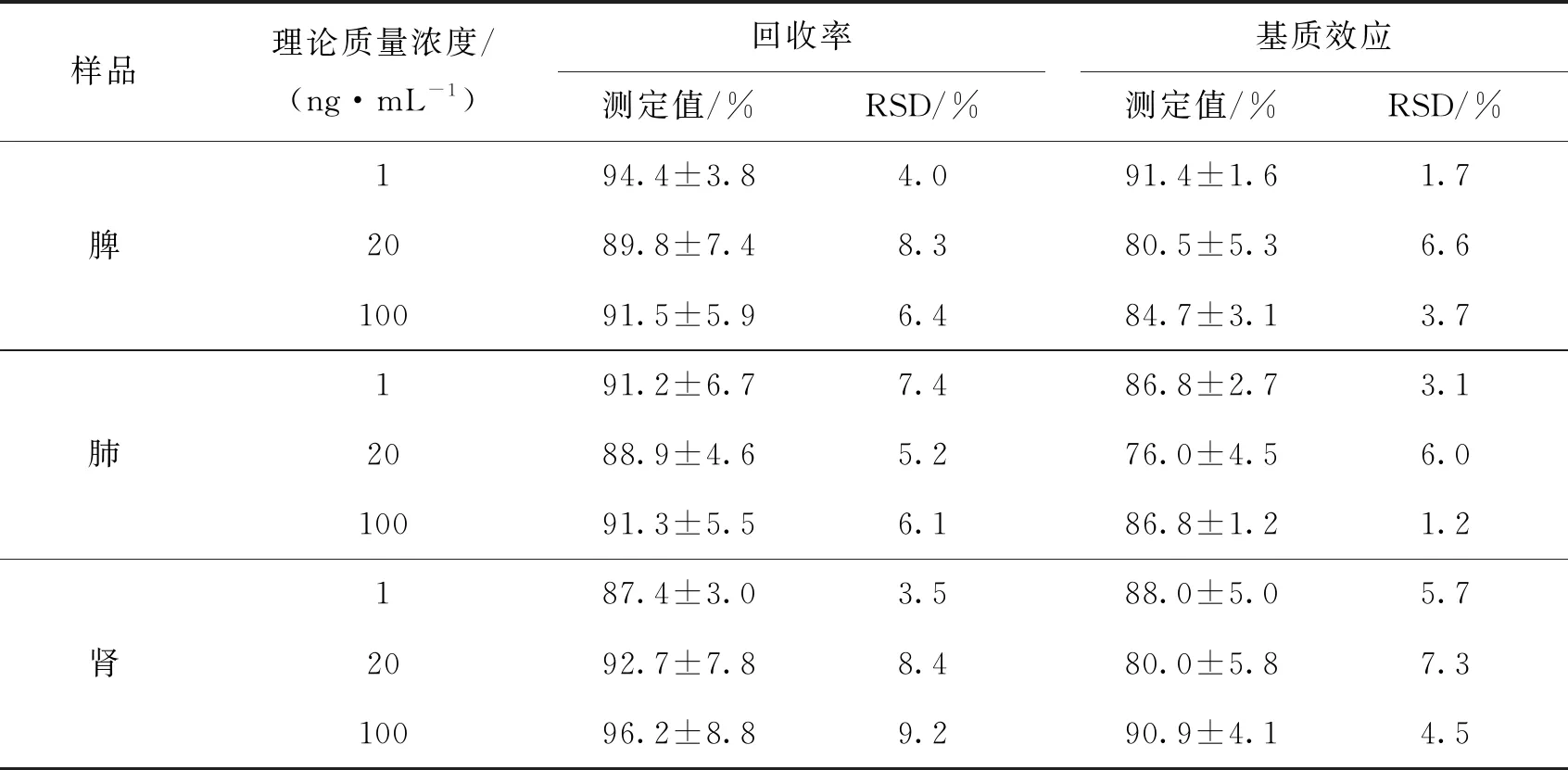
表3(续)
2.1.5 稳定性 取空白大鼠血浆和组织匀浆,分别加入低、中、高质量浓度的标准溶液配制质控样品,考察样品在自动进样器放置24 h、室温放置2 h、3次冻融循环及在-20 ℃下放置14 d的稳定性,每种条件下每浓度3个平行样本。实验结果如表4所示,AZM在不同条件下的RSD均小于9.7%,表明血浆和组织样品的AZM在上述条件下均具有良好的稳定性。

表4 不同条件下AZM在血浆和组织中的稳定性
2.2 组织分布研究
根据预实验结果,血浆和各组织中的AZM浓度均远高于标准曲线的范围,因此对血浆和组织匀浆进行稀释,血浆稀释5 000倍,心稀释2 000倍,肝稀释10 000倍,脾、肺、肾均稀释20 000倍。对照组和实验组大鼠体内各组织中AZM的浓度测定结果见图2。结果发现:与对照组相比,实验组AZM在心和肝中的药物浓度显著降低(P<0.05),在血浆和其他组织中未见有显著性差异。研究结果表明,KM与AZM联用可能加快了AZM在肺炎大鼠心和肝中的代谢,从而降低心和肝中的药物蓄积,有利于减轻AZM的不良反应。
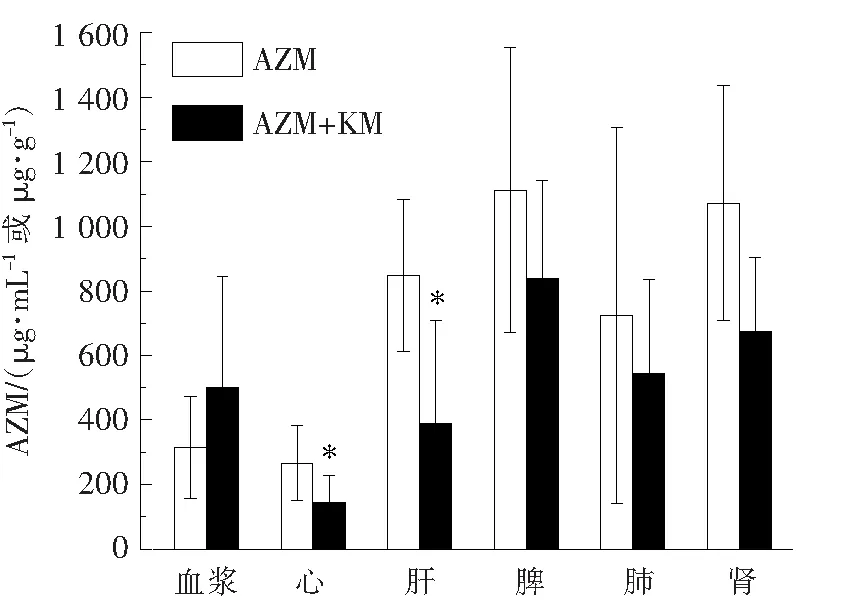
与对照组相比,*P<0.05。
3 讨 论
根据实验室前期研究结果发现,AZM与KM联用对肺炎克雷伯菌具有显著的抑菌效果,因此本研究选取肺炎克雷伯菌造模,并给予模型大鼠同等剂量的AZM和/或KM。药效学研究结果表明,AZM联合KM对大鼠肺组织炎症的治疗效果最强。AZM在静脉注射给药吸收后具有高度的组织选择性和细胞渗透性的特点,脾、肝、肺和肾中的分布尤为明显,其在组织中的药物浓度明显高于血浆,这与文献报道是一致的[17]。由于AZM本身单剂量给药后血浆代谢消除半衰期长达35~38 h,且排泄较慢,有较强的抗生素后效应,加之较长时间的连续用药,使AZM的组织浓度增加,产生蓄积,增加肝损害的风险。因此本实验将肺炎大鼠单用AZM及AZM联合KM给药后在各组织的AZM含量进行比较,结果显示在各组织中,联合给药组的AZM含量均低于AZM单药组,并在心和肝中显著降低,表明KM可以加快AZM在各组织中的代谢消除,避免AZM在体内蓄积造成肝脏损害。
4 结 论
本研究建立并验证了测定大鼠血浆和组织中AZM浓度的LC-MS/MS方法,方法学验证结果均符合生物样品分析指导原则的要求,通过比较AZM单用和AZM联用KM后AZM在肺炎大鼠不同组织的分布差异,发现AZM与KM联用显著降低AZM在心和肝脏中的药物蓄积,加速AZM在体内的代谢,提高疗效的同时减少不良反应的发生,为临床AZM联合用药提供更多选择。
