红藻多管藻(Polysiphonia Urceolata)R-藻蓝蛋白、别藻蓝蛋白吸收系数测定及藻胆体藻胆蛋白组成分析
2021-07-16台丹丹赵明日
台丹丹,赵明日,孙 力
(烟台大学生命科学学院,山东 烟台 264005)
藻胆蛋白(Phycobiliprotein,PBP)是一类存在于原核蓝藻、真核红藻、部分隐藻和一些甲藻中的水溶性色素-蛋白复合体[1-2]。根据光谱特性,分为藻红蛋白(Phycoerythrin, PE)、藻红蓝蛋白(Phcoerycyanin, PEC)、藻蓝蛋白(Phycocyanin, PC)和别藻蓝蛋白(Allophycocyanin, AP)。构成红藻藻胆体(Phycobilisome,PBS)的藻胆蛋白为PE、PC、AP。其中多管藻(PolysiphoniaUrceolata)R-藻红蛋白(R-PE)在498、538、567 nm处有特征吸收峰[3-4];R-藻蓝蛋白(R-PC)在547、618 nm处有特征吸收峰[5];别藻蓝蛋白(AP和AP-B)在650、620 nm处有特征吸收峰和肩峰[6]。
藻胆蛋白的颜色由所含的藻胆素(Phycobilin)[1,4,7]决定。在蓝藻和红藻中藻胆素主要有藻红素(phycoerythrobilin,PEB)、藻蓝胆素(phycocyanobilin,PCB) 、藻尿胆素(phycourobilin,PUB)和藻紫胆素(phycobiliviolin,PVB) 4种,其中藻紫胆素仅存在于一些蓝藻所含有的PEC中[1,4]。在藻胆蛋白亚基中,藻胆素以单或双硫醚键与脱辅基蛋白共价相连,交联点相对保守[1,4,7],其光谱特性[8-11]取决于四吡咯发色团中共轭双键的数目及其π-电子的离域程度。例如,双键数目较多、π-电子离域程度较大的PCB在R-PC中所表现的特征吸收峰一般位于615~620 nm,在AP中红移至650 nm;双键数目较少、π-电子离域程度小的PUB在PE中所表现的特征吸收峰一般位于498~500 nm;双键数目和π-电子离域程度小于PCB大于PUB的PEB在R-PC中所表现的特征吸收峰位于548~550 nm,但在R-PE中其特征吸收峰可红移至565~570 nm。由此可见,相同的PCB、PEB在不同藻胆蛋白R-PC和AP中均可表现出不同的光吸收特性。这种现象表明,除了藻胆素种类和数目之外,影响藻胆蛋白光物理特性的主要因素还包括发色团与多肽链的共价连接方式、发色团的微环境及其构象、发色团间的相互作用及其能量传递关系[1,4,12]。多因素的综合影响还可使来源于不同藻种的同类藻胆蛋白表现出吸收光谱及光吸收系数的差异,这种种源差异会使藻胆蛋白的光吸收系数失去种源间的通用性。因此,利用光吸收系数进行藻胆蛋白间的相对含量比例分析前,必须在分离纯化制备出藻胆蛋白的基础上完成各藻胆蛋白光吸收系数测定。
藻胆体中藻胆蛋白以特定的组成比例在连接多肽的辅助下有序组装,为藻胆体单向、高效的光能传递提供了关键的结构支持,分析确定藻胆体藻胆蛋白的组成比例,可为利用透射电镜技术准确模拟构建藻胆体组装结构提供必要且关键的数据支持[13-14]。本研究以实验室前期工作为基础[15-16],利用多维层析技术方法,从多管藻藻胆蛋白提取液中分离纯化、制备低含量R-PC、AP。选用Bradford 法和Hartree-Lowry法[17-19],根据Lambert-Beer Law获得藻胆蛋白在特征吸收峰处的光吸收系数,建立以特定波长的光吸收值(A)为变量,藻胆蛋白质量浓度(CPE,CPC,CAP)为函数的线性方程组,用于藻胆蛋白提取液、层析产物、完整藻胆体及其部分解离产物等藻胆蛋白混合样品的藻胆蛋白组成及其相对含量与分子比例分析。
1 材料方法
1.1 材料
实验材料采自烟台海滨,将采集到的海生红藻多管藻按照质量体积比1∶3的比例浸泡在50 mmol/L磷酸缓冲液(PBS,pH 7.0)中48~72 h,待藻胆体破碎后,抽滤,离心(15 000×g,15 min,10 ℃),收集上清,再依次经500 kU和50 kU的膜包把样品分子质量截留在50~500 kU范围内,将蛋白提取液浓缩至吸光度A498> 7.0,4 ℃保存。
1.2 藻胆蛋白纯化制备
选用凝胶过滤、离子交换层析和疏水相互作用层析建立的多维层析技术方法,从多管藻藻胆蛋白提取液中分离纯化制备R-PC和AP[15-16]。
藻胆蛋白提取液利用Sephacryl S-300 (S-300)和Sephacryl S-200顺序进行凝胶过滤,S-300柱床5 cm×48 cm、S-200柱床2.5 cm×64 cm,洗脱液含200 mmo1/L NaC1 的50 mmo1/L PBS,洗脱流速6 cm/h,得到在 618和650 nm有特征吸收峰的R-PC/AP组分。
选用Q Sepharose Fast Flow进行离子交换层析,柱床1.6 cm×4.2 cm,选用600 mL 含有25 mmol/L PBS 的0~200 mmol/L 的NaC1 线性梯度、7.5~7.0 的pH值线性梯度溶液进行线性梯度洗脱,洗脱流速30 mL/h,根据洗脱曲线收集分别收集R-PC、AP组分。
选用Phenyl Sepharose 6 Fast Flow进行疏水相互作用层析,柱床 1.6 cm×4.2 cm,R-PC离子交换层析组分选用400 mL 425~10 mmol/L PBS、100~0 mmol/L NaCl进行线性梯度洗脱,AP疏水层析组分选用400 mL 200~10 mmol/L PBS 进行线性梯度洗脱,洗脱流速18 mL/h。疏水层析结束后根据洗脱曲线得到R-PC、AP和R-PC2。但疏水层析所得AP和R-PC2须选用非变性的聚丙烯酰胺凝胶电泳进一步纯化。
1.3 藻胆体样品的制备
按照本实验室已建立的多管藻藻胆体制备方法进行完整藻胆体的制备[20]。多管藻按照质量体积比1∶1的比例加入1 mol/L磷酸盐溶液,匀浆后18 000×g离心15 min,去沉淀取上清,经蔗糖密度梯度离心得到完整藻胆体样品。向保存在1 mol/L磷酸盐溶液中的藻胆体加水,将磷酸盐浓度稀释至0.2 mol/L,藻胆体解离为R-PE、R-PC、AP的混合溶液。
1.4 光谱检测
纯化的藻胆蛋白样品利用紫外分光光度计(UV-1900,北京普析)分别检测R-PC、AP在280、498、567、618、650 nm处的吸收值,并扫描样品在250~750 nm范围内的吸收光谱。
1.5 凝胶电泳
非变性的聚丙烯酰胺凝胶电泳(Native-PAGE)[21]分析藻胆蛋白的纯度。选用Bis-Tris HEPES电泳体系,pH=6.5,7%的分离胶(C=3%),pH=5.75,4%的浓缩胶(C=20%),稳流方式电泳。
1.6 光吸收系数的测定
本研究选用Bradford法、Hartree-lowry法,以牛血清蛋白和γ-球蛋白为标准蛋白[19],测定多管藻的蛋白质含量,Lambert-Beer law(A=K·C·L)求得藻胆蛋白吸收峰对应的光吸收系数,其中K为吸收系数〔L/(mg·cm)〕,L为比色皿的厚度(cm),C为浓度(mg/mL),紫外分光光度计测定吸光度,测定时,保证A约为0.2~0.8。
1.6.1 Bradford法蛋白定量 差光谱的测定:以牛血清蛋白为标准蛋白,与待测蛋白分别和含G-250的8.5%磷酸、4.75%乙醇溶液反应,选用不含G-250的磷酸-乙醇溶液作为参比液,分别测定考马斯亮蓝染液和标准蛋白、待测蛋白反应后在250~750 nm范围内的吸收光谱,计算蛋白与考马斯亮蓝染液反应前后的差光谱。由差光谱确定波峰和波谷,即为蛋白质与考马斯亮蓝染液反应最灵敏的吸收点,记为λ峰、λ谷。
蛋白质量浓度的测定:设计蛋白质量浓度梯度为0、10、20、30、40、50、60 μg/mL,首先加入相应浓度的蛋白溶液,与考马斯亮蓝G-250试剂旋涡混匀,室温反应30 min,确保蛋白质与考马斯亮蓝染液充分反应。测定标准蛋白的λ峰、λ谷吸光度,以体系中的蛋白质质量浓度为横坐标,标准蛋白的λ峰/λ谷为纵坐标绘制标准曲线。根据标准曲线选取合适的待测蛋白量,测定待测蛋白的λ峰/λ谷,由标准曲线求得待测蛋白质量浓度。根据Lambert-Beer law,计算待测蛋白吸收峰对应的光吸收系数。
1.6.2 Lowry法蛋白定量 以牛血清蛋白和γ-球蛋白两种蛋白作为标准蛋白,设计蛋白质量浓度梯度为0、20、40、60、80、100 μg/mL,使其反应体积均为1 mL,充分混匀后分别加入0.9 mL的Hartree-Lowry试剂A,50 ℃水浴10 min,待冷却至室温加入0.1 mL Hartree-Lowry试剂B充分摇匀,置于室温下反应10 min 后加入3mL Hartree-Lowry 试剂C,50 ℃水浴10 min 后冷却至室温。在750 nm测吸光度,以蛋白质量浓度为横坐标,不同质量浓度的吸光度为纵坐标,绘制标准曲线。根据标准曲线上的吸光度范围选取合适的待测蛋白量,在750 nm下测吸光度,根据标准曲线确定待测蛋白质量浓度,由 Lambert-Beer Law 求出样品的吸收系数。具体实验方法参考文献[17-19]。
1.6.3 建立方程组 根据混合样品的光吸收值是各组分在任一波长吸光度的线性加和这一基本原理,利用Lambert-Beer law,建立R-PE、R-PC及AP特征光吸收A与质量浓度的线性方程组:
联立方程组,得到以A498、A567、A618和A651为变量,求CPE、CPC和CAP的方程组,用于计算藻胆体、藻红-藻蓝蛋白复合物及藻胆蛋白混合液中各藻胆蛋白的含量,进而分析各藻胆蛋白间的相对比例。
2 结果与讨论
2.1 藻胆蛋白的分离纯化
多维层析及层析后Native-PAGE得到的R-PC、AP的吸收光谱见图1,根据吸收光谱,纯化藻胆蛋白样品的Amax/A280均大于4.5,符合试剂级[22]。前期Native-PAGE实验结果[15]证明,多维层析后的R-PC蛋白纯度符合吸光系数测定的要求。
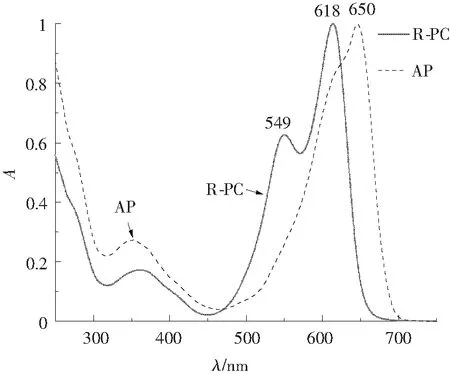
图1 2种纯化藻胆蛋白的吸收光谱
2.2 藻胆蛋白吸收系数的测定
2.2.1 Bradford法 牛血清蛋白与考马斯亮蓝G-250染液结合前后的吸收光谱及其差光谱如图2所示,与G-250染液的吸收光谱相比,牛血清蛋白与G-250结合后在465 nm处吸收显著降低、在649 nm处吸收显著升高,反应后的差光谱在465 nm出现最低吸收值、在590 nm处出现最大吸收值,说明牛血清蛋白与考马斯亮蓝结合后吸光度的变化主要集中在465~590之间,峰、谷两处吸收值的比值可敏锐反映考马斯亮蓝G-250和蛋白的结合量,选用牛血清蛋白的峰、谷比值A590/A466可进行藻胆蛋白质量浓度定量测定。

图2 牛血清蛋白与考马斯亮蓝G-250结合前后的吸收光谱及差光谱
R-PC、AP与考马斯亮蓝G-250染液反应前后的吸收光谱及其差光谱如图3所示,藻胆蛋白与考马斯亮蓝G-250结合后的吸收光谱与考马斯亮蓝G-250染液的吸收光谱相比, R-PC、AP与考马斯亮蓝染液结合前后在465 nm处的吸收值均未发生移动,与牛血清蛋白的吸收峰的变化相似。但在649 nm处的吸收峰分别移动到了644、646 nm处。R-PC、AP差光谱的λ峰分别在597和595 nm处,λ谷在466和469 nm处。R-PC、AP与考马斯亮蓝G-250结合后,吸收光谱变化不如牛血清蛋白显著,但是R-PC与AP吸收光谱的变化具有相似性。根据R-PC、AP的差光谱分别选择各自的峰谷进行吸收系数的测定。

图3 藻胆蛋白与考马斯亮蓝G-250结合前后的吸收光谱及差光谱
由牛血清蛋白A590/A465比值和蛋白质量浓度测定的标准曲线如图4所示,根据标准曲线测定的藻胆蛋白的特征吸收峰的吸收系数于表1。

图4 牛血清蛋白在A590/A465吸收比值处的标准曲线

表1 Bradford法测定的藻胆蛋白的特征吸收峰的吸收系数
2.2.2 Lowry法 由牛血清蛋白和γ-球蛋白在750 nm处的吸光度A750和蛋白质量浓度做出的标准曲线如图5。

图5 标准蛋白在A750吸收处的标准曲线
根据标准曲线测定出的藻胆蛋白特征吸收峰的吸收系数于表2。Lowry法测定的藻胆蛋白R-PC和AP的特征吸收峰的吸收系数,以牛血球蛋白作为标准蛋白时,R-PC测定的吸收系数小于以γ-球蛋白作为标准蛋白时测定的结果,AP则相反。且两种标准蛋白测定的结果中,R-PC吸收系数之间的差别大于AP,AP吸收系数之间的差别几乎可以忽略。Bradford法测定的结果与Lowry法测定的藻胆蛋白的特征吸收峰的吸收系数相比,以牛血球蛋白作为标准蛋白时,R-PC测定的吸收系数均大于以Lowry法测定的结果,与γ-球蛋白测定的结果相比,AP测定的吸收系数小于以Lowry法测定的吸收系数。

表2 Lowry法测定的藻胆蛋白的特征吸收峰的吸收系数
Bradford法作为一种检测灵敏度较高且使用便捷的蛋白测定方法,依赖于考马斯亮蓝G-250与蛋白质的结合。前期实验[19]在对多管藻、异管藻的PE进行吸光系数测定时,PE在与G-250结合前后的吸收光谱表现出很大不同,异管藻吸收光谱变化明显大于多管藻,因为异管藻PE易于解离而多管藻R-PE结构比较稳定,在与染液反应时,蛋白质的解离程度直接影响G-250与蛋白的结合,进而影响吸收光谱的变化。而Lowry 法是一种与肽键反应为基础的蛋白定量方法,测定时样品经NaOH处理后使蛋白样品的二级以上结构变性、解离,致使被检测蛋白的一级结构及其肽键可在后续反应中与检测试剂充分结合。与Bradford法相比,Lowry法基本消除了由于变性程度不同可能对蛋白定量产生的影响。以上实验结果进一步说明了Bradford法测定的结果受蛋白解离程度的影响。而且,考马斯亮蓝G-250在与蛋白质反应时,染液中的阴离子更容易与Pr中的赖氨酸和精氨酸残基结合,这种特异性可能导致该方法对不同蛋白的反应发生变化,使得Bradford法在不同蛋白之间的反应存在较大的差异,这也是该方法的主要缺点。因此,利用 Lowry 法测定的蛋白质量浓度及光吸收系数更准确,与牛血清蛋白作标准蛋白相比,考虑到两者间的结构特性差异,γ-球蛋白更适合在多亚基复合体蛋白定量中作标准蛋白。最终选用Lowry 法中以γ-球蛋白为标准蛋白时,测定的吸光系数值。参考魏星等[19]前期测定的R-PE的吸光系数值,三种藻胆蛋白的吸收系数汇总于表3。

表3 多管藻三种藻胆蛋白的特征吸收峰的吸收系数
2.2.3 方程组的建立 根据混合样品的光吸收值等于各组分在任一波长吸光度的线性加和这一基本原理,即A总=APE+APC+AAP,利用Lambert-Beer law,选取各藻胆蛋白的特征吸收峰,Lowry法中γ-球蛋白作为标准蛋白时测定的K值,计算蛋白质量浓度CPE、CPC、CAP。当以498 nm处的特征吸收峰计算R-PE时,所得方程组为
以567 nm处的特征吸收峰计算R-PE时,得
同理,针对仅含有R-PE和R-PC或R-PC和AP的藻胆蛋白样品,还可以建立相应的二元方程组。
最终解得两组有关藻胆蛋白含量的计算公式,以R-PE在498 nm的特征吸收峰的吸光系数计算蛋白含量时,根据不同色素的吸收光谱图可知,λ498不仅包括R-PE、R-PC的吸收值,而且还可能包括β-胡萝卜素及其蛋白复合体的光吸收干扰。在实际计算R-PE的含量时,来自β-胡萝卜素的光吸收被叠加到R-PE的光吸收值上,可能使测定的R-PE的含量高于实际值,而R-PC、AP含量低于实际值。当以λ567为R-PE特征吸收峰计算蛋白含量时,测定的A567仅可能包含极微量的叶绿素-蛋白复合体的吸收干扰,与A498相比可更准确地反映R-PE质量浓度;此外,A618和A651两值受叶绿素-蛋白复合体的吸收干扰会更大。因此,在进行藻胆蛋白含量测定时,藻胆蛋白样品中所含有的、在450~530 nm和550~660 nm有光吸收的杂质成分越少,对藻胆蛋白的干扰越小,定量结果越准确。
2.3 藻胆蛋白含量及其相对比例分析
以Lambert-Beer law为基础,利用所测得的R-PE、R-PC及AP光吸收系数,建立以藻胆蛋白特征光吸收(R-PEA498和A567,R-PCA618,APA651)为变量、蛋白质量浓度(CPE,CPC,CAP)为函数的方程组。利用方程组,根据藻胆蛋白样品的吸收光谱求得样品中各藻胆蛋白的质量浓度及其相对含量比例。这样不仅为跟踪藻胆蛋白分离纯化过程中所得样品中的各藻胆蛋白含量比例变化提供便利,而且还可用于完整藻胆体及其解离样品中R-PE、R-PC和AP含量分析,确定藻胆蛋白组分在藻胆体中的物质的量比例,为藻胆体有序组装研究提供有力支持。
2.3.1 R-PE、R-PC混合溶液中各藻胆蛋白含量的计算 取两个R-PE和R-PC含量确定的藻胆蛋白样品,按比例混合并测定各蛋白混合溶液在250~750 nm的吸收光谱(图6)及其在498、567、618 nm特征光吸收值(表4)。因样品中只含有R-PE和R-PC不含AP,因此用二元方程组:CPE=137.501A567-70.825A618,CPC=181.661A618-1.800A567,计算混合液中R-PE和R-PC的质量浓度,并与混合溶液中的藻胆蛋白质量浓度的加和值进行比较(表4)。
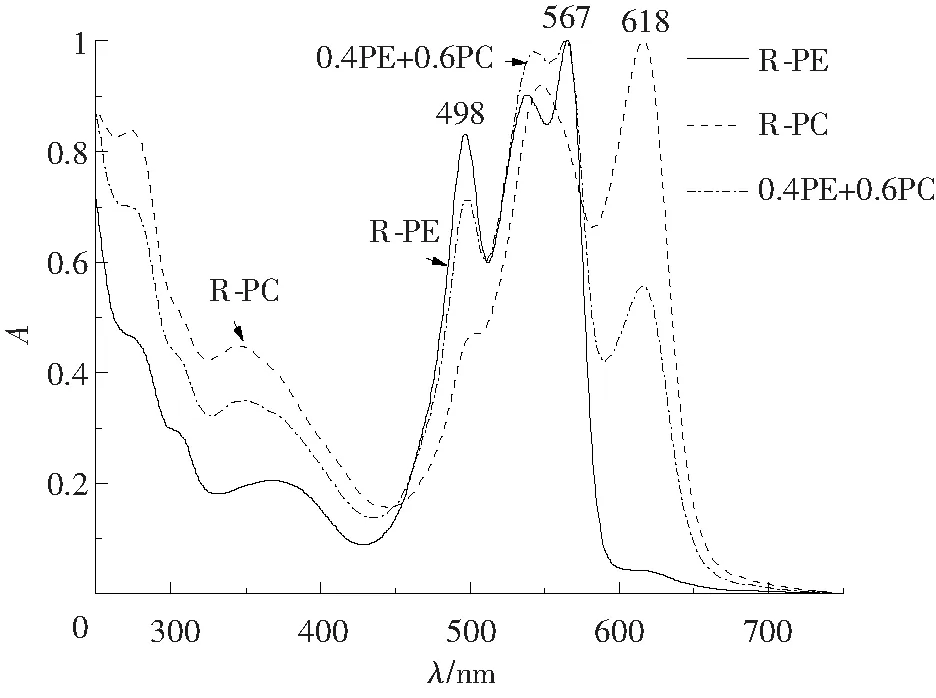
图6 R-PE、R-PC和混合样品的吸收光谱
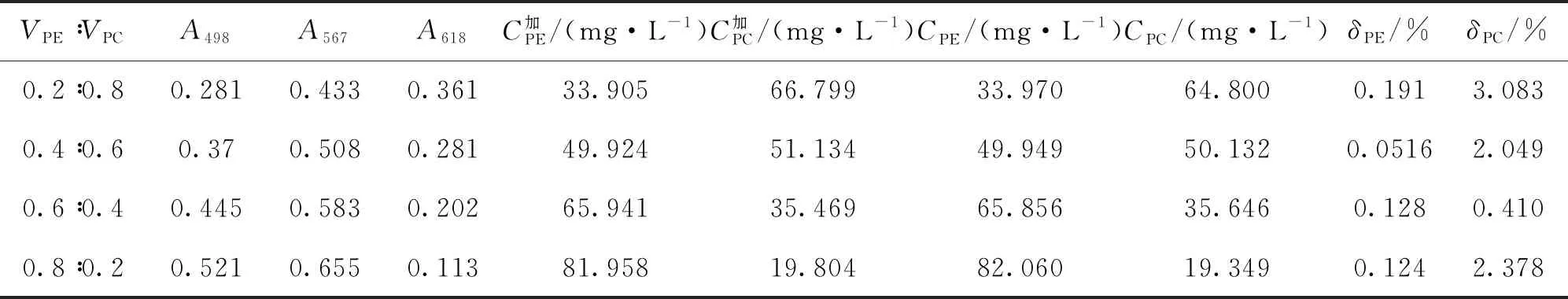
表4 混合溶液中R-PE、R-PC蛋白质量浓度
各混合液中的R-PE和R-PC来自按比例混合的两个藻胆蛋白样品,因此根据A567(或A498)和A618利用二元方程组求得的各混合液中R-PE和R-PC质量浓度的真实值应为两原始样品R-PE和R-PC浓度的加和值。

2.3.2 完整藻胆体和解离后的藻胆体中藻胆蛋白含量的计算 图7是完整藻胆体和解离藻胆体的吸收光谱。对比可知,藻胆体在解离前后吸收光谱在450~580 nm几乎完全相同,且在498、567 nm的特征吸收峰处无变化。但两者间的吸收光谱在580~680 nm和450~250 nm表现出明显差别。例如,藻胆体解离后651 nm处的AP光吸收明显降低,以约370 nm为中心的发色团的光吸收也明显降低。分别测定完整藻胆体和解离后的藻胆体在498、567、618、651 nm处的特征光吸收值,便可利用三元方程组求得溶液中各藻胆蛋白(R-PE、R-PC和AP)的浓度,并根据已知分子质量计算出物质的量比。
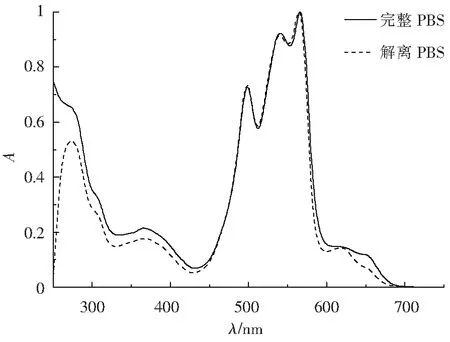
图7 完整藻胆体和解离藻胆体的吸收光谱
本实验室用Superdex 200凝胶过滤测出的多管藻六聚体R-PE和三聚体R-PC的分子质量分别为240 kU和136 kU。在用凝胶过滤进行R-PE与R-PC和AP分离时,三聚体R-PC和AP的洗脱峰重叠[15],表明两者有相同(或至少非常相近)的分子大小,因此三聚体AP应与三聚体R-PC具有相同136 kU的分子质量。藻胆蛋白的六聚体是由两个盘形三聚体以结构互补方式相叠复合而成,因此R-PC和AP六聚体的分子质量应小于等于272 kU,大于等于R-PE的240 kU。
藻胆体解离前后各藻胆蛋白的质量浓度如表5所示,依据藻胆体中各藻胆蛋白的质量浓度,当R-PE、R-PC、AP分别以240、272、272 kU计算物质的量比时,完整藻胆体中各藻胆蛋白的比例为12~13∶1∶3,解离完成之后各藻胆蛋白的比例为8~9∶1∶1。当R-PE、R-PC、AP都以240 kU的分子质量计算物质的量比时,完整藻胆体中各藻胆蛋白物质的量比为11~12∶1∶3,解离后各藻胆蛋白的比例为7~8∶1∶1。为方便与8∶1∶1对比,完整藻胆体的12∶1∶3可改写成8∶2/3∶2。就数值来看,似乎完整藻胆体中的AP增大了一倍,同时R-PC减少了1/3。这种变化应与藻胆蛋白在藻胆体有序组装时建立的R-PC与AP间的相互作用密切相关,这种相互作用导致其特征光吸收增加或减少。例如,AP在618 nm处的特征吸收肩峰向651 nm吸收峰偏移,致使651 nm光吸收增加;又如,R-PC 618 nm吸收峰向长波偏移导致618 nm 处的光吸收降低。这一结果也证明,在用分光光度法测定藻胆蛋白及其他有色分子溶液成分质量浓度时,溶液中各成分的质量浓度必须足够低,以保证各种分子均处于无分子间相互作用的独立分布状态。

表5 藻胆体解离前后各藻胆蛋白的浓度及相对比例
2.3.3 S-300、S-200凝胶过滤R-PC/AP混合样品中R-PC、AP的比例 本研究在从多管藻藻胆蛋白提取液制备R-PC和AP时,首先先用S-300凝胶过滤分离R-PE同时富集R-PC/AP组分,R-PC/AP组分再经S-200凝胶过滤以除去残留的R-PE。根据两种凝胶过滤所得R-PC/AP组分在567、618及651 nm的光吸收值,利用三元方程组可计算R-PC、AP的质量浓度及物质的量的比值,结果如表6所示。从S-300、S-200 R-PC/AP样品的吸收光谱(图8)中可以看出,位于R-PE的特征光吸收490~570 nm的吸收光谱明显下降,结合表5中R-PE的质量浓度变化,可以看出S-300样品经S-200凝胶过滤后R-PE含量明显降低,S-300中R-PC和AP物质的量比3.322∶1,S-200中R-PC与AP的物质的量比为3.429∶1。这一结果表明,S-200凝胶过滤只是除去了S-300残留的部分R-PE,对R-PC和AP的相对含量的影响不大。
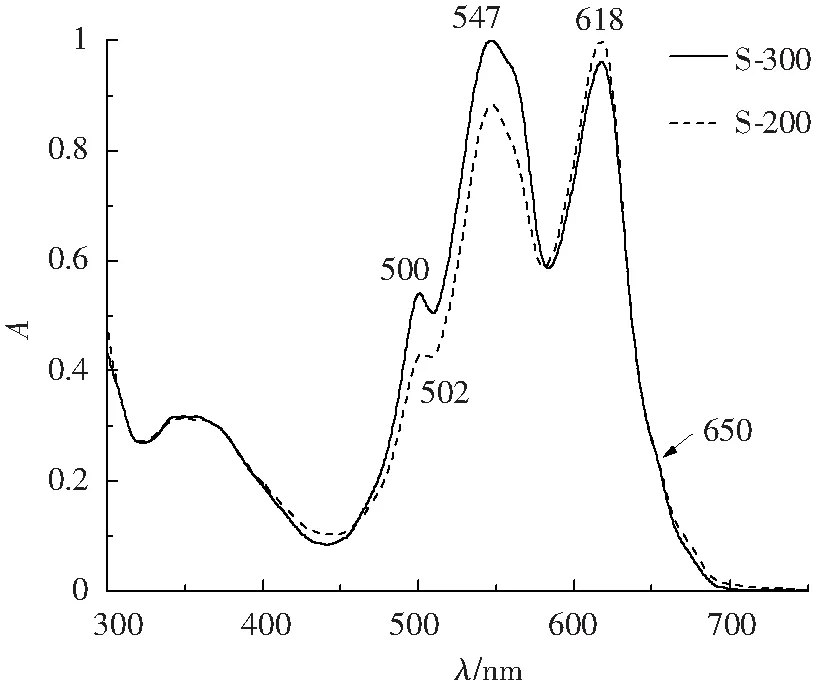
图8 S-300、S-200 R-PC/AP样品的吸收光谱

表6 S-300、S-200 R-PC/AP溶液中各蛋白质量浓度
与藻胆体中R-PC与AP 1∶1的组成比例相比,大于3∶1的R-PC与AP的比例表明,从藻胆蛋白提取到S-200凝胶过滤的实验过程中有AP的丢失。从技术方法来看,这种AP丢失最大的可能是发生在多管藻藻胆蛋白提取是否充分上,因为在藻体中AP位于与类囊体膜直接接触的藻胆体核结构域中。 就此而言,从完整藻胆体分离制备AP组分应更有利,但高质量藻胆体样品的制备量是一个关键的限制因素。
3 结 论
根据Bradford 法和Hartree-Lowry法,与结构比较稳定的多管藻六聚体R-PE相比[19],两种方法测得的R-PC和AP光吸收系数差别相对较小。进一步证明,Bradford法测定蛋白含量与样品蛋白质变性解离程度密切相关,而以γ-球蛋白作标准蛋白的Hartree-Lowry法更适合于多亚基复合体蛋白的含量测定。因此,选用γ-球蛋白作标准、Hartree-Lowry法测定蛋白含量所获得的光吸收系数,建立了相对误差符合低浓度蛋白含量测定要求的、可利用特征吸收值计算R-PE和R-PC质量浓度的一个二元线性方程组和计算R-PE、R-PC和AP的两个三元线性方程组。
根据吸收光谱,利用三元方程组进行的完整藻胆体和解离藻胆体样品藻胆蛋白组成分析表明:藻胆体中的R-PE、R-PC和AP物质的量比例为11~13∶1∶3,而藻胆蛋白分子间已无相互作用的解离藻胆体的R-PE、R-PC和AP物质的量比例则为7~9∶1∶1。这种R-PC与AP物质的量比例的显著差别,无疑应来源于有序组装藻胆体中R-PC和AP之间的结构互补性相互作用,其结果将更有利于R-PE捕获的光能经过R-PC向AP的单向、高效传递。与本文分析确定的多管藻藻胆体中1∶1的R-PC和AP物质的量比不同,近期以利用冷冻电竞技术重构的红藻GriffithsiaPacifica[13]和Porphyridiumcruentum[14]藻胆体的R-PC与AP的物质的量比均为6∶4 (3∶2)。与藻胆体的3柱体核相比,在两者相同的核结构域的两个基部柱体(A)中各少了一个编号为4的三聚体AP-B,在顶部柱体中少了一对编号为1和2的三聚体AP;然而,在文章中均未给出源于其他方法分析确定的PE、PC、AP在藻胆体中的组成比例。此外,早期的研究报道[23]已确定,Porphyridiumcruentum藻胆体中是含有AP-B的。AP-B是藻胆体中除AP-LCM之外的另一个末端发射体,其主要功能之一是在藻胆体与PS I三聚体侧向接触时作为桥梁向PS I传递光能[12],以调节PS II与PS I之间的光能供应平衡。就此而言,缺少AP-B会对红藻尤其是底栖红藻的光能利用及其光合效率产生非常不利的影响,因此对红藻的光合及生长不具有合理性,需进一步研究予以确定。
本实验分析确定的多管藻藻胆体中藻胆蛋白的组成比例及在完整藻胆体中由于结构互补性相互作用而表现出的相对比例变化,将为藻胆体中R-PE、R-PC、AP的有序组装以及光能的单向、高效传递提供有力的数据支持。同时,本研究所建立的二元和三元线性方程及藻胆蛋白定量分析方法,也为后续研究工作中藻胆蛋白溶液的R-PE、R-PC及AP组成分析建立了便利的技术基础。
