通心络胶囊对大鼠低压低氧暴露后炎症反应和脑组织水肿及认知功能的影响
2021-07-15刘鹏飞胡艳婷姜静雯赵晟邓会薛新颖潘磊崔磊王勇乔辉李天佐赵斌江
刘鹏飞胡艳婷姜静雯赵 晟邓 会薛新颖潘 磊崔 磊王 勇乔 辉李天佐赵斌江*
(1.首都医科大学附属北京世纪坛医院,北京 100038;2.北京急救中心,北京 100038)
低压低氧导致的认知障碍及脑水肿是高原环境急性期一种常见的表现类型,也是高原相关性脑病的病理基础[1]。 大脑对缺氧的耐受力差,低氧会出现形态学异常,炎症与应激反应,代谢紊乱[2]。部分患者可以出现神经心理障碍,包括焦虑、抑郁、睡眠障碍,认知损伤,反射迟钝等[3]。 既往研究表明,高海拔暴露引起的氧化应激及炎症反应是高原脑病发生、发展的关键因素[4-5]。 严重的炎症导致炎症因子的过度释放,包括白细胞介素(IL-1β)、肿瘤坏死因子(TNF-α)、IL-6[5-6]。 这些介质可进一步诱发血脑屏障损伤、脑水肿和细胞凋亡。 这些细胞因子受到 TLR-4/MyD88/NF-κB 信号通路的调控[7],所以本研究选择 TLR-4/MyD88/NF-κB 信号通路与高原脑病之间的关系。
通心络是一种广泛应用于临床的中药制剂,主要成分包括人参,水蛭,全蝎等[8]。 近年来研究发现通心络可以抗氧化应激,抗炎,改善内皮功能,目前临床中广泛应用于心脑血管疾病[9-10]。 但是其对低压低氧导致的脑水肿及认知障碍并无明确报道。 因而本研究拟建立低压低氧环境模拟高原模型,从TLR-4/MyD88/NF-κB角度揭示可能的作用机制,为临床高原脑病的防治提供一定的实验依据。
1 材料和方法
1.1 实验动物
成年雄性 Sprague-Dawley 大鼠 64 只(8 周龄,180~220 g,清洁级)购置于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。 所有大鼠饲养于北京世纪坛医院动物实验室,所有操作均在世纪坛医院动物屏障设施内进行[SYXK(京)2017-0025]。 本实验已经通过北京世纪坛医院动物实验伦理委员会批准(2019 年科研伦审第(49)号)。 本实验方案符合中国卫生部《动物管理规定》(2001 年第55 号文),并且按照实验动物“3R”原则执行。
1.2 主要试剂与仪器
通心络购置于石家庄以岭药业股份有限公司(批号为090226),经高效液相色谱(HPLC)和气相色谱(GC)分析鉴定,通心络的主要化学成分为人参皂苷Rg1、人参皂苷b1、异龙脑、冰片、芍药苷、红枣苷A、红枣苷B,具有多种生物活性。 兔抗TLR-4 多克隆抗体(ab217274,Abcam,英国);兔抗 MyD88(ab2064,Abcam,英国);兔抗 p-NF-κB p65 多克隆抗 体 ( ab16502, Abcam, 英 国 ); 兔 抗-IκB-α(ab32518,Abcam,英国)单克隆抗体;兔抗-AQP4 多克隆抗体(ab125049,Abcam,英国);兔抗-MMP9-单克隆抗体(ab58803,Abcam,英国);β-actin 一抗(ab8227,Abcam,英国);白介素(IL)-1β、IL-6 和肿瘤坏死因子(TNF)-α 酶联免疫吸附实验(ELISA)试剂盒购置于武汉伊莱瑞特生物科技股份有限公司(批号:E-EL-R0012c,E-EL-R0896c,E-EL-R2856c);光学显微镜(Olympus,徕卡,德国)。
1.3 实验方法
1.3.1 实验分组
实验开始前,64 只成年雄性Sprague-Dawley 大鼠在温度(23±2)℃、湿度(55%~60%)、光照/暗循环12 h 的空调环境中适应性饲养7 d,并饲喂实验室标准饲料和水。 适应期结束后,所有大鼠在水迷宫(morris water maze,MWM)中进行5 d 的定位航行训练,形成记忆。 然后随机分为四组,每组16 只。正常组(C):饲养在常压常氧环境中,给予0.9%生理盐水灌胃 7 d,每天1 次,作为对照;通心络组(TXL):饲养在常压常氧环境中,予1.6 g/(kg·d)通心络灌胃7 d,每天1 次;低压低氧组(HH):饲养在低压低氧环境中,予0.9%生理盐水灌胃7 d,每天1 次;低压低氧+通心络组(HH-TXL):饲养在低压低氧环境中,予1.6 g/(kg·d)通心络灌胃7 d,每天1 次。 低压低氧暴露7 d 后,每组随机取6 只大鼠进行脑水含量测定,其余大鼠大鼠进行旷场实验和水迷宫空间探索实验。
1.3.2 低压低氧环境建立
通过动物减压舱模拟海拔6000 m 高空,保持光照/黑暗循环12 h,气压为50 kPa,含氧量为10%(与海拔6000 m 相同)的环境,温度和湿度保持在25℃~27℃,55%~60%。 用新鲜空气(5~6 L/min)持续冲洗,补充大鼠消耗的O2,去除大鼠产生的CO2。 在30 min 的时间内,开始上升到目标高度的速率为 3 m/s。 每天上午 10 ∶00 打开腔室 1 h,补充食物、水、填充物和通心络处理。 大鼠连续7 d 暴露于6000 m 的环境中。
1.3.3 旷场实验
将大鼠置于旷场(100 cm×100 cm×50 cm)中央(上海玉研科学仪器有限公司,上海),内壁涂成黑色。 活动由视频跟踪系统自动记录,旷场分为中心区域和周围区域。 所有大鼠在旷场内探索5 min,记录大鼠走行的全程距离,记录大鼠在中心区域停留的时间。 每只大鼠在测试结束时,用75%的乙醇擦拭旷场,以避免嗅觉线索的出现。
1.3.4 水迷宫实验
水迷宫实验包括两部分,定位航行和空间探索实验。 采用Morris 水迷宫(上海玉研科学仪器有限公司,上海)(MWM)进行定位航行和空间探索测试。 圆形水池直径180 cm,深度60 cm,注水至50 cm 高度(温度22℃~24℃)。 水迷宫在概念上被平均划分为四个象限,标记为:I,II,III,IV。 在第III 象限中心,水面以下2 cm 处有一逃生平台。 水迷宫装置上方设置了摄像头和视频跟踪系统,监控并记录大鼠的游泳轨迹。 在低压低氧环境暴露前,所有大鼠均进行5 d 的定位航行实验。 在每次实验中,大鼠面对池壁,被随机放置在四个象限之一的水中。在每次实验中,初始象限的顺序是不同的。 所有老鼠允许在60 s 内找到隐藏的平台。 如果老鼠在60 s内没有找到平台,则引导大鼠到达平台,并在平台上停留10 s。 记录并计算大鼠的逃逸潜伏期(s)、游泳距离(cm)和平均速度(mm/s)。 在每个实验结束时,将大鼠擦干放进笼子里。 在7 d 低压低氧环境暴露结束后,进行空间探索实验。 撤掉平台,将大鼠面向池壁,从第I 象限放入池中,跟踪60 s。 记录大鼠通过原平台区域的次数,原平台所在象限停留的时间(s),及游泳速度(mm/s)。
1.3.5 脑水含量测定
采用干湿重法测定大鼠大脑含水量。 每组随机取6 只,处死,然后完整游离出两个大脑半球,称重记录湿重。 然后在100℃电热鼓风烘箱中烘干24 h,测定干重。 脑含水量(%)的计算公式为:(湿重-干重)/湿重×100%。
1.3.6 蛋白印迹
在行为学测试结束后,大鼠处死,然后完整游离海马组织,置于-80℃备用。 取部分海马组织驾驭组织裂解液,研磨,12000 r/min×5 min 离心,取上清。 采用Bradford 法检测相对蛋白浓度。 然后加入缓冲液,取50 μg 蛋白质样品采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,转移至PVDF 膜。 然后用5%脱脂奶粉封闭,TBST 漂洗,加入兔抗 TLR-4 多克隆抗体(1 ∶500,Abcam,英国),兔抗 MyD88(1 ∶1000,Abcam,英国),兔抗 p-NF-κB p65 多克隆抗体(1 ∶2000,Abcam,英国),兔抗-IκB-α(1 ∶2000,Abcam,英国)单克隆抗体,兔抗-AQP4 多克隆抗体(1 ∶2000,Abcam,英国),兔抗-MMP9-多克隆抗体(1 ∶1000,Abcam,英国)以及 β-actin 一抗(l:1000,Abcam,英国)。 然后与膜在4℃孵育过夜。 再用辣根过氧化物酶结合山羊抗兔IgG 抗体(1 ∶500,Abcam,英国)或辣根过氧化物酶偶联兔抗小鼠IgG抗体(1 ∶500,Abcam,英国)二抗孵育膜,用含0.1%Tween 20(TBST)的Tris 缓冲盐水洗三次后1 h。 使用凝胶成像和分析系统(Amersham 公司,美国)捕获和分析波段的化学发光信号(ECL kit,Thermo Fisher Scientific,美国)进行曝光,拍照。 研究中采用Image J 软件分析条带,将目的条带灰度值与内参βactin 条带灰度值比值反映目的蛋白的表达水平。
1.3.7 脑组织病理染色
行为学实验后,每组取2 只大鼠,麻醉后,暴露心脏,在右心耳剪切一小口,依次用0.9%生理盐水和4%多聚甲醛经升主动脉进行灌注,清除组织中血液。 然后迅速游离大脑并置于4%多聚甲醛固定,经100%、90%、70%分级乙醇脱水,二甲苯玻璃化,石蜡包埋,制成5 μm 厚的石蜡切片备用。 石蜡切片经二甲苯脱蜡,分级乙醇浸泡,苏木精染色5 min,伊红染色2 min,脱水。 在×400 放大倍数的光学显微镜下观察海马CA1 区形态。
1.3.8 酶联免疫吸附实验
行为学实验后采集血液2 mL,海马30 mg。 应用特异性酶联免疫吸附测定试剂盒检测血液及海马组织中的白介素(IL-1β)、肿瘤坏死因子(TNF-α)和IL-6 水平。 具体操作依照试剂盒中的说明执行。
1.4 统计学方法
采用SPSS 22.0 软件进行统计分析。 数据以平均数±标准差()形式记录。 行为学实验各项指标、脑水含量及炎症相关蛋白水平组间比较比较采用单因素方差分析,组间两两比较采用Bonferroni多重检验。P<0.05 为差异有统计学意义。
2 结果
2.1 通心络干预及低压低氧暴露对大鼠体重的影响
四组大鼠实验前体重比较,无统计学差异(P>0.05),低压低氧暴露7 d 后,四组大鼠组间比较体重无明显统计学差异(P>0.05)。 见表1。
表1 四组大鼠实验前后体重的变化(n=16, )Table 1 Body weight of rats in the four groups before and after the HH exposure
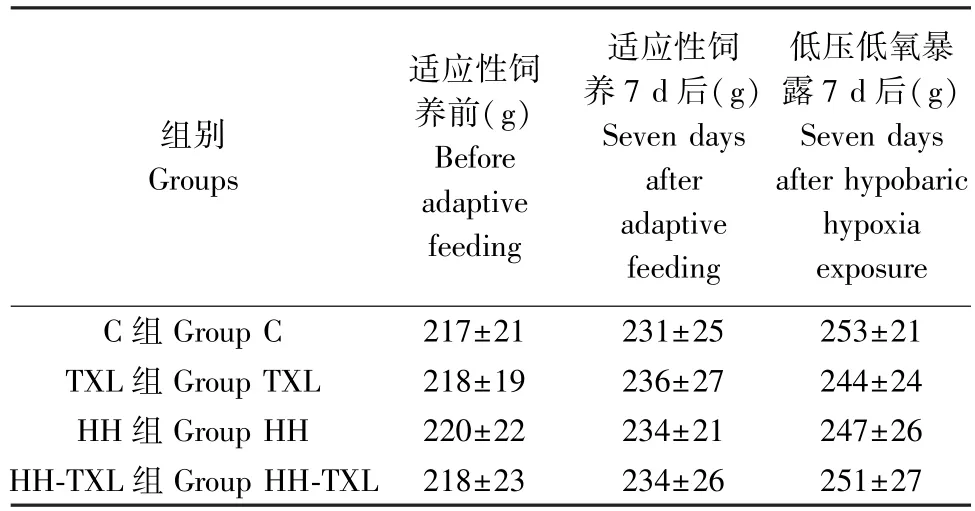
表1 四组大鼠实验前后体重的变化(n=16, )Table 1 Body weight of rats in the four groups before and after the HH exposure
注:C:对照组;TXL:1.6 g/(kg·d)通心络干预;HH:低压低氧组;HHTXL:低压低氧+1.6 g/(kg·d)通心络组。 下同。Note. C, Control group. TXL, TXL treatment with the dose of 1.6 g/(kg·d). HH, Hypobaric hypoxia exposure. HH-TXL, Hypobaric hypoxia exposure and TXL treatment with the dose of 1.6 g/(kg·d). The same as below.
组别Groups适应性饲养前(g)Before adaptive feeding适应性饲养7 d 后(g)Seven days after adaptive feeding低压低氧暴露7 d 后(g)Seven days after hypobaric hypoxia exposure C 组 Group C 217±21 231±25 253±21 TXL 组 Group TXL 218±19 236±27 244±24 HH 组 Group HH 220±22 234±21 247±26 HH-TXL 组 Group HH-TXL 218±23 234±26 251±27
2.2 通心络干预及低压低氧暴露对大鼠一般行为的影响
低压低氧暴露7 d 后,大鼠进行旷场实验,评价其一般行为表现的变化。 四组间比较,低压低氧暴露对大鼠运动的整体距离和中心区域停留时间无明显影响(P>0.05)。 通心络干预后,对正常组及低氧低氧组大鼠,均不影响旷场实验中大鼠运动的整体距离和中心区域停留时间(P>0.05),见表2。
表2 四组大鼠旷场实验的结果(n=10, )Table 2 Results of open field test in the four groups
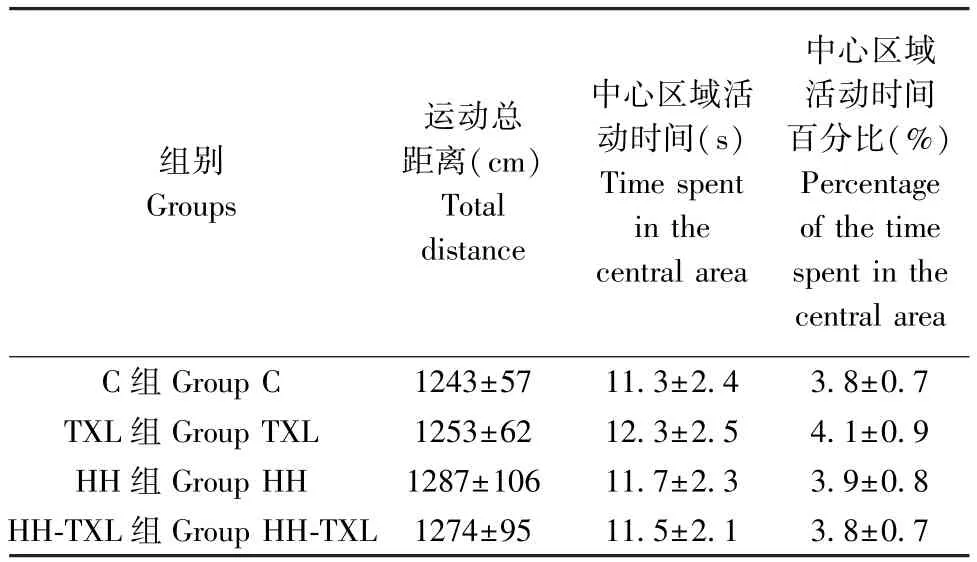
表2 四组大鼠旷场实验的结果(n=10, )Table 2 Results of open field test in the four groups
组别Groups运动总距离(cm)Total distance中心区域活动时间(s)Time spent in the central area中心区域活动时间百分比(%)Percentage of the time spent in the central area C 组 Group C 1243±57 11.3±2.4 3.8±0.7 TXL 组 Group TXL 1253±62 12.3±2.5 4.1±0.9 HH 组 Group HH 1287±106 11.7±2.3 3.9±0.8 HH-TXL 组 Group HH-TXL 1274±95 11.5±2.1 3.8±0.7
2.3 对大鼠空间记忆的影响
采用Morris 水迷宫(Morris water maze, MWM)测试评价大鼠海马相关的空间记忆能力。 低压低氧暴露前进行训练实验。 四组在同一时间点的逃避潜伏期比较,差异无统计学意义(P>0.05)。 训练第5 天的潜伏期明显短于第1 天时的潜伏期,提示通过训练大鼠行成记忆(P<0.05),见表3。
表3 四组大鼠定位航行实验结果(n=10, )Table 3 Results of navigation experiments in the MWM test of the rats
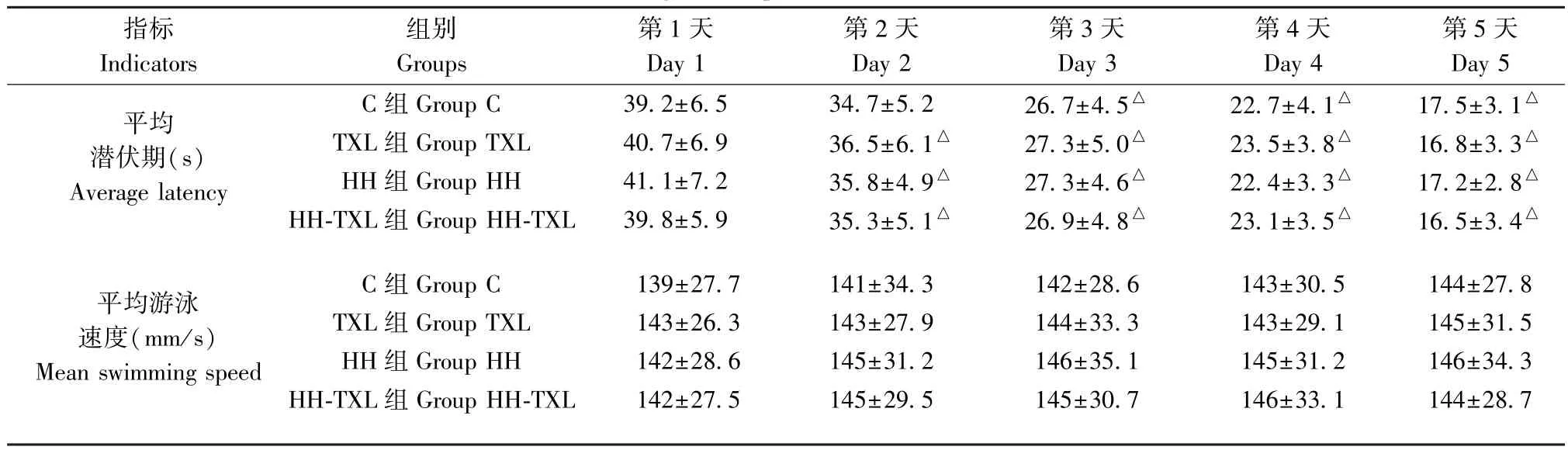
表3 四组大鼠定位航行实验结果(n=10, )Table 3 Results of navigation experiments in the MWM test of the rats
注:与 C 组相比,*P<0.05;HH-TXL 与 HH 组比较,#P<0.05;与 T1 时间点比较,△P<0.05。 下同。Note. Compared with group C,*P<0.05.Group HH-TXL compared with group HH,#P<0.05.Compared with the time of T1,△P<0.05. The same as below.
指标Indicators组别Groups第1 天Day 1第2 天Day 2第3 天Day 3第4 天Day 4第5 天Day 5平均潜伏期(s)Average latency C 组 Group C 39.2±6.5 34.7±5.2 26.7±4.5△ 22.7±4.1△ 17.5±3.1△TXL 组 Group TXL 40.7±6.9 36.5±6.1△ 27.3±5.0△ 23.5±3.8△ 16.8±3.3△HH 组 Group HH 41.1±7.2 35.8±4.9△ 27.3±4.6△ 22.4±3.3△ 17.2±2.8△HH-TXL 组 Group HH-TXL 39.8±5.9 35.3±5.1△ 26.9±4.8△ 23.1±3.5△ 16.5±3.4△平均游泳速度(mm/s)Mean swimming speed C 组 Group C 139±27.7 141±34.3 142±28.6 143±30.5 144±27.8 TXL 组 Group TXL 143±26.3 143±27.9 144±33.3 143±29.1 145±31.5 HH 组 Group HH 142±28.6 145±31.2 146±35.1 145±31.2 146±34.3 HH-TXL 组 Group HH-TXL 142±27.5 145±29.5 145±30.7 146±33.1 144±28.7
在低压低氧暴露结束后的空间探索实验中,与正常组比较,低压低氧暴露可显著减少大鼠穿越平台次数和在目标象限的停留时间(P<0.05)。 而1.6 g/(kg·d)通心络干预后,大鼠穿越平台次数和在目标象限的停留时间明显长于低压低氧组大鼠(P<0.05);但通心络对正常组大鼠空间探索实验无明显影响(P>0.05),见表4。
表4 四组大鼠空间探索实验结果(n=10, )Table 4 Results of probe trial in the MWM test of the rats

表4 四组大鼠空间探索实验结果(n=10, )Table 4 Results of probe trial in the MWM test of the rats
组别Groups原平台所在象限停留时间(s)The time spent in the quadrant with the original platform经过原平台次数(次数)Number of crossings (time)平均游泳速度(cm/s)Mean swimming speed C 组 Group C 36.5±6.6 5.3±1.2 143±26.8 TXL 组 Group TXL 37.1±7.1 5.1±0.8 145±31.2 HH 组 Group HH 19.7±4.1* 1.2±0.8* 143±29.7 HH-TXL 组 Group HH-TXL 28.1±4.8*# 3.3±0.9*# 147±27.3
2.4 对大鼠脑组织水肿的影响
与正常组比较,低压低氧组大鼠脑水含量明显升高,海马组织水通道蛋白4(AQP4)及基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)表达明显增强(P<0.05);1.6 g/(kg·d)通心络干预后,大鼠脑水含量、海马组织AQP4 及MMP-9 表达明显低于低压低氧组大鼠(P<0.05)。 而对正常组大鼠,通心络干预后,大鼠脑水含量、海马组织 AQP4 及MMP-9 表达无明显变化(P>0.05),见表5 及图1。
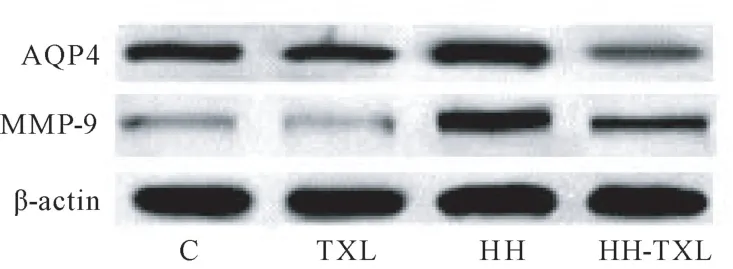
图1 Western blot 检测大鼠海马AQP4 及MMP-9 的表达Figure 1 Immunoblots of AQP4 and MMP-9 proteins in the hippocampus of the rats
表5 四组大鼠脑水含量及海马组织AQP4 和MMP-9 蛋白的表达( )Table 5 The brain water content, and the expression of AQP4 and MMP-9 protein inhippocampus of the rats
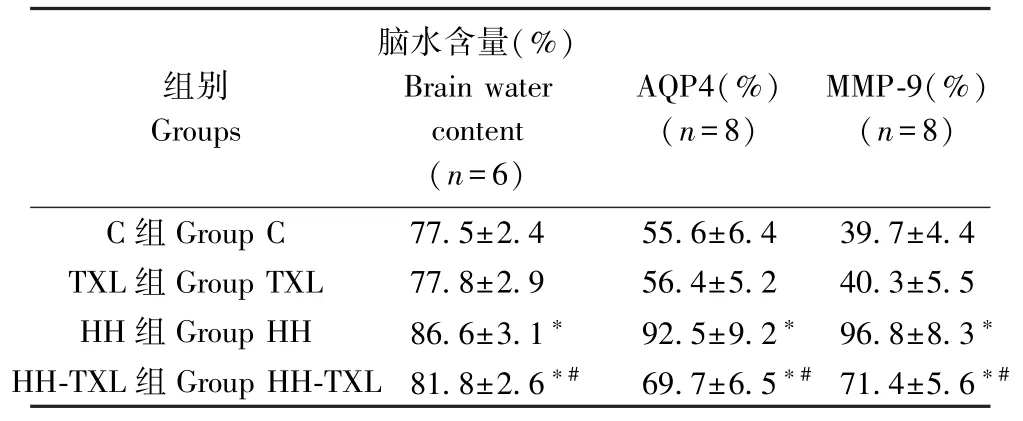
表5 四组大鼠脑水含量及海马组织AQP4 和MMP-9 蛋白的表达( )Table 5 The brain water content, and the expression of AQP4 and MMP-9 protein inhippocampus of the rats
C 组 Group C 77.5±2.4 55.6±6.4 39.7±4.4 TXL 组 Group TXL 77.8±2.9 56.4±5.2 40.3±5.5 HH 组 Group HH 86.6±3.1* 92.5±9.2* 96.8±8.3*HH-TXL 组 Group HH-TXL 81.8±2.6*# 69.7±6.5*# 71.4±5.6*#
病理染色提示,正常组及单纯通心络组海马区细胞排列整齐,边界清晰,数量多,层次分明。 而低压低氧组海马区细胞稀疏,排列不规则,边界模糊,细胞肿胀明显。 通心络干预后,神经元数目层次增多,边界相对清晰,见图2。
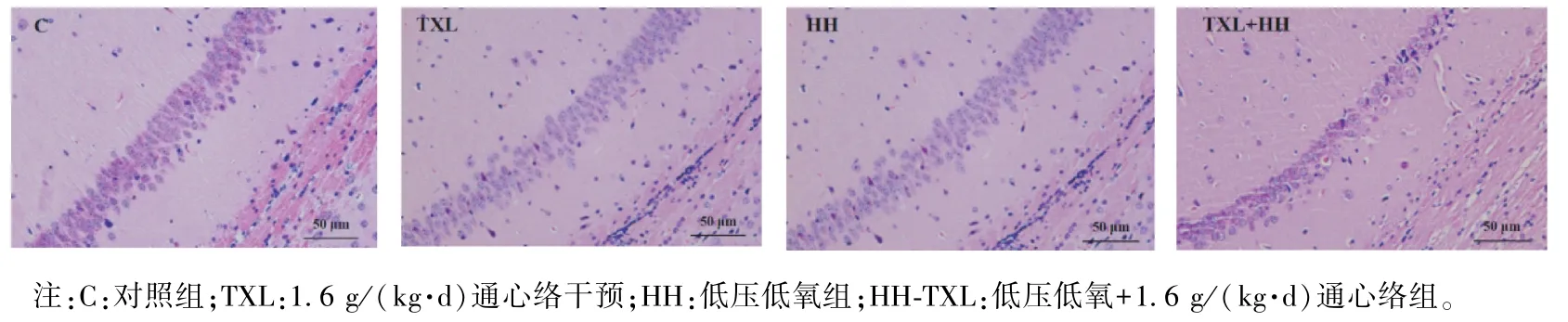
图2 大鼠海马组织苏木精-伊红染色Note. C, Control group. TXL,TXL treatment with the dose of 1.6 g/(kg·d). HH,Hypobaric hypoxia exposure. HH-TXL,Hypobaric hypoxia exposure and TXL treatment with the dose of 1.6 g/(kg·d).Figure 2 Hematoxylin-eosinstaining of rat hippocampus
2.5 对大鼠海马 TLR-4/MyD88/NF-κB p65 通路的影响
与正常组比较,低压低氧组大鼠海马组织TLR-4、MyD88、p-NF-κB p65 蛋白的表达明显升高(P<0.05),Iκ-Bα 的水平明显降低(P<0.05);通心络干预后,大鼠海马组织 Iκ-Bα 的水平明显升高(P<0.05),TLR-4、MyD88、p-NF-κB p65 蛋白的表达明显降低(P<0.05)。 但是单纯通心络干预对TLR-4/MyD88/NF-κB p65 通路无明显影响(P>0.05),见表 6 及图3。
表6 四组大鼠海马TLR-4、MyD88 和p-NF-κB p65 的表达(n=8, )Table 6 Expression of TLR-4、MyD88 and p-NF-κB p65 in hippocampus of rats
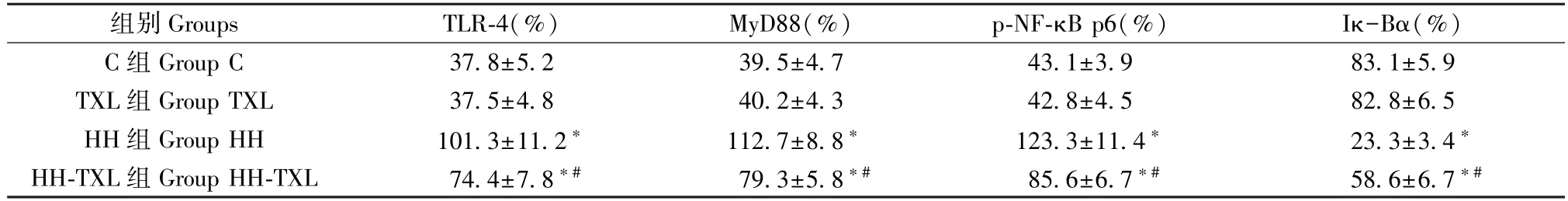
表6 四组大鼠海马TLR-4、MyD88 和p-NF-κB p65 的表达(n=8, )Table 6 Expression of TLR-4、MyD88 and p-NF-κB p65 in hippocampus of rats
组别 Groups TLR-4(%) MyD88(%) p-NF-κB p6(%) Iκ-Bα(%)C 组 Group C 37.8±5.2 39.5±4.7 43.1±3.9 83.1±5.9 TXL 组 Group TXL 37.5±4.8 40.2±4.3 42.8±4.5 82.8±6.5 HH 组 Group HH 101.3±11.2* 112.7±8.8* 123.3±11.4* 23.3±3.4*HH-TXL 组 Group HH-TXL 74.4±7.8*# 79.3±5.8*# 85.6±6.7*# 58.6±6.7*#
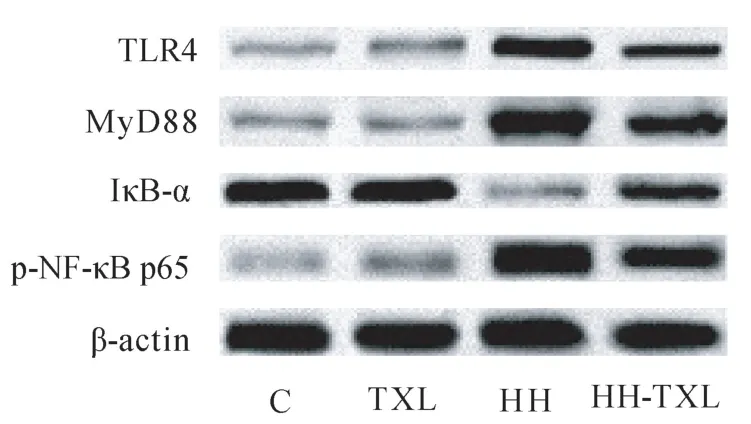
图3 Western blot 检测大鼠海马TLR-4、MyD88、NF-κB p65 和 IκB-α 的表达Figure 3 Immunoblots of TLR-4、MyD88、NF-κB p65 and IκB-α proteins in the hippocampus of the rats
2.6 对大鼠外周血及海马炎症因子水平的影响
与正常组比较,低压低氧暴露后大鼠海马及血清 IL-1β,TNF-α 及 IL-6 的 水 平 明 显 升 高 (P<0.05);1.6 g/(kg·d)通心络干预后,大鼠血清及海马组织的IL-1β, TNF-α 及IL-6 的水平较低压低氧组明显降低(P<0.05)。 单纯通心络干预对大鼠外周血及海马炎症因子水平无明显影响(P>0.05),见表7。
表7 大鼠外周血及海马组织IL-1β,TNF-α 和IL-6 的表达(n=8, )Table 7 Expression of IL-1β,TNF-α and IL-6 in hippocampus and serum of rats
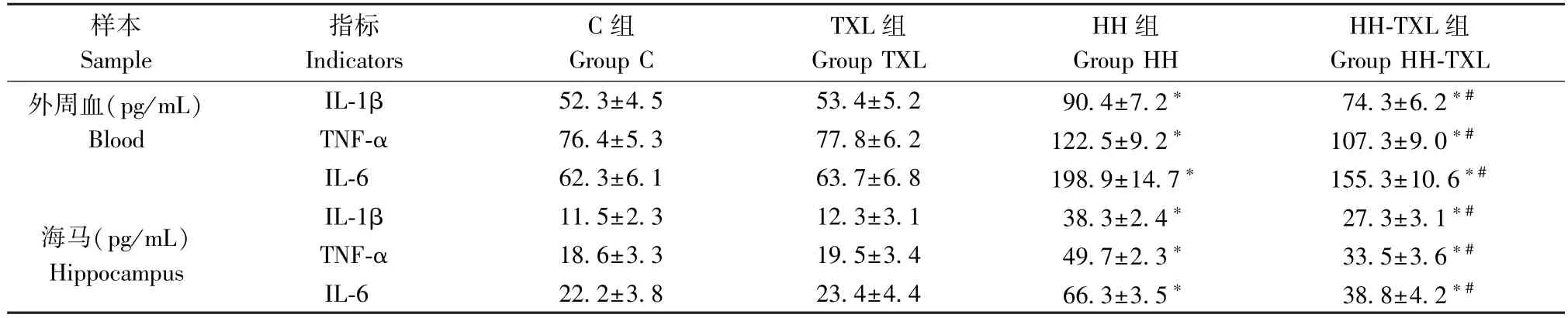
表7 大鼠外周血及海马组织IL-1β,TNF-α 和IL-6 的表达(n=8, )Table 7 Expression of IL-1β,TNF-α and IL-6 in hippocampus and serum of rats
样本Sample指标Indicators C 组Group C TXL 组Group TXL HH 组Group HH HH-TXL 组Group HH-TXL外周血(pg/mL)Blood IL-1β 52.3±4.5 53.4±5.2 90.4±7.2* 74.3±6.2*#TNF-α 76.4±5.3 77.8±6.2 122.5±9.2* 107.3±9.0*#IL-6 62.3±6.1 63.7±6.8 198.9±14.7* 155.3±10.6*#海马(pg/mL)Hippocampus IL-1β 11.5±2.3 12.3±3.1 38.3±2.4* 27.3±3.1*#TNF-α 18.6±3.3 19.5±3.4 49.7±2.3* 33.5±3.6*#IL-6 22.2±3.8 23.4±4.4 66.3±3.5* 38.8±4.2*#
3 讨论
随着西部大开发的推进,越来越多的人因工作,旅游或其他原因暴露于高原环境下。 高原属于低压低氧环境,因而短期或长期暴露会引起不同程度的高原反应。 其中急性高原反应是指在高原暴露后数小时或数天内发生高原缺氧而引起的一系列临床综合征,包括轻度高原反应、急性脑水肿、急性肺水肿等[1-2];而高原脑水肿多属于高原病的终末阶段,患者表现为头痛,恶心呕吐,严重者可出现共济失调,精神及认知、意识的改变。 因而如何有效的缓解高原反应,降低高原病的发生,具有重要的现实意义。
本研究中将大鼠置于低压低氧环境中7 d,作为急性高原暴露模型[3-5]。 结果发现,与正常组比较,低压低氧暴露7 d 后,脑水含量明显增加,病理染色提示海马区细胞肿胀,边界模糊不清,细胞数量明显减少。 提示低压低氧暴露7 d 后,出现了明显的脑组织水肿,同时行为学测试发现,大鼠认知功能明显减退,这与既往研究结果相符。 早期研究同样发现低压缺氧暴露3 d、7 d 甚至14 d 后,大鼠出现明显的脑组织水肿及认知功能障碍[11]。 同时研究检测了海马组织AQP4 及MMP9 的表达,发现低压低氧暴露后,海马组织AQP4 及MMP-9 水平明显升高。 AQP4 广泛分布于脑组织胶质细胞,血管内皮细胞等,在维持脑水平衡,稳定细胞微环境等方面发挥重要作用。 任何创伤,应激,低氧均可以导致AQP4 的异常表达,脑水肿发生[12]。 而 MMP-9 能够有效降解细胞外基质,抑制血管基底膜蛋白表达,导致血脑屏障受损[12]。 因此,进一步证明低压低氧暴露7 d 导致明显的脑组织水肿。
对于高原导致的脑水肿如何有效的防治,目前尚无明确统一的定论。 前期有研究相继报道了红景天,七叶皂苷钠等的保护作用。 同样,通心络也是中药复方,由12 种中药成分组成,在国内广泛应用于动脉粥样硬化、心绞痛、心肌梗死、缺血性中风等心脑血管疾病患者[13]。 多项研究表明,通心络具有明显的抗氧化、抗炎和抗血栓形成作用。 在脑缺血再灌注损伤模型等基础研究中证实了通心络可改善内皮功能,减少细胞凋亡,保护血脑屏障[8,14]。但是该药物是否能在急性低压低氧暴露的大鼠中发挥神经保护作用尚不清楚。 因而,本研究选择通心络作为干预方案。 研究显示,与低压低氧组相比,通心络干预后,大鼠的空间参考记忆有明显改善,同时海马AQP4 及MMP-9 表达下降,脑含水量同样明显低于低压低氧组。 以上结果提示,通心络能够有效缓解低压低氧导致的脑组织水肿和认知功能障碍。 另外,在整个实验过程中,所有大鼠未发生通心络的肝、肾毒性,也未发生不良反应导致大鼠死亡,证明1.6 g/(kg·d)通心络干预是安全可行的。
而对于高原脑水肿发生的分子机制尚未明确。近年来相继有研究从形态学、生理学、生物化学及分子生物学的角度讨论了急性高原脑水肿的发生机理[3-5]。 其中炎症反应与氧化应激是较为认可的机制[5-6]。 早期研究报道急性低压低氧暴露可促进NK 细胞的激活,血清细胞因子(包括 IL-6、IL-1β 和CRP)浓度升高[15]。 本研究同样发现,急性低压低氧暴露明显上调海马和血清中TNF-α、IL-1β 和IL-6的水平,提示低压低氧急性暴露可导致显著的外周及中枢炎症反应。 而在通心络干预后,外周血及海马组织 TNF-α、IL-1β 和 IL-6 的水平明显下降,证明通心络具有有效的抗炎作用。
目前已发现有多种信号通路参与机体炎症反应的调控。 其中 Toll 样受体(Toll like receptor,TLR)是一种天然免疫受体,广泛分布于巨噬细胞,淋巴细胞,单核细胞等[16]。 TLR4 是人类发现的第一个TLR 相关蛋白,其是介导内毒素/脂多糖应答反映的主要受体[17]。 TLR-4 作为LPS 的重要受体,通过MyD88 依赖的通路上调NF-κB 的表达,激活炎症介质[18-19]。 MyD88 作为TLR-4 信号转导的关键调控蛋白,可与 TLR-4 相互作用,激活 NF-κB。 同时反过来促进 IκB-α(NF-kappa-B 抑制剂 α)的磷酸化[20]。 IκB-α 与 REL 二聚体相互作用,抑制 NF-κB/REL 复合物参与炎症反应[20]。 磷酸化 NF-κB(p-NF-κB)可诱导 IL-6、TNF-α 和 IL-1β 等细胞因子的表达[21]。 在一项缺血再灌注损伤研究中发现,TLR4 突变小鼠进行脑缺血再灌注损伤(I/R)造模时,其神经行为、脑水肿程度和促炎细胞因子分泌水平均有所缓解[17]。 同样TLR-4 在应激下的大脑氧化和炎症损伤中发挥重要作用[18]。 因而本研究选择TLR4/MyD88/NF-κB 信号通路,探讨通心络可能的作用机制。 本研究发现,低压低氧暴露后,海马组织中 TLR-4、MyD88 和 p-NF-κB 的表达明显增加,而 IκB-α 表达水平明显下降。 通心络干预后,能够明显抑制低压低氧诱导的TLR4/MyD88/NF-κB通路活化。 对于正常组大鼠,通心络干预后对TLR4/MyD88/NF-κB 通路相关蛋白的表达无明显影响。 以上结果证实通心络能够有效抑制低压低氧环境下TLR4/MyD88/NF-κB 信号通路的激活及海马的炎症反应,进一步降低脑水肿和认知功能障碍的发生,发挥脑保护作用。
同时,本研究也存在一定的局限性。 首先,本研究讨论了通心络干预对大鼠低压低氧暴露7 d 时脑水肿及认知功能的影响。 而低压低氧环境中不同暴露时间(例如 第 3、7、14、21、28 天)下脑组织的变化情况尚未探讨。 其次研究初步探讨了通心络的脑保护作用。 在后续的研究中,将进一步探讨不同剂量通心络干预对脑功能的影响,提供更高质量的证据。 另外,本研究初步从神经炎症角度探讨了低压低氧导致认知障碍,脑水肿的可能机制,及通心络发挥脑保护作用的抗炎机制。 但炎症,血脑屏障,脑水肿这三部分之间如何相互作用还有待进一步探讨。
综上所述,低压低氧可激活TLR4-MyD88-NF-κB 信号通路,引起外周及海马炎症,最终导致脑水肿及认知障碍的发生;而通心络干预可以有效抑制TLR4-MyD88-NF-κB 通路的活化,减轻外周和中枢炎症反应,最终改善急性低压低氧暴露导致的脑组织水肿及认知障碍。
