小鼠肝癌原位移植性肿瘤动物模型的改良
2021-07-15罗晓琴丁冠茗郑旭金京燕刘阳张楠王靖宇王爱国
罗晓琴丁冠茗郑 旭金京燕刘 阳张 楠王靖宇王爱国
(大连医科大学实验动物中心,辽宁大连 116044)
在我国,原发性肝细胞癌是仅次于胃癌和肺癌的第三大恶性肿瘤,因其患病人数多、生存期短、病死率高,被称为“癌中之王”,是我国医疗卫生事业的重要攻关课题[1]。 建立体内肿瘤动物模型是研究肿瘤发生、发展、浸润、转移及肿瘤治疗的重要方法,在肿瘤的基础和临床前研究方面,以及加快抗肿瘤药物的研发和促进肿瘤的转化医学研究等方面都具有重要的意义[2-3]。
肝的解剖位置和生理功能的特殊性决定了其不仅是人体最大的消化和代谢器官,也是重要的免疫器官。 由于肝直接接收来源于消化道的大量复杂营养物质,因而肝不仅要对病毒、细菌等有害抗原及时启动免疫应答,同时还要免疫耐受绝大多数无害性抗原。 肝特殊的免疫耐受状态被认为是肝癌发生发展的重要病因[4]。 因而,肝的特殊生理学特点决定了肝原位移植性动物模型是研究肝癌病理机制和探索治疗方案的重要体内模型。 因此,建立肝原位移植性动物模型是肝癌的发病机制、侵袭、转移,以及治疗等研究的重要技术方法。
但在实际操作过程中,却常因肝肿瘤细胞易从肝组织中溢漏,发生腹壁瘤、腹腔积液等情况,致使因肝内接种的肝肿瘤细胞数量不一致和实验鼠体况差异增大,进而导致肝移植肿瘤大小不一、实验结果的误差波动范围大和不确实等现象,无论是在动物福利方面,还是在动物实验中人、财、物和时间的投入方面都是重要的损失[5]。 因此,摸索出一套稳定、高效、简便易行的技术方法,是建立肝原位移植性肿瘤动物模型的实际需要。 本研究旨在建立一套高效、稳定的建立肝原位移植性肿瘤动物模型的技术方法,以兹同行参考和交流。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF 级 C57BL/6J 雄鼠 24 只,12 周龄,体重(23±2)g,购买于大连医科大学重大疾病基因工程模式动物研究所[SCXK(辽)2018-0003]。 小鼠饲养于大连医科大学实验动物中心[SYXK(辽)2018-0007]。 实验和饲养条件严格按照SPF 级实验动物的规范要求。 饲喂的鼠粮为SPF 级小鼠AIN-93M标准饲料(脂肪占4%;碳水化合物占72.7%;蛋白质占12.5%),饮用水为灭菌的纯净水。 小鼠按照简单随机法分为两组,每组12 只,分别为棉压组和热封组。 本实验经过大连医科大学实验动物伦理委员会批准(AEE19065)。 实验过程中严格遵守3R原则,且严格按照伦理要求控制移植肿瘤的长径小于2 cm,体积小于2 cm3。
1.1.2 实验细胞
小鼠肝癌细胞株H22 由大连医科大学张宏颖教授赠予。
1.2 主要试剂与仪器
1640 培养基(Gibico);FBS(Gibico);1%青霉素和链霉素(碧云天公司);1.75%阿弗丁(2, 2, 2-Tribromoethanol,75-80-9,Sigma 公司);4%多聚甲醛(北京索莱宝科技有限公司);低生长因子Matrigel 基质胶(康宁公司)等。 二氧化碳培养箱(MCO-20AIC);超净工作台(ESCO,AC2-6S1);倒置显微镜(NOVEL,河南兄弟仪器设备有限公司);Vortex 振荡器(海门市其林贝尔仪器制造有限公司)。
(1)一次性无菌医用棉棒(江西松鹤医疗器械有限公司);1 mL 和10 mL 注射器(镇江康利医疗器械有限公司);10 μL 微量注射针(上海高鸽工贸有限公司);微创手术剪;微创镊子;止血钳;宠物剃毛器;体视显微镜;针型电烙铁(深圳市白光电子科技有限公司);缝合针;医用真丝编织线(缝合线,规格4-0,黑色,产品标准号 YZB/沪0645-65-2005,上海浦东金环医疗用品有限公司)。
(2)自制手术辅助工具:直径为0.5 cm 的垫背小木棒;撑开胸腔的带线小金属细弯钩;长度为1 cm 的固定小棒(图1)。

图1 自制手术辅助工具Figure 1 Self-made auxiliary tools for surgery
1.3 实验方法
1.3.1 H22 细胞的准备
将H22 细胞从液氮罐中取出,在37℃水浴锅中晃动将细胞解冻,把细胞悬液移入含有7~8 mL 的37℃完全培养液的15 mL 离心管中,1000 r/min 离心5 min,弃上清,加入新的培养液,吹打混匀,移入培养瓶在CO2培养箱(37℃,5% CO2)中培养,连续培养3 代后,当细胞处于旺盛、稳定的生长状态,可用于肝原位移植性实验。 调整细胞浓度:每毫升1×108个,和 Matrigel 基质胶按照 4 ∶1混合均匀,置于冰上等待后续注射实验,使用前Vortex 振荡混匀。
1.3.2 肝原位移植性肿瘤动物模型的制备
(1)小鼠在手术前提前禁水粮4 h,小鼠称重,按0.25 mL/10 g 体重腹腔注射麻醉药阿弗丁,麻醉后使用宠物剃毛刀剃去腹部手术部位的毛,将小鼠固定于泡沫板制成的手术台上(图2)。
(2)剃毛并依次使用碘伏和75%乙醇对腹部备皮部位进行消毒,用眼科剪沿腹部正中线从剑突向下做一约1.5~2.0 cm 的纵向切口,暴露剑突(图2)。
(3)用带线小金属细弯钩将切口两侧皮层与肌层一同分别拉向切口两侧,固定拉钩。 将一个直径为2 cm 的小棒垫于小鼠背部肝上缘以便充分暴露肝,观察小鼠肝的解剖结构是否正常,手指轻压两侧肋弓以挤出部分肝左叶(图2)。

图2 手术小鼠固定方法Figure 2 Fixation method of surgical mice
(4)调整立体显微镜的焦距,使肝左叶清晰地暴露在显微视眼下,使用Vortex 将细胞振荡混匀后,使用规格为10 μL 的微量注射针缓慢吸取5 μL细胞液。 微量注射针的针头与肝表面呈20 度角进针,进针后使针头与桌面平行,平行推进约1 cm(针尖的最终位置不宜太过靠近肝叶边缘薄处),缓慢注入5 μL H22 细胞悬液,可观察到注射区域大部肝叶颜色迅速变浅(白斑)或出现浑浊的半透明空泡。
(5)注射后针体停留1 min,再缓慢退出白斑或空泡区域,退出该区域后等待2~4 min,退出全针。为防止肿瘤细胞从针孔溢漏,我们依据采用的应对方法的不同,分为棉压组和热封组。 棉压组小鼠在退针后迅速使用无菌棉签压迫进针口,直至无出血情况后移走棉签。 热封组小鼠在退针后使用无菌棉签迅速压迫进针口的同时,使用针型电烙铁轻轻灼烧封闭针孔。
(6)用蘸取75%乙醇的棉棒轻轻擦拭肝叶表面后,将肝左叶轻缓地移回腹腔。
(7)根据称量的小鼠体重值,向腹腔注射浓度为 8 μg/μL 的庆大霉素(5 mL/kg),使用 4-0 非吸收性缝合线依次缝合腹膜和皮肤。
(8)缝合完毕后,使用75%乙醇擦拭缝合的切口及周围的皮肤,将小鼠放置于35℃加热垫上待其复苏。 完全复苏后,移入饲养盒内进行常规饲养。
1.3.3 术后观察及检测
(1)日常观察:小鼠术后的生活状态,进食、饮水、活跃健康状况,异常死亡情况等。
(2)样本取材:第19 天处死小鼠,解剖取出肝称重拍照,分离肿瘤组织称重并拍照,同时使用游标卡尺测量每只小鼠肿瘤的长径(a)和短径(b),按公式:V=ab2/2 计算肿瘤体积。
(3)病理学检测:肿瘤组织标本用4%多聚甲醛固定后做病理学检测,常规取材、脱水、石蜡包埋、制片(4 μm),HE 染色,光学显微镜下观察。
1.4 统计学方法
肝重数据采用t检验进行统计学分析。 两组比例差异应用卡方检验进行统计学分析。P<0.05 为差异有统计学意义。
2 结果
2.1 模型鼠的存活状态
在术中均未见死亡,并于术后2~3 h 后苏醒。模型鼠术后存活状况良好,1 d 后活动正常,5 d 后手术刀口恢复。 在5~18 d 的饲养过程中,棉压组和热封组小鼠的存活率均为91.7%,各有1 只小鼠在后期的饲养过程中死亡,剖检时发现死亡小鼠的结肠内有大量内容物聚集,结肠肿胀,可能是由于麻醉时针刺损伤、麻醉药作用、术中机械牵拉刺激或肿瘤压迫等因素导致排便功能异常或麻痹性肠梗阻所致,食物残渣不能正常排出,导致代谢功能紊乱而最终死亡。
2.2 模型鼠肝肿瘤成瘤情况
接种后第19 天对模型鼠进行剖检,观察肝移植瘤的成瘤情况。 肝内肉眼可见明显的移植瘤,瘤形状相对规则,呈白色的椭圆或者长条形(图3、图4)。 结果表明,移植瘤小鼠的成瘤率为100%。
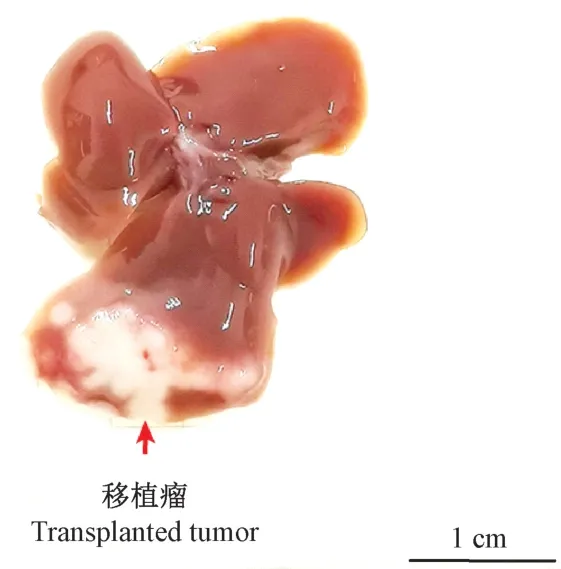
图3 移植瘤实体表观Figure 3 A representative physical photograph of transplanted liver tumor
肿瘤测量结果显示,棉压组小鼠的肿瘤最大长径为1.83 cm,平均体积为(0.27 ± 0.16)cm3,平均重量为(0.19 ± 0.07)g;热封组小鼠的肿瘤最大长径为1.75 cm,平均体积为(0.34 ± 0.09)cm3,平均重量为(0.18 ± 0.02)g。 两组小鼠的肿瘤大小和肿瘤重量虽无统计学差异,但与棉压组相比较,热封组的肝移植瘤的大小均一,肿瘤重量的波动性小(图4)。 另外,在剖检时发现,棉压组出现了高比率的腹水(36.4%)和腹壁瘤(36.4%)(图5),而热封组没有出现上述现象,两组统计学差异显著(表1)。说明棉压组的肿瘤细胞从注射孔溢漏的情况显著增高,这也是棉压组肝移植瘤大小波动性较大的根本原因。 另外,在棉压组还发现1 只发生腹水的小鼠出现肝内多个肿瘤结节(图6),这可能是腹水瘤细胞通过脉管系统形成的肝转移现象。
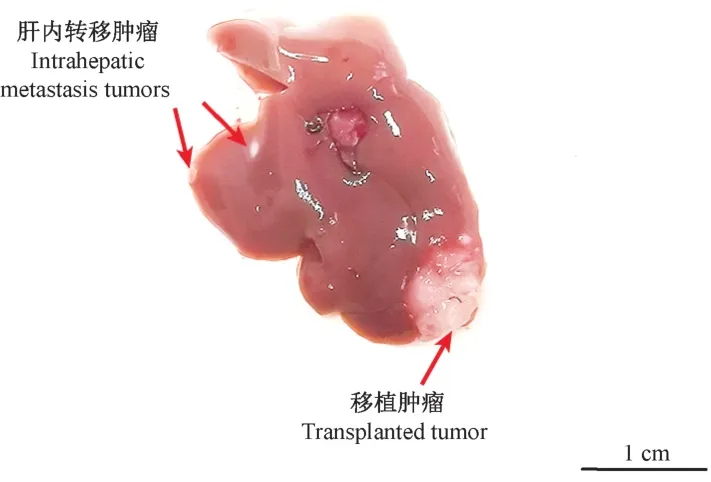
图6 肿瘤细胞的肝内转移Figure 6 Intrahepatic metastasis of tumor cells
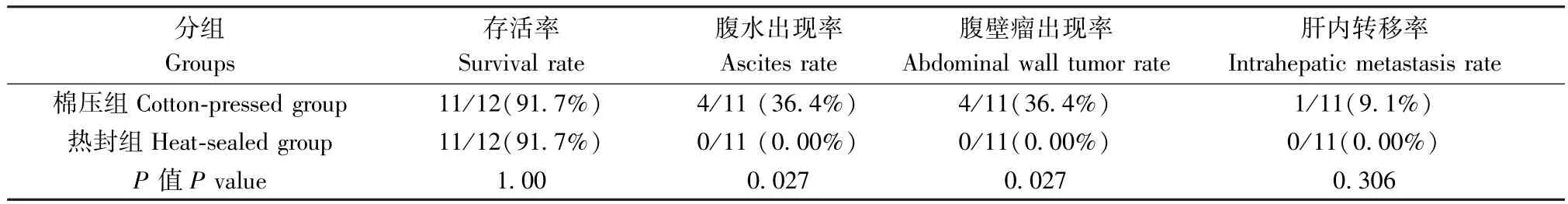
表1 棉压组和热封组小鼠生存和肿瘤情况的比较Table 1 Comparison of survival and tumor status of mice between cotton-pressed group andheat-sealed group
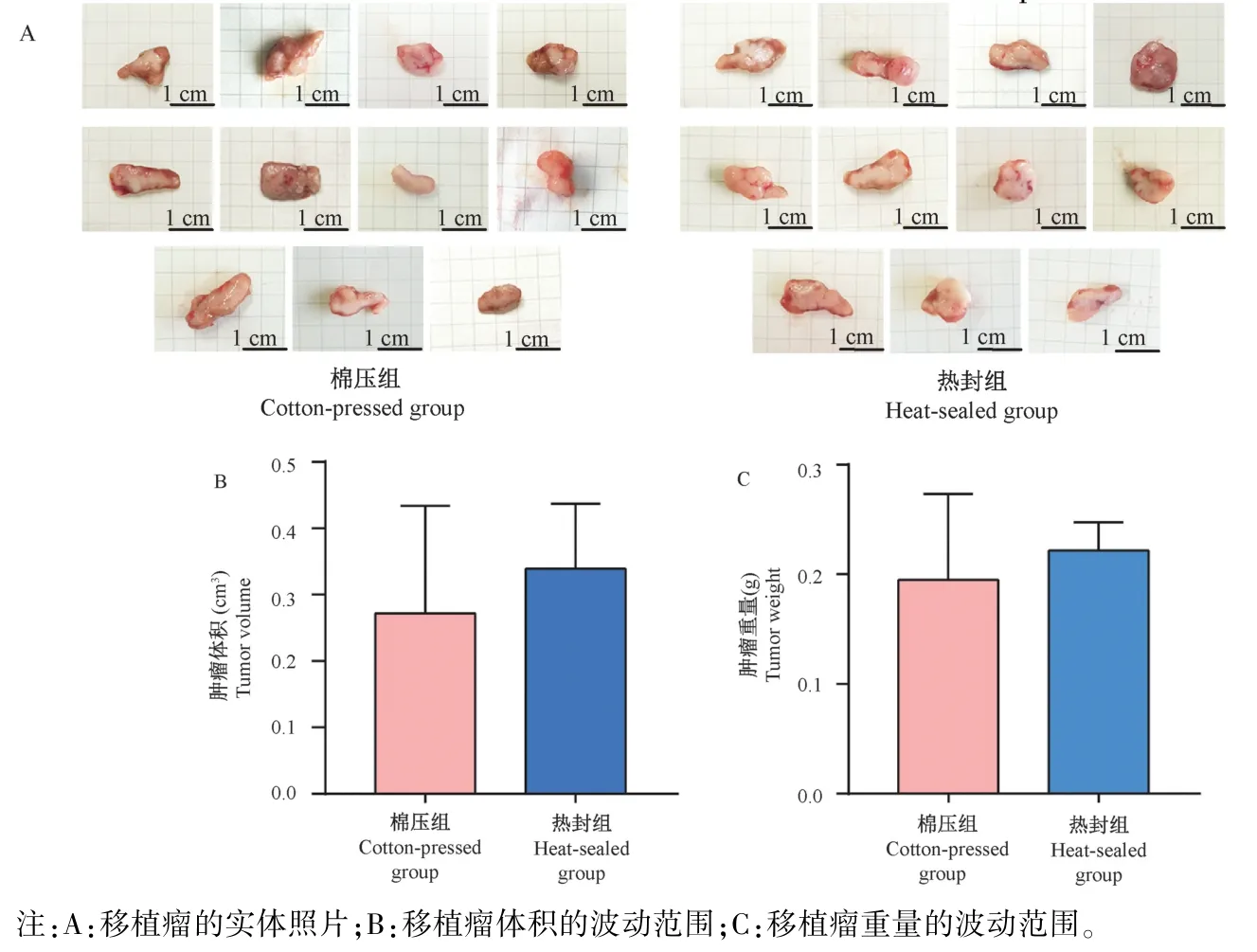
图4 移植瘤大小及重量的波动范围Note. A, Physical photographs of transplanted tumors. B, Fluctuation range of transplanted tumor volume. C,Fluctuation range of transplanted tumor weight.Figure 4 Fluctuation ranges of size and weight of the transplanted tumors
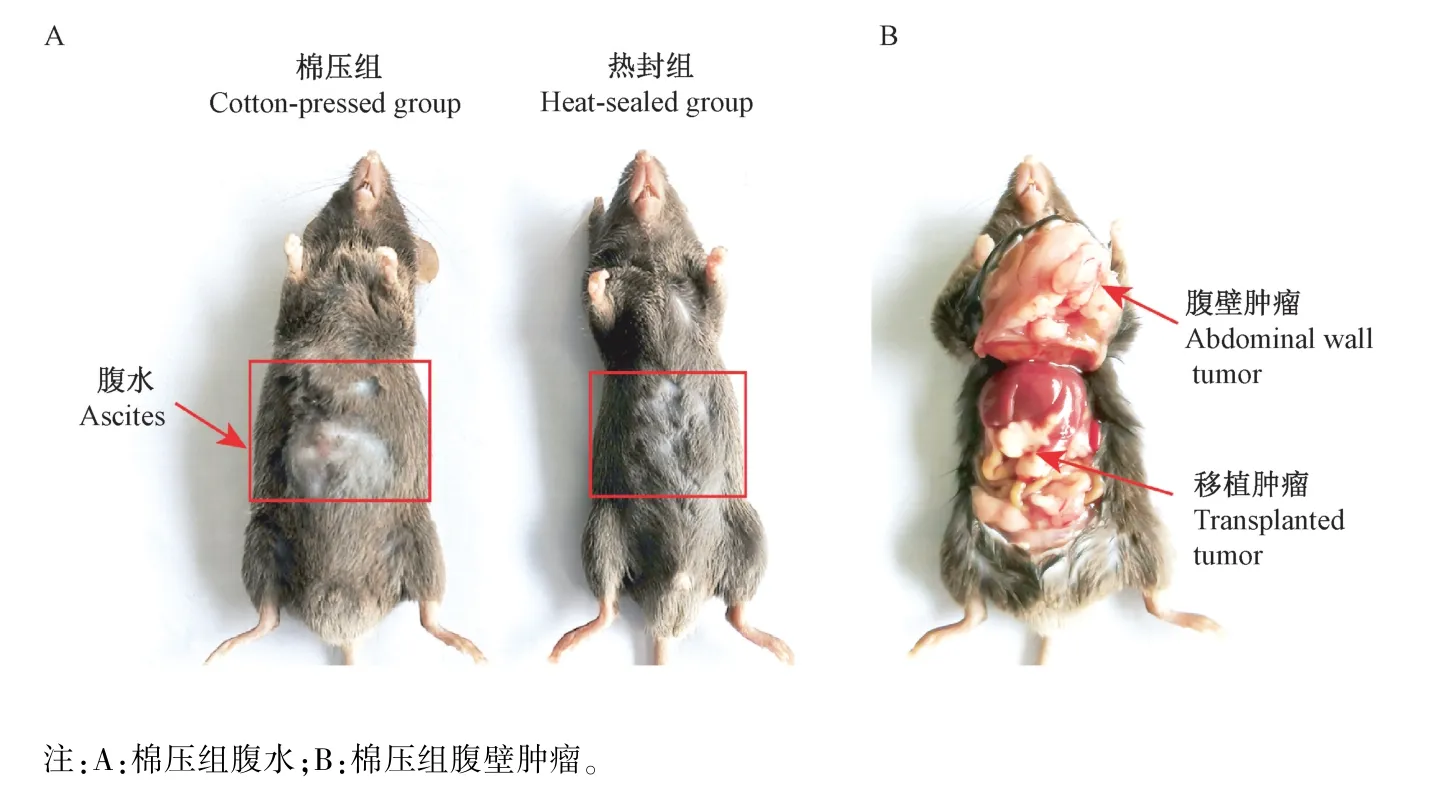
图5 棉压组出现的腹水和腹壁瘤Note. A, Ascites in the cotton-pressed group. B, Abdominal wall tumor in the cotton-pressed group.Figure 5 Ascites and abdominal tumor appeared in the cotton-pressed group
2.3 病理学检测
病理学检测结果表明(图7),虽然棉压组与热封组在肿瘤大小的波动性上有明显的不同,但在病理学表型上没有显著差异。 HE 染色光镜下观察,癌细胞排列紧密,表面不规则,异型性明显,分化程度差,核深染,呈现分叶及多核现象,游离核糖体增多,肿瘤边缘浸润肝组织。
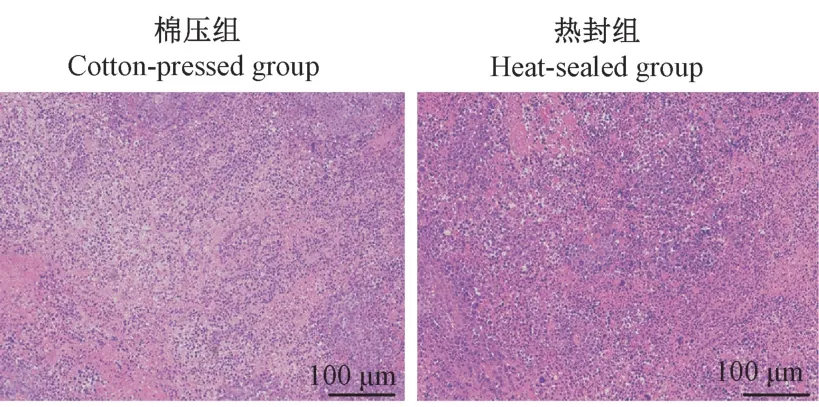
图7 肝原位移植性肿瘤的病理学检测Figure 7 Pathological examination of orthotopic liver transplanted tumors
3 讨论
动物模型应该尽可能地接近人类肿瘤的自然生物学过程。 肿瘤模型主要包括自发性、移植性、化学性诱发性和转基因肿瘤模型,这些肿瘤动物模型已经被广泛地应用于肿瘤发生和发展分子机制的研究中[6-8]。 因自发性和转基因肿瘤模型具有遗传性特征,局限于特定的遗传特质或人为遗传修饰的动物模型,应用范围有限。 由于移植性和化学性诱发性肿瘤动物模型的建立具有易于获取实验动物和相对技术难度小等特点,是目前实验室普遍应用的肿瘤动物模型。 虽然诱发性肿瘤动物模型与自然肿瘤发生过程相近,但具有实验周期长、个体差异大、致死性高、实验动物用量大等缺点[9]。 而移植性肿瘤动物模型因其具有实验周期短、个体差异小、致死性低、实验动物用量少等优点,已成为实验室最常用的肿瘤动物模型[10]。
移植性肿瘤动物模型主要分为皮下移植性和原位移植性两种[11]。 与原位肿瘤移植模型相比,虽然皮下肿瘤移植模型操作简单、技术难度小、成功率高、易于观测和局部干预,但存在因血液供应不足而发生后期的皮肤破溃和中心组织坏死;因被膜相对完整而局限于皮下,缺乏周围组织浸润及远处淋巴结转移,不能很好地模拟肿瘤浸润和转移的病理生理学过程等缺点[12-13]。 特别是忽略了肿瘤与周围正常组织的相互作用关系,在组织细胞的生物学环境、免疫环境、肿瘤形成、病理生理学变化等方面仍存在较大的差异,不能很好地模拟肿瘤的自然生物学过程,有一定的局限性[14-16]。 原位移植性肿瘤模型可有效克服皮下移植瘤的缺点,是目前肿瘤研究中较为理想的基础体内动物模型。
由于野生型小鼠具有完全的免疫能力,因而应用H22 等鼠源性肝癌细胞制备野生型小鼠的肝原位移植性肝癌动物模型是实验室常用的研究方案[17-18]。 但H22 肝癌细胞属于种植腹水型肝癌细胞,具有扩增速度快,容易扩散的特点。 在制作肝原位移植性肿瘤动物模型过程中,除了因为无法很好地解决肝肿瘤细胞浓度、注射体积、压迫肝止血和防止肿瘤细胞溢漏等问题,从而导致肝原位移植瘤大小不均一的现象,还常出现腹水和腹壁瘤等附加异位接种等情况,极大地影响了最终实验结果的统计和判定[19]。 有些学者为了避免上述现象,采用先建立皮下移植肿瘤,然后取出皮下移植的肿瘤组织将其切成小块(2 mm × 2 mm × 1 mm 左右),再采取肝内隧道植入法移植到肝内。 但这个方法操作难度大,容易造成动物肝大量出血并引起动物死亡,同时手术时间较长,具有较大的操作难度,在人员有限的情况下不适用于制备大批量的肝原位移植性肿瘤动物模型,影响荷瘤成功率[20]。
为解决上述难点,本研究通过对实验方法和细节的不断摸索和多次改进,建立了一种简易、有效、稳定、可行性高的原位移植性肝癌的方法,总结经验要点如下:
(1)保持高细胞活性。 体外培养H22 悬浮细胞可保证细胞的高纯度和高活性。
(2)手术视野要宽阔。 腹部切口适度(1.5~2 cm),同时用自制器材拉开腹皮,以便充分暴露肝,便于操作。
(3)选择微量注射器。 使用细的微量注射针将细胞缓缓注入小鼠肝,可减轻针头对肝的损伤,减少针口面积,提高实验成功率。
(4)严格控制注射体积。 为避免注入肝的细胞混悬液因压力过大而发生溢漏,形成腹壁瘤或腹腔积液的现象,可使用10 μL 微量注射针向肝注射5 μL 细胞悬液,尽可能减少注射体积。
(5) 应用 Matrigel 基质胶。 将细胞悬液和Matrigel 基质胶混匀,可避免在原位接种细胞悬液的弥散,有效地形成实体瘤。
(6)注意进针的角度和深度。 C57BL/6J 小鼠肝较薄,进针角度过大极易穿透肝,从而引起腹腔种植,导致接种的失败。 在实验过程中需将针尖与肝表面呈20 度进针,针尖行程约为1.0 cm,可有效保证所注射的细胞位于肝左外侧叶实质内。
(7)选择合适大小的小鼠。 在小鼠的选取上,尽量使用自然生长环境下的雄性 C57BL/6J 小鼠,出生在 12~15 周,体重在(23 ± 2)g 为宜,避免肝叶太小影响细胞注射过程增大手术难度,也可避免性激素可能对肝移植瘤生长的影响。
(8)清除残余肿瘤细胞。 使用针型电烙铁灼烧针孔后,要用酒精棉球轻擦针孔周围及肝表面,防止少量遗漏的肿瘤细胞异位种植于腹壁或腹腔内。
(9)术前禁水禁粮。 在进行手术前4 h 对小鼠禁水禁粮,避免麻醉时的不良反应。
(10)谨慎柔和操作。 在手术操作的过程中要轻柔、谨慎,避免损伤其他脏器。
(11)缝合打结后线头要留0.3 cm 左右。 小鼠腹皮缝合时,缝合打结后,线头要留的长一些,避免小鼠苏醒后在活动或啃咬中解开,导致胃肠和肝暴露而死亡。
本研究探索出制备均一、稳定肝原位移植性肿瘤动物模型的技术方法并总结其实施要点,具有时间短,易操作,模型稳定性高等特点,以兹与肝癌研究的同仁进行交流和相互借鉴。
