饲料铜水平对赤眼鳟幼鱼生长性能、体组成和成活率的影响
2021-07-15王岳松高银爱杨慧君袁勇超成为为魏辉杰王青云
杨 凯,王岳松,高银爱,杨慧君,袁勇超,成为为,魏辉杰,王青云
(1.武汉市农业科学院,武汉 430070;2.华中农业大学水产学院农业动物遗传育种与繁殖教育部重点实验室/农业农村部淡水动物养殖重点实验室,武汉 430070)
铜是脊椎动物包括鱼类的必需微量元素,具有多种生理功能,主要作为某些酶的辅助因子,如细胞色素氧化酶、超氧化物歧化酶、赖氨酸氧化酶、多巴胺羟化酶和酪氨酸酶[1]。鱼类饲料必须包括能量来源、必需氨基酸、必需脂肪酸、特定维生素和矿物质,以维持生命和促进生长[2]。部分鱼类对铜的需求量已经被定量化,如鲤鱼和虹鳟鱼[3]、斑点叉尾鮰[4]、奥尼罗非鱼[5]、石斑鱼[6]、黄颡鱼[7]和蓝点石斑[8]。现已有研究表明,饲料中缺乏铜会降低鱼的食欲、生长速度、肝脏Cu-Zn SOD和心脏细胞色素氧化酶的活性[4-6,8,9]。且以往的研究也表明,鱼类饲料中过量的铜会导致中毒综合征[5],包括生长减缓[10]、肠道严重损伤[11]以及提高肠道细胞增殖率和凋亡率[12,13]。在饲料中添加铜既要满足铜的需要,又要避免铜中毒[14]。因其肉质鲜美,且可接受配合饲料并快速生长的特性,赤眼鳟成为中国淡水养殖的一个很好的候选品种[15]。近年来,赤眼鳟最佳的饲料蛋白质和脂肪水平已被确定[16]。然而到目前为止,还没有关于其饲料铜需要量的定论。因此,本研究旨在探究赤眼鳟幼鱼对饲料中铜的适宜需求量,并评估饲料铜水平对其生长性能和体组成的影响,以期补充完善赤眼鳟营养数据库,为开发赤眼鳟不同生长阶段专用饲料提供基础数据和理论依据。
1 材料与方法
1.1 饲料制备
基础饲粮(对照组饲粮)组成及营养水平[17]见表1。酪蛋白(国药集团化学试剂有限公司)、鱼油、豆油和糊精(武汉高龙饲料有限公司)分别作为饲粮的蛋白质源、脂肪源和糖源。在基础饲粮中不添加铜作为对照(干物质基础含铜0.29 mg/kg)[16]。另外8种试验处理饲料以CuSO4·5H2O(国药集团化学试剂有限公司)作为铜源的半纯化饲粮中实际铜含量分别为0.29、1.31、2.28、3.43、4.57、6.61、8.77、10.73和12.89 mg/kg。制作饲料时,先将称取各干料搅拌混合后加入蒸馏水混合,倒入制粒机(F-26(II),华南理工大学)磨制成颗粒状,在45℃的通风烘箱中烘干12 h。干燥后将其筛分出直径1.0 mm的颗粒饲料,密封后在-20℃储存。先用高氯酸消化后,再用电感耦合等离子体原子发射光谱仪(ICP-AES,VIS⁃TA-MPX,VARIAN)对饲粮中的铜水平进行分析。在所有饲粮中添加30 g/kg的诱食剂,其与鱿鱼外套膜组织具有类似化学组成可以增加饲粮适口性[18]。
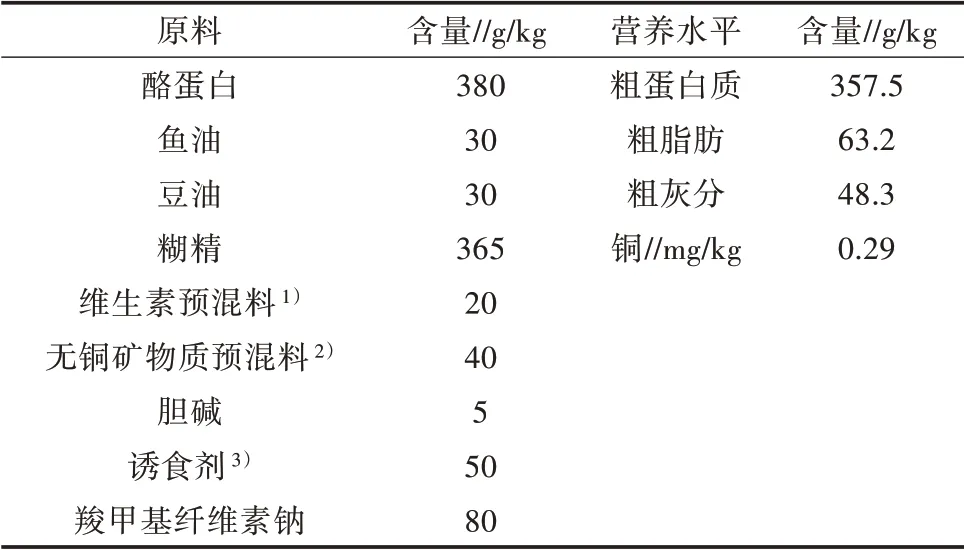
表1 基础饲粮组成及营养水平(风干基础)
1.2 饲养管理
试验鱼购自武汉市农业科学院水产研究所试验基地。在饲养试验开始前,先将赤眼鳟幼鱼放置于1 600 L室内循环养殖水箱中驯化2周。驯化期内,每天8:00和16:00分别投喂对照饲粮两次。饲养试验共分9组,每组设置3个重复,每个重复30尾鱼。选取810尾健康状况良好、体型均匀的鱼(初始体重为6.22±0.11 g)放置在27个砂滤曝气后的淡水水箱(300 L)中,每箱放30尾鱼。每天分别在8:00和16:00给鱼投喂试验饲料至饱食,记录每日进料情况,为避免粪便污染,于投料后40 min收集未吃饲料并记录重量,每天检查死亡情况。饲养试验期间维持12 h光照、12 h黑暗,水温25.6~27.4℃,溶氧量6.7 mg/L,pH 7.4~8.1,总氨氮0.033~0.057 mg/L,定期检测饲养水中铜含量(1.36±0.41μg/L),养殖周期为8周。
1.3 样品采集
饲养试验结束后,对每个水箱中鱼体称重并进行组织取样分析。每个水箱中选8尾鱼用三卡因甲烷磺酸盐(MS-222)麻醉,解剖5尾鱼肝脏,并集中分析。肝脏保存在-80℃,用于测定硫代巴比妥酸反应物(TBARS)、铜锌超氧化物歧化酶(Cu-Zn SOD)活性。
1.4 指标测定及分析
采用标准程序[16]对饲粮中的蛋白质、脂质和灰分进行测定。将肝组织匀浆到9倍体积的冷缓冲液(0.01 mol/L Tris-HCl,0.000 1 mol/L EDTA-2Na,0.01 mol/L蔗糖,0.8%生理盐水,pH 7.4)中,4℃下3 000 r/min离心15 min,保存上清液以测定Cu-Zn SOD的活性和MDA的含量。采用BCATM蛋白测定试剂盒(南京建成生物工程研究所)测定蛋白含量,采用硫代巴比妥酸反应物测试盒(南京建成生物工程研究所)测定丙二醛(MDA)含量。采用ELISA标准方法测定金属硫蛋白含量[18]。采用南京建成生物工程研究所生产的Cu-Zn SOD活性测定试剂盒(A001-2)按照说明书测定Cu-Zn SOD活性。用分光光度法测定血清蛋白质浓度[19]。所有分析测定进行3次重复。
1.5 生长指标计算
存活率(SR,%)=100(Nf/Ni),其中,Nf为试验末期鱼成活数,Ni为试验初期鱼成活数;增重率(WG,%)=100[(Wf-Wi)/Wi],其中,Wf为末期鱼体重,Wi为试验初期鱼体重;特定生长率(SGR,%/d)=100(lnWf-lnWi)/T,其中,Wf试验末期鱼体重,Wi为试验初期鱼体重,T为试验周期;饲料系数(FCR)=WF/(Wf-Wi),其中,WF为摄食量;蛋白质效率(PER,%)=(Wf-Wi)/WF×Wp,其中,Wp为饲料中蛋白质含量;全体铜蓄积量(μg)=(Cf-Ci,μg)-(CF,μg)[5],其中,Cf为试验末期鱼全体铜含量,Ci为试验初期鱼全体铜含量,CF为铜摄入量;肥满度(CF,%)=100Wf/L3,其中,L为鱼体长;肝体比(HSI,%)=100(WH/W),其中,WH为肝脏重;脏体比(VSI,%)=100(WV/W),其中,WV为内脏重。
1.6 数据统计
试验数据采用SPSS17.0软件进行统计分析,结果以3次重复的平均值±标准误表示。通过单因素方差分析(one-way ANOVA)检验各数据之间的方差和显著差异,若差异性显著采用邓肯氏多重比较检验P<0.05显著性水平的均值。对试验鱼全体铜蓄积量进行二次曲线回归分析,对WG和FCR进行线性回归分析以评估赤眼鳟幼鱼对饲粮中铜的需要量。
2 结果与分析
喂食对照饲粮(0.29 mg/kg饲料铜组)的试验鱼出现典型的饲粮铜缺乏症状,如生长不良和骨骼畸形。各试验饲粮饲养下鱼的生长性能、形态指标和存活情况如表2所示。饲喂对照饲粮的试验鱼的SGR明显低于饲喂其他饲粮的鱼。4.57 mg/kg饲料铜组的鱼SGR最高(1.68%/d),但在低铜水平和高铜水平时均有下降(P<0.05)。PER与SGR的变化趋势相似。相反,饲粮铜水平为0.29 mg/kg时,FCR最低。通过线性回归模型分析,可以很好地表现饲粮中铜水平与WG之间的关系,赤眼鳟生长性能最佳饲粮铜水平为4.79 mg/kg(图1)。对试验鱼的FCR进行折线回归分析表明,饲粮中铜的适宜需要量为4.92 mg/kg(图2)。饲喂对照饲粮的试验鱼SR低于饲喂铜水平≤10.73 mg/kg饲粮的鱼。饲粮铜水平对VSI和HSI有显著影响(P<0.05,表2),对CF却没有显著影响(P>0.05)。
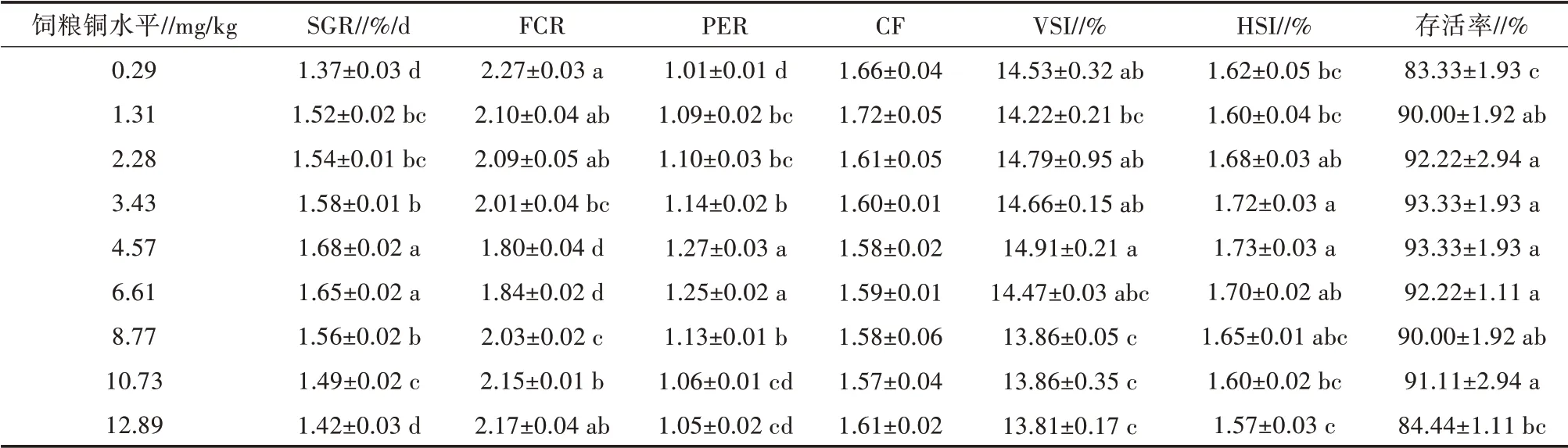
表2 饲粮铜水平对赤眼鳟幼鱼生长性能、形态指标和存活情况的影响
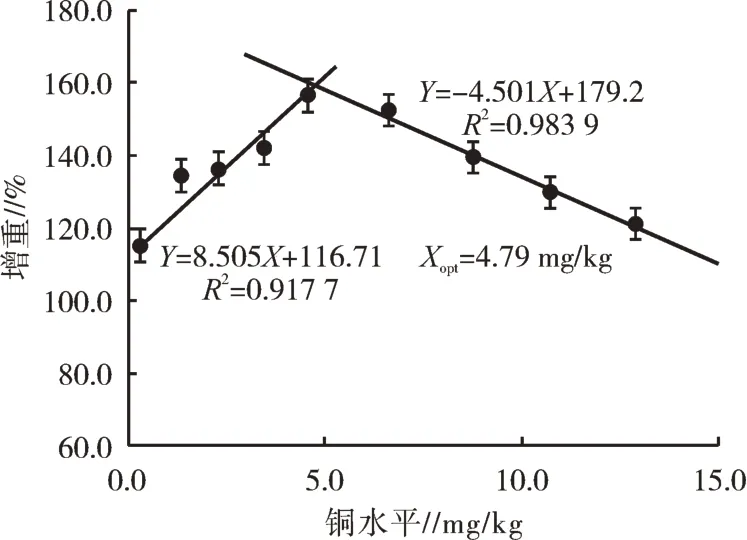
图1 饲粮铜水平对赤眼鳟幼鱼增重的影响
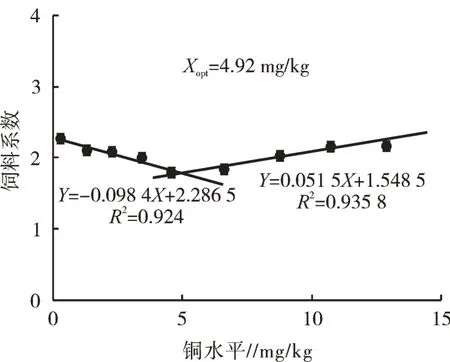
图2 饲粮铜水平对赤眼鳟幼鱼饲料系数的影响
由表3可以看出,饲粮铜水平也显著影响赤眼鳟的体组成(P<0.05)。其体脂肪含量随饲粮铜水平的升高而降低(P<0.05)。随着饲粮铜水平的增加,全体铜蓄积量显著增加(P<0.05)(表4)。对全体铜蓄积量和饲粮铜水平进行线性回归分析,发现饲粮中铜的适宜需求量为3.94 mg/kg(图3)。
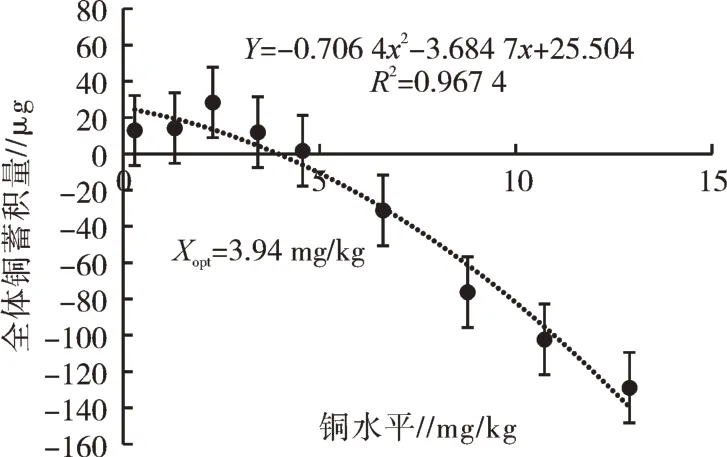
图3 饲粮铜水平对赤眼鳟幼鱼全体铜蓄积量的影响
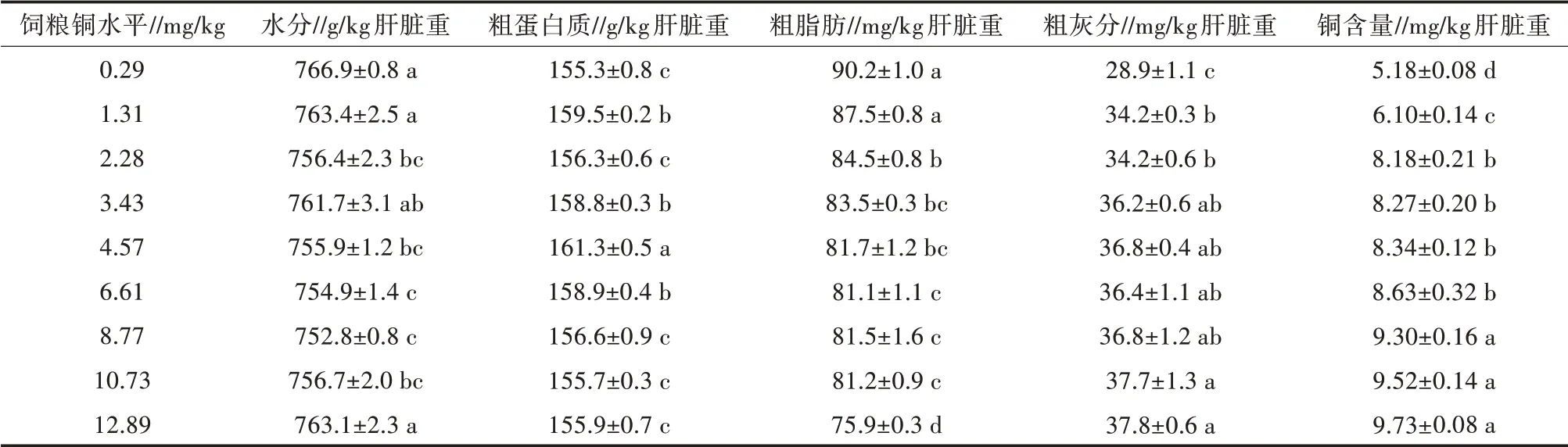
表3 饲粮铜水平对赤眼鳟幼鱼体组成和铜含量的影响
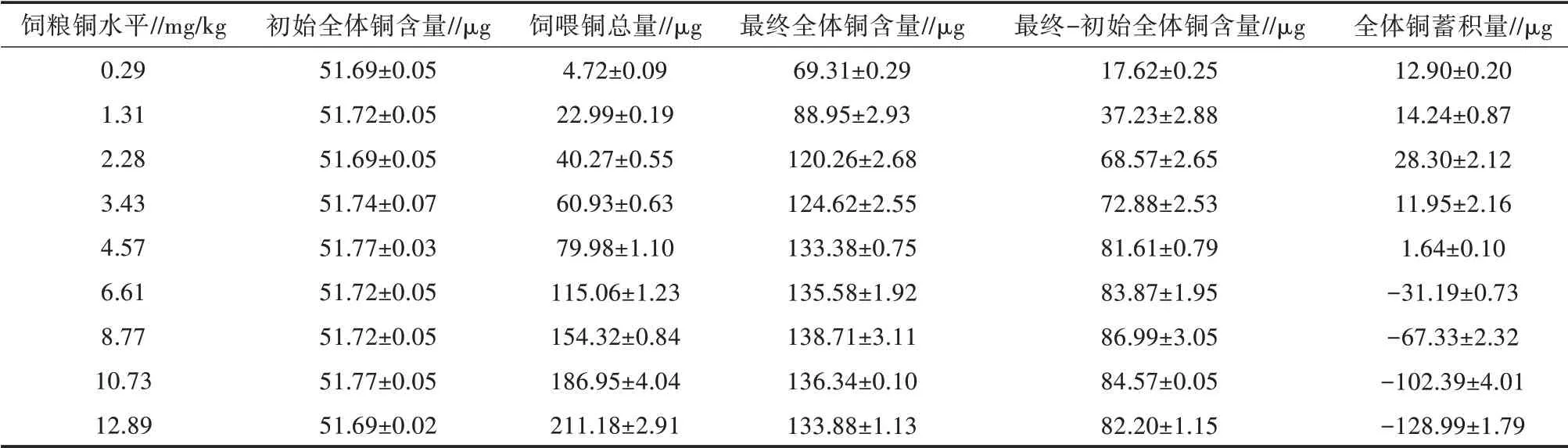
表4 饲粮铜水平对赤眼鳟幼鱼全体铜蓄积量的影响
肝脏铜浓度随饲粮铜水平的增加而显著(P<0.05)增加(表5)。饲粮铜水平对赤眼鳟肝脏中TBARS浓度有显著影响(P<0.05)。各组中,饲喂对照日粮的鱼的TBARS值最高(表5)。饲粮铜水平对肝脏Cu-Zn SOD活性有显著影响(P<0.05),低铜含量饲粮和高铜含量饲粮对肝脏Cu-Zn SOD活性的影响显著(P<0.05)低于3.43 mg/kg饲粮和4.57 mg/kg饲粮。
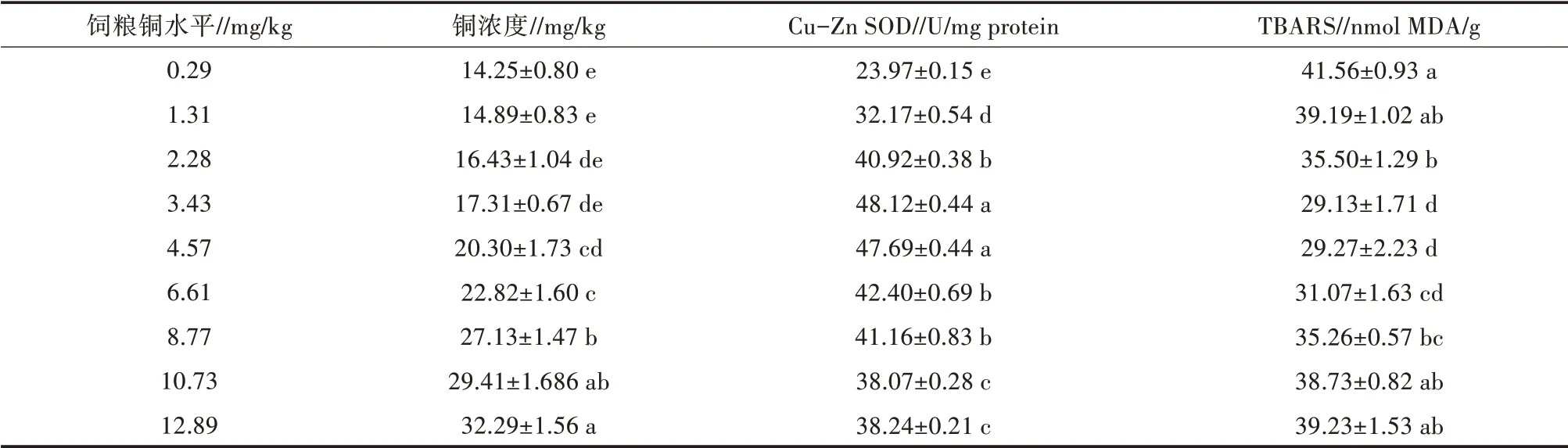
表5 饲粮铜水平对赤眼鳟幼鱼肝脏Cu-Zn SOD活性、TBARS值和铜浓度的影响
3 讨论
本研究结果表明饲粮中铜水平对赤眼鳟幼鱼的生长性能有显著影响,以4.57 mg/kg饲料铜组饲粮饲养的试验鱼SGR最高。在石斑鱼和黄颡鱼中也发现了类似的结果[7,20]。饲养鱼类时饲粮铜缺乏或过量都会生长缓慢,这与其他水生动物一致[21,22]。对照组鱼体FCR和PER值最低,但与12.89 mg/kg饲料铜组鱼体FCR和PER值无显著性差异。同样,较低或较高的饲粮铜水平会影响黄颡鱼和斑点叉尾鮰的生长和饲料利用[7,23]。有研究表明,饲粮铜缺乏会抑制罗非鱼和石斑鱼的食欲和生长[5,6],而鱼体内铜含量过高会导致中毒综合征[11,13],包括生长减缓[10]、肠道细胞增殖和代谢的微妙变化[12,13]以及肠道的严重损伤[11]。因此,在鱼饲料中补充铜是满足铜需求和避免铜毒性之间的平衡[14]。
对WG进行折线回归分析,赤眼鳟幼鱼对饲粮中铜的最佳需求量为4.79 mg/kg。以生长和生化指标作为评价指标,赤眼鳟饲粮铜需求量与有鳍鱼相似(3~6 mg/kg)[4-6,23,24]。鱼类对铜的最适需要量与鱼种、摄食方式和生长阶段有关[10]。通过对试验鱼FCR进行折线回归分析,赤眼鳟幼鱼对饲粮中铜的最佳需求量为4.92 mg/kg。
在本研究中不论是摄入不足或过量铜的赤眼鳟幼鱼,其VSI和HSI均显著降低。Wu等[22]报道,当饲粮铜水平≥12.22 mg/kg时甲鱼肝脏出现缩小,HSI显著降低,清楚地证明了该浓度下的铜水平会对甲鱼产生不利影响。但关于鱼和虾的报道显示其肝脏铜含量和HSI呈正相关[21,25]。在本研究中VSI和HSI的降低可能是由于这些组摄食减少或机体为解毒和维持体内平衡而增强代谢所致。
随着饲粮铜水平的增加,试验鱼全体铜蓄积量显著下降,这种现象在其他研究中也有报道[5-6,25]。肝脏是鱼类主要的铜储存器官[24,26]。在本研究中饲粮中铜含量显著影响了赤眼鳟的体组成。脂肪、蛋白质和铜的组织沉积依赖于饲料摄入量、代谢利用和肠道吸收,而这些因素都可能受到饲粮中铜水平升高的影响[27]。Handy等[28]提出与食用11 mg/kg铜水平的干性饲料的鱼相比,食用500 mg/kg铜水平的干性饲料1个月后,虹鳟鱼的脂肪储存显著下降。本研究中赤眼鳟全体和肝脏铜蓄积量随饲粮中铜水平的增加而增加,表明赤眼鳟可能在组织中积累过量的铜。一般来说,当鱼被喂食高浓度铜7 d或更长时间后,高浓度铜会在肠组织、肝脏和胆囊积聚,而在鳃、肌肉和肾脏积聚的铜浓度较低[29-31]。
SOD作为一种抗氧化酶,在保护细胞免受自由基损伤方面发挥着重要作用[32,33]。SOD是一种铜依赖酶,已经被证明是一个很好的研究大鼠和猫铜营养需求的评价指标[34,35]。Gatlin等[4]也报道了喂养0~2.0 mg/kg铜水平饲料的斑点叉尾鮰肝脏中Cu-Zn SOD活性明显低于喂养4 mg/kg铜水平饲料的斑点叉尾鮰。本研究结果表明饲粮中低剂量铜(≤2.28 mg/kg)和高剂量铜(≥6.61 mg/kg)都会降低赤眼鳟肝脏Cu-Zn SOD活性。TBARS是通过检测脂质氧化来评价氧化应激的常用指标之一[36]。肝脏TBARS值与肝脏Cu-Zn SOD活性呈负相关。饲粮中低剂量铜和高剂量铜都会升高试验鱼肝脏TBARS值,可能是由于Cu-Zn SOD活性较低所致。
通过对试验鱼WG、FCR线性回归分析和鱼体铜蓄积量的二次曲线回归分析,赤眼鳟幼鱼的最适饲粮铜需求量为3.94~4.92 mg/kg。饲粮中铜的缺乏或过量都会显著降低赤眼鳟幼鱼的生长速度和摄食量。饲粮中的铜会使赤眼鳟幼鱼肝脏蓄积铜,并表现出毒性作用。
