IBA对月季切花‘黑魔术’保鲜效应的影响
2021-07-14李博文李玲敏夏萌潘思媛陈佳灜娄玉霞明凤
李博文 李玲敏 夏萌 潘思媛 陈佳灜 娄玉霞 明凤


摘 要: 為探究外源吲哚丁酸(IBA)对月季鲜切花的保鲜效应,采用蔗糖+水杨酸(SA)为基础保鲜液,分别添加不同浓度梯度的IBA,对月季‘黑魔术鲜切花进行瓶插保鲜处理,观察分析鲜切花的各项生理指标.结果表明:保鲜处理12 d后,不同浓度IBA对鲜切花的生长和品质产生了不同的影响.IBA质量浓度为250 mg?L-1的保鲜液处理组,鲜切花完全萎蔫,丧失观赏价值.IBA质量浓度为500 mg?L-1的保鲜液处理组中,鲜切花能维持较好的花瓣形态,花朵于第6 d进入盛花期,绽放冠幅达8 cm,且最终花瓣萎蔫率仅为24.3%.同时,该处理组较其他组生理状态更佳,水分平衡值和鲜重维持在较好的水平,超氧化物歧化酶(SOD)和过氧化物酶(POD)的活性提高,花瓣中蔗糖含量显著高于其他处理组.进一步分析影响花瓣脱落相关基因的表达,其中RcSUC2,RcARF7因外源施加了蔗糖和生长素,导致体内基因表达相对于对照组显著降低,而乙烯与生长素的拮抗作用也使得RcETR1的表达显著降低.基于上述研究结果,筛选获得对月季‘黑魔术鲜切花保鲜效果最佳的保鲜液配方.研究结果为月季切花保鲜应用提供了理论依据和技术参考.
关键词: 月季鲜切花; 吲哚丁酸(IBA); 保鲜液; 保鲜效应
中图分类号: Q 945 文献标志码: A 文章编号: 1000-5137(2021)02-0243-10
Effect of IBA on its fresh-keeping of the cut roseRose hybrida Hort
LI Bowen1,2?, LI Lingmin1,2?, XIA Meng1,2?, PAN Siyuan1,2,CHEN Jiaying1,2*, LOU Yuxia1,2*, MING Feng1,2*
(1.College of Life Sciences, Shanghai Normal University, Shanghai 200234, China;2.Development Center of Plant Germplasm Resources, Shanghai Klormal University, Shanghai 200234, China)
Abstract: In order to explore the fresh-keeping effect of exogenous indole butyric acid (IBA) on fresh cut rose,sucrose+salicylic acid (SA) was used as the basic fresh-keeping solution,and with different concentration of IBA,the fresh cut rose,Rose hybrida Hort were vase-holding treated.And the physiological indicators of the fresh cut rose were observed and analyzed.The results showed that after 12 days of fresh-keeping treatment,different concentrations of IBA had different effects on the growth and quality of cut flowers.In the fresh-keeping liquid treatment group with 250 mg?L-1IBA content,the fresh cut flowers completely wilted and lost their ornamental value.In the fresh-keeping solution treatment group with 500 mg·L-1IBA content,fresh cut flowers can maintain good petal form.The flowers entered the full bloom on the 6th day,with a blooming crown of 8 cm diameter,and the final petal wilting rate was only 24.3%.At the same time,this treatment group has better physiological status than other groups,maintaining a good water balance and fresh weight,increasing the activity of superoxide dismutase (SOD) and peroxidase (POD),and sucrose content in petals significantly higher than other treatment groups.Further analysis of the expression of genes related to petal shedding was carried out.Among them,RcSUC2andRcARF7were exogenously applied with sucrose and auxin,resulting in a significant decrease in gene expressionin vivocompared to the control group,and the antagonism of ethylene and auxin also significantly decreased the expression ofRcETR1.Based on the above research results,the formula of the preservation solution has the best preservation effect on cut roseRosa hybridaHort.The results of this study provide theoretical basis and technological support for the application of cut rose fresh-keeping.
Key words: fresh cut rose; indole butyric acid(IBA); preservative solution; fresh-keeping effect
0 引言
月季(Rosa chinensis Jacq.)為蔷薇科、蔷薇属植物,是常绿、半常绿低矮灌木,条件适宜时四季开花.作为世界四大切花之一,月季色彩艳丽、香气浓郁、观赏性强,深受大众青睐.随着人们生活水平的不断提高,鲜切花的消费需求逐年扩大,鲜切花保鲜技术逐渐成为最主要的限制因素.中国鲜切花的损失率通常在30%以上,长途运输损耗率通常在40%以上.而发达国家鲜切花的损失率仅为2%左右[1].为了将鲜切花保存更长的时间,通常会给鲜切花施加营养物质,其中,糖类是植物生长发育必备的主要营养能源.有研究证明:番茄扦插不定根的形成与糖代谢有关[2];绿豆芽在第3 d后可溶性糖的含量会迅速增加,此时具有较高的营养价值[3].因此,根据植物生长的这一特性,合理地施加外源的单糖成分,能够促进植物生长.有研究报道:蔗糖(8.36 g?L-1)搭配其他激素处理绣球切花,能最大限度地延长绣球切花的保鲜时间[4];加入蔗糖保鲜液(25 g?L-1)对天门冬切叶的保鲜效果最佳[5].而植物激素中,生长素对植物生长具有低浓度促进生长,高浓度抑制生长的两重性.薛秋华等[6]以月季切花为实验材料,采用含蔗糖或钾盐的保鲜剂配方促进了生长素的合成,延缓了切花的衰老.吲哚丁酸(IBA)是一种人工合成的植物生长调节剂,比植物内源的吲哚乙酸(IAA)更具活性,能促进细胞的分裂和伸长、新器官的分化和形成,防止果实脱落[7].IBA常用于植物扦插生根实验,而罕用于切花月季瓶插保鲜.
切花作为离体后的鲜活产品,切断了母体根系的水分供应,吸水与失水的平衡被打破.一般情况下,切花从花蕾期到盛开期需要一定的膨涨压,才能满足花朵各器官的纵向与横向伸展,此时水分平衡值为正值,即吸水量大于失水量.盛开期以后水分平衡值转为负值,花瓣膨胀压丧失,花瓣出现焦边现象,花枝出现萎蔫、弯颈现象[8].芍药(Paeonia lactiflora)切花在瓶插过程中的瓶插寿命与吸水量和失水量的下降速率呈显著负相关,与水分平衡值降为0的时间呈正相关,水分亏缺则是影响芍药切花衰老的原因之一[9].史国安等[10]研究的牡丹(Paeonia suffruticosa)切花,和杨明艳[11]研究的非洲菊(Gerbera jamesonii)切花均发现瓶插寿命与水分平衡值间的相关性.当细胞内活性氧的产生与清除不平衡时,就会发生氧化胁迫.花衰老早期,保护酶:超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(AsA-POD)活性先升高,再下降,表现出抗氧化防卫机制.开花后,抗氧化剂水平降低,总抗氧化能力下降,是细胞衰老的重要标志[12].李霞等[9]以6个芍药品种的切花为材料,观察其外部形态变化,并测其膜透性、O2-生成速率以及CAT,SOD活性变化,发现膜脂过氧化所造成的细胞膜损伤是启动切花衰老的生理原因之一.对切花月季(Rosa chinensis Jacq.)、郁金香(Tulipa gesneriana)、非洲菊和牡丹等都有类似的研究发现[13-16].花瓣蔗糖含量反映切花月季的营养物质利用情况,营养物质不足会引起器官脱落.据报道:花瓣脱落过程中,蔗糖转运体RcSUC2表达量下降.同时生长素和乙烯信号转导通路的调控基因RcARF7和RcETR1等已被证明参与了花瓣脱落的调控[17].
目前,有关月季鲜切花保鲜的研究较少,月季品种的特异性也导致了不同的品种需要不同的保鲜处理方式.本研究设置不同浓度梯度的IBA保鲜液,通过测定瓶插期间切花月季花枝鲜重变化,以及水分平衡值变化,来探究IBA浓度对切花月季衰老过程中水分代谢的影响;通过测量切花月季瓶插期间花瓣相对电导率得到植物膜系统状况,以及通过二氨基联苯胺(DAB)、氯化硝基四氮唑蓝(NBT)染色法得到花瓣活性氧代谢程度,以探究IBA浓度对切花月季衰老过程中的生理影响.
1 材料与方法
1.1 材料与试剂
植物材料为‘黑魔术切花月季品种(上海盛佰丽玫瑰园与上海师范大学植物种质资源开发中心联合实验基地).
生化试剂包括:蔗糖、水杨酸(SA)、IBA、无水乙醇、dNBT、DAB、甘油、植物蔗糖含量检测试剂盒(Solarbio公司).
1.2 仪器与设备
分析天平、游标卡尺、摇床、电导率仪、500 mL无色透明塑料瓶、定植篮、海绵.
1.3 方 法
1.3.1 實验分组及处理
切花月季从花朵开放到花瓣脱落的过程可以分为6个阶段.其中,第1阶段到第3阶段,花瓣脱落带细胞比相邻细胞密集;第4阶段到第5阶段,花瓣脱落带细胞堆积松散;第6阶段,花瓣脱落带细胞间分离明显.
本实验选用发育良好、花蕾饱满、花径大小一致、叶片颜色均匀、无机械损伤、无病虫害的切花月季‘黑魔术,采收处于第4阶段的花材为材料,探究不同浓度IBA对切花月季保鲜效果的影响.将采收的切花月季修剪留枝长约25 cm,保留5~6片叶.实验设置6个处理(表1),以基础保鲜液为对照(CK).
取500 mL无色透明塑料瓶,每个处理梯度3 次重复,每瓶瓶插一支切花月季并用定植篮、海绵固定,做好标记,加入等量的不同配方保鲜液.置于通风良好的室内,瓶插期间保持日间温度25 ℃,夜间温度16 ℃,湿度40%,每3 d更换一次保鲜液.
1.3.2 理化指标的测定
1) 花枝花径的测量:瓶插期间,每3 d使用游标卡尺,于上午10时测定每枝花朵的花冠直径.
2) 花枝鲜重及水分平衡值的测量采用称量法测定.每3 d更换保鲜液前后,分别使用分析天平测量:A=瓶+保鲜液+定植篮+海绵+花枝质量;B=瓶+保鲜液质量;C=海绵+定植篮质量.
花枝鲜重=A-B-C.
花枝吸水量为两次测量B的质量差值,花枝失水量为两次测量A的质量差值.
花枝水分平衡值=花枝吸水量-花枝失水量.
3) 花瓣相对电导率采用抽气法测定.用打孔器取3片大小一致的花瓣作为一组,每个样品3组重复,加入10 mL双蒸水(dd H2O)抽真空,使叶片全部浸没在水中.摇床轻摇4 h,用电导率仪测量煮前电导率C1.沸水浴20 min,冷却至室温后,测量煮后电导率C2.相对电导率为C1×100%/C2
4) 花瓣衰老萎蔫比率计算:瓶插12 d后,计数每朵花中颜色变暗、边缘卷曲发黑的花瓣数目以及每朵花总花瓣数,花瓣衰老萎蔫比率前者除以后者.
5) POD和SOD活性检测:POD活性采用DAB染色法测定,SOD活性采用NBT染色法测定.在各保鲜液浓度梯度处理的样品中随机取3片花瓣,加入各自染液,沸水浴加热5 min,暗处静置16 h染色,倒出染液,用清水冲洗样品2~3次,加入无水乙醇,水浴加热5 min,倒去乙醇,重复至脱色,加入40%体积分数的甘油溶液保存,暗处静置2 h,取出花瓣样品,吸干甘油后进行观察.
6) 花瓣蔗糖含量测定:采用Solarbio公司植物蔗糖含量检测试剂盒进行测定.
7) 植物脱落相关基因(SUC2,ARF7,ETR1)实时荧光定量聚合酶链式反应(qPCR)测定:取各样品花瓣提RNA,定量反转录cDNA,设计定量引物,各设计3对引物进行点样qPCR;分析qPCR数据.选取引物如表2所示.
用Excel进行数据整理与分析,用Photoshop整合图片,用Prism 9制图,用Studentst-test进行显著性检验和分析.
2 结果分析
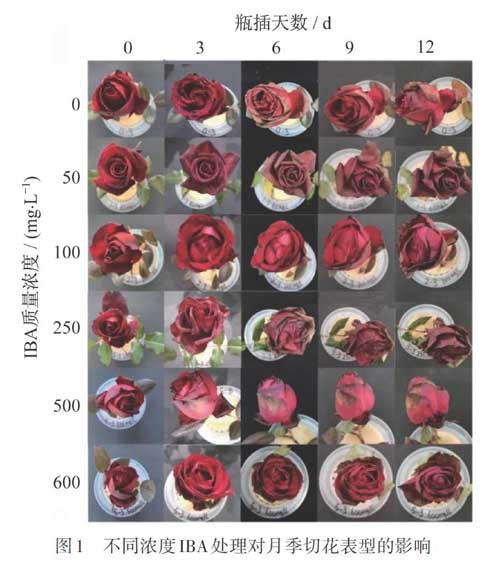
2.1 不同浓度IBA保鲜液对切花月季生理形态的影响
选取相同枝长、相同开花阶段的月季花枝,在含不同浓度IBA的保鲜液中瓶插处理.瓶插期间每3 d更换一次保鲜液,并在每次更换保鲜液时对鲜切花进行照相记录(图1).
从瓶插保鲜处理第3 d开始,IBA质量浓度250 mg?L-1处理组最先出现花瓣焦边现象,IBA 100 mg?L-1和600 mg?L-1处理组,与第0 d相比,花朵开放程度变化最大.第6 d时,所有处理组均出现不同程度的花瓣焦边现象,其中IBA 50 mg?L-1处理组花瓣焦边范围最大,表现最为明显;第12 d时,IBA 500 mg?L-1的处理组相较于其他组出现焦枯、萎蔫、发黑的花瓣数量最少,能够保持较好的生理形态.该结果表明:IBA质量浓度500 mg?L-1的保鲜液处理组在瓶插第12 d后花朵表型最好.
2.2 不同浓度IBA保鲜液对切花月季花瓣萎蔫率的影响
瓶插12 d后,对上述处理的鲜切花花瓣中出现萎蔫、颜色变暗、边缘卷曲发黑的花瓣数,以及总花瓣数进行统计,计算得出花瓣萎蔫比率(图2).所有处理组的花瓣萎蔫比率相较于空白对照组均有下降,IBA质量浓度500 mg?L-1的处理组与对照组相比具有显著性差异,花瓣衰老萎蔫比率最低,在瓶插后期能保持花瓣不掉落,且具有良好的花瓣形态.
不同浓度IBA处理对月季切花花瓣萎蔫率的影响.保鲜液中IBA质量浓度为(a) 0;(b) 50 mg?L-1;(c) 100 mg?L-1;(d) 500 mg?L-1;(e) 600 mg?L-1时的花瓣;(f) IBA浓度与花瓣萎蔫率关系,*表示有显著性差异,**表示极显著性差异
2.3 不同浓度IBA保鲜液对切花月季花枝衰老相关生理指标的影响
瓶插期间不同处理组月季切花花枝的鲜重变化趋势大致相同.随着瓶插时间的延长,花枝的鲜重大致呈先上升、后下降的变化规律,相较于第0 d的鲜重,500 mg?L-1IBA处理组在瓶插期鲜重变化最小,鲜重变化率最低,能保持较好的保鲜效果,如图3(a)所示.
不同浓度IBA保鲜液处理下水分平衡值的变化趋势,总体呈先下降、后稍有回升,之后再出现下降的趋势.其中对照组、50 mg?L-1和600 mg?L-1IBA处理组的水分平衡值下降最快,最早出现负值.IBA处理组的鲜切花水分平衡值出现负值的时间较对照组推迟,但都在第6 d前降到负值.500 mg?L-1IBA处理组的水分平衡值的负值绝对值比其他处理组小.研究结果表明:500 mg?L-1IBA处理组中花枝的水分含量比其他处理的相对更高,这说明在维持切花水分平衡值中500 mg?L-1IBA的保鲜液处理组具有较好作用,如图3(b)所示.
5种不同浓度IBA处理均不同程度地促进了鲜切花的开放,600 mg?L-1和100 mg?L-1IBA处理组切花花径在第3 d达最大值,花径增加最明显.而采用其他浓度IBA处理的切花花径达到最大值的时间比对照有不同程度的推后,在第6 d达到峰值后出现失水皱缩现象.结果表明:过低或者过高浓度的IBA处理,均会促进花瓣的脱落,这也间接验证了植物激素两重性的观点,如图3(c)所示.
相对电导率反映植物膜系统状况,能够间接地表明植物在受到逆境胁迫下,细胞膜破裂、膜蛋白受伤害、胞质的胞液外渗,及细胞受损伤的情况.通过观察切花月季花朵表型及分析其水分代谢情况,发现250 mg?L-1IBA的保鲜液处理组花朵衰老速度最快,于第9 d完全萎蔫,丧失研究价值,因此仅对处理组1、处理组2、处理组4、处理组5及CK组进行后续生理指标分析.在本实验中,保鲜液中IBA质量浓度在100 mg?L-1及以下时,随施加的IBA浓度提高,切花月季花瓣相对电导率逐渐递增,而保鲜液中IBA质量浓度为500 mg?L-1时,相对电导率最低,之后随IBA浓度增加,相对电导率递增.综合实验结果,500 mg?L-1IBA 的保鲜液处理可有效减少膜系统受伤害程度,使切花月季保持较好的生理状态,如图3(d)所示.
2.4 切花月季衰老过程中的活性氧代谢
采用DAB,NBT染液进行染色,验证POD与SOD的积累.过氧化氢可以直接或间接地反映植物细胞受到损害的程度,植物细胞受到损害越严重,DAB染色后棕色物质积累越多.由图4可知:细胞受到损害最严重的是50 mg?L-1IBA处理组,较轻的是500 mg?L-1和600 mg?L-1IBA处理组,表明在这两个浓度下,花瓣中POD的活性较高.而SOD可清除植物体内O2-的积累,经过NBT染色后,样品蓝色愈深,说明酶活性愈低,反之酶活性愈高.图4中,600 mg?L-1IBA处理组表现出较深的蓝色,500 mg?L-1IBA处理组蓝色最浅,SOD酶活性最高.研究表明:经过500 mg?L-1IBA处理的花枝,能够维持较高的POD和SOD活性,增强花瓣的抗氧化性,延缓衰老,达到较好的保鲜效果(图4).
2.5 不同浓度IBA处理对切花月季花瓣脱落相关基因的影响
植物生长发育需要营养,其中,蔗糖作为碳源,能有效地被植物利用,促进植物细胞生长.在保鲜液中加入蔗糖,既能为植物提供营养,还能够维持长期稳定的渗透压.以上数据表明,500 mg?L-1IBA處理组的切花月季保鲜效果最好,而生长素能够调节植物体内对蔗糖的吸收.测定第12 d月季切花花瓣的蔗糖含量,外源施加IBA的处理组,其花瓣中蔗糖含量均高于对照组.其中,500 mg?L-1IBA处理组的蔗糖含量显著高于其余处理组,与对照组差异极其显著,如图5(a)所示.
为了探究不同浓度的IBA处理对切花月季相关基因表达的影响,选择影响衰老的相关基因进行了分析.首先测定RcSUC2,RcARF7,RcETR1基因的表达量.与对照组相比,各处理组RcSUC2,RcARF7,RcETR1的表达量均大幅度下降,差异极显著,说明在添加了IBA之后,会强烈抑制相关基因的表达.一方面,IBA作为外源生长素,能够与体内生长素竞争,抑制生长素相关基因的表达.而蔗糖转运蛋白RcSUC2作为下游基因,也会受到RcARF7相关基因的影响;另一方面,生长素与乙烯具有拮抗作用,外源生长素的添加,会显著抑制体内乙烯基因RcETR1的表达,体内激素与营养维持在一个特定的水平.研究结果表明:随着IBA浓度的增加,RcSUC2,RcARF7的表达量呈先增加、后下降的趋势,而RcETR1的表达量仅表现受到抑制这一现象,如图5(b)~5(d)所示.对比蔗糖含量的数据,推测可能存在其他基因调控通路影响切花月季蔗糖的吸收与合成.结果表明:500 mg?L-1IBA处理下,切花月季保鲜效果最佳,其体内基因表达在一个特定的水平,维持良好的生理状态.
3 讨论
鲜切花在采摘后脱离母株,失去了能量和水分来源,在瓶插期间逐渐失水萎蔫,走向衰老.其主要原因是瓶插期间水分的胁迫、能源的缺乏、乙烯的生成,及真菌、细菌的滋生等[18].因此,月季切花的保鲜首先需要足够的营养供应,本研究在保鲜液中加入质量浓度为10 g?L-1的蔗糖,为切花保存提供了营养物质,SA的加入一方面缓解了瓶插时的水分胁迫,一方面也能起到抑菌的作用,本实验的目的是探究不同浓度的生长素IBA对切花保鲜的影响.有研究报道:生长素可在成熟的韧皮部中,与其他代谢产物一起以集流的形式,进行快速的非极性运输[19].研究结果表明:不同浓度IBA处理组在花枝鲜重、花瓣萎蔫率以及花枝水分平衡值方面均与对照组存在差异,生长素类似物IBA可以影响植物对蔗糖等营养成分的吸收,缓解月季切花的衰老.在香碗豆(Lathyrus odoratus)、金鱼草(Antirrhinum majus)、兰花等花卉中,都发现IBA能抑制花蕾、花瓣以及整朵花的脱落[20].并且发现采用100 mg?L-1的IBA瓶插处理艳山姜切花,能延长切花的瓶插寿命,在瓶插过程中切花的鲜重下降最慢,且抑制了花蕾脱落[21].
本实验结果表明:500 mg?L-1IBA处理组有效抑制了花蕾、花瓣脱落;另一方面,IBA处理推迟了水分亏缺出现的时间,增加了切花月季鲜重,延缓了月季萎蔫衰老,使得月季切花在瓶插期间保持了较高的含水量.同时,在推迟花枝最大花径出现时间方面,IBA处理组相较于对照组也有较好的表现.活性氧的积累会导致膜脂过氧化,攻击膜脂双分子层中的不饱和脂肪酸,造成膜系统的损伤,代谢紊乱,导致衰老的发生[23].本实验通过对切花月季花瓣DAB,NBT染色发现在瓶插月季过程中外源施加IBA,可有效降低细胞受损程度,改善月季衰老死亡过程中的膜系统状况.实验发现:外源施加蔗糖和IBA能一定程度上促进蔗糖的运输,IBA处理组中切花蔗糖含量显著高于对照组,相关基因RcSUC2,RcARF7,RcETR1的表达均会受到抑制,RcSUC2与RcARF7随着IBA浓度的增加,其表达量先增加,随后受到抑制,表达量下降.过低或过高浓度的外源生长素均会抑制基因的表达,RcETR1的表达则一直处于抑制的状态,与IBA浓度变化没有显著相关.对于切花保鲜的研究,可以根据鲜花品种的基因特性,从细菌、真菌感染的影响,植物的衰老机制等方面针对性地探索保鲜液[24].
4 结 论
本实验以蔗糖+SA为基础保鲜液,分别添加不同浓度梯度的IBA,对月季鲜切花进行瓶插保鲜处理,观察分析鲜切花的各项生理指标,证明IBA在月季切花瓶插过程中对延缓其衰老萎蔫具有显著作用.本实验得出了‘黑魔术品种月季切花保鲜效果较好的保鲜液配方:蔗糖(10 g?L-1)+SA(50 mg?L-1)+IBA(500 mg?L-1),不但可应用于该月季品种切花保鲜,而且为更多鲜切花保鲜液的研究提供了技术参考.
参考文献:
[1] 詹轶景.云南鲜切花出口的现状 [J].商讯,2019(4):26.
ZHAN Y J.Current situation of Yunnan fresh cut flower export [J].Business,2019(4):26.
[2] 張晓蕊,谢露露,董春娟,等.叶片切除对番茄扦插苗茎基部糖含量及不定根发生的影响 [J].中国蔬菜,2020(11):60-65.
ZHANG X R,XIE L L,DONG C J,et al.Effect of leaf excision on sugar content in basal part of stem and adventitious root formation in tomato cutting seedlings [J].China Vegetables,2020(11):60-65.
[3] 刘远平,李娟,赵成萍,等.绿豆芽萌发过程中营养成分变化规律研究 [J].安徽农业科学,2021,49(3):203-204,208.
LIU Y P,LI J,ZHAO C P,et al.Study on the variation of nutrient composition of mung bean sprouts during germination [J].Journal of Anhui Agricultural Sciences,2021,49(3):203-204,208.
[4] 杨景雅,赵艳娟,张静,等.绣球切花采后保鲜技术的研究 [J].黑龙江农业科学,2020(2):61-72.
YANG J Y,ZHAO Y J,ZHANG J,et al.Study on technology of postharvest preservation of the cut flower ofHydrangea macrophylla[J].Heilongjiang Agricultural Sciences,2020(2):61-72.
[5] 杨运英,卢淑仪,王廷芹.保鲜剂对天门冬切叶的保鲜效应 [J].亚热带植物科学,2020,49(5):345-350.
YANG Y Y,LU S Y,WANG T Q.Effect of preservative on cut leaves of Asparagus cochinchinensis [J].Subtropical Plant Science,2020,49(5):345-350.
[6] 薛秋华,林如.月季萨蔓莎切花衰老过程中内源激素水平变化 [J].热带作物学报,2005,26(2):62-67.
XUE Q H,LIN R.Changes of endogenous hormone of cut Rosa hybrida cv.Samantha during senescence [J].Chinese Journal of Tropical Crops,2005,26(2):62-67.
[7] 周毅,尤忠胜,俞越汉,等.化学药剂对唐菖蒲切花衰老的影响 [J].园艺学报,1994,21(2):189-192.
ZHOU Y,YOU Z S,YU Y H,et al.Effect of chemicals on senescence of cut Gladiolus [J].Acta Horticulturae Sinica,1994,21(2):189-192.
[8] 郭聞文,陈瑞修,董丽,等.几个牡丹切花品种的采后衰老特征与水分平衡研究 [J].林业科学,2004,40(4):89-93.
GUO W W,CHEN R X,DONG L,et al.The postharvest characteristics and water balance of some cultivars of tree_Peony cut flowers [J].Scientia Silvae Sinicae,2004,40(4):89-93.
[9] 李霞,张玉刚,郑国生,等.芍药切花瓶插期衰老进程及膜脂过氧化研究 [J].园艺学报,2007,34(6):1491-1496.
LI X,ZHANG Y G,ZHENG G S,et al.Studies on the senescence process and membrane-lipid peroxidation of cut Peony flowers during the vase-holding [J].Acta Horticulturae Sinica,2007,34(6):1491-1496.
[10] 史国安,郭香凤,张国海,等.不同发育时期牡丹切花瓶插生理特性的研究 [J].园艺学报,2010,37(3):449-456.
SHI G A,GUO X F,ZHANG G H,et al.Studies of vasing physicological characteristics of cut peony flowers in various development stages [J].Acta Horticulturae Sinica,2010,37(3):449-456.
[11] 杨明艳.非洲菊切花水分平衡、鲜重变化和瓶插寿命的关系探究 [J].保鲜与加工,2012,12(6):12-16.
YANG M Y.Study on water balance,fresh weight change and vase life of Gerbera jamesonii cut flowers [J].Storage and Process,2012,12(6):12-16.
[12] BARTOLI C G,SIMONTACCHI M,GUIAMET J J,et al.Antioxidant enzymes and lipid peroxidation during aging of Chrysanthemum morifolium ram petals [J].Plant Science,1995,104(2):161-168.
[13] 薛秋华,林如.月季切花衰老与含水量、膜脂过氧化及保护酶活性的关系 [J].福建农业大学学报,1999,28(3):304-308.
XUE Q H,LIN R.Senescence of China rose cut-flower and its relationships to moisture content,lipid peroxidation and protective enzyme activity [J].Journal of Fujian Agricultural University,1999,28(3):304-308.
[14] 王华,张继澍,王飞.郁金香切花瓶插期的衰老与膜脂过氧化的关系 [J].西北植物学报,1994,14(3):220-224.
WANG H,ZHANG J S,WANG F.The relationship between senescence and membrane lipid peroxidation in cut Tulips during vase-holding life [J].Acta Botanica Boreali-Occidentalia Sinica,1994,14(3):220-224.
[15] 吴岚芳,黄绵佳,蔡世英.非洲菊切花活性氧代谢的研究 [J].园艺学报,2002,30(1):69-73.
WU L F,HUANG M J,CAI S Y.Studies on metabolism of active oxygen during senescence of cut Gerbera [J].Acta Horticulturae Sinica,2002,30(1):69-73.
[16] 史国安,郭香凤,包满珠.牡丹花不同发育时期脂质过氧化代谢的相关性研究 [J].西北农林科技大学学报(自然科学版),2008,36(8):183-189.
SHI G A,GUO X F,BAO M Z.Correlation analysis of lipid peroxidation metabolism during florescence and flower senescence of Peony [J].Journal of Northwest A & F University(Natural Science Edition),2008,36(8):183-189.
[17] LIANG Y,JIANG C Y,LIU Y,et al.Auxin regulates sucrose transport to repress petal abscission in Rose (Rosa hybrida) [J].The Plant Cell,2020,32(11):3485-3499.
[18] PETRIDOU M,VOYIATZI C,VOYIATZIS D.Methanol,ethanol and other compounds retard leaf senescence and improve the vase life and quality of cut Chrysanthemum flowers [J].Postharvest Biology and Technology,2001,23(1):79-83.
[19] PETRASEK J,FRIML J.Auxin transport routes in plant development [J].Development,2009,136(16):2675-2688.
[20] HALEVY A H,MAYAK S.Senescence and postharvest physiology of cut flowers:Part 2 [J].Horticultural Reviews,1981,3:59-143
[21] 葉向斌,盛爱武,刘念,等.IBA及热击处理对艳山姜切花保鲜效果的影响 [J].安徽农业科学,2008,36(14):5870-5871.
YE X B,SHENG A W,LIU N,et al.Effects of IBA and heat shock treatment on fresh-keeping Alpinia zerumbet cut flower[J].Anhui Agricultural Sciences,2008,36(14):5870-5871
[22] 王宝山.生物自由基与植物膜伤害 [J].植物生理学通讯,1988(2):12-16.
WANG B S.Biological free radicals and membrane damage of plants [J].Plant Physiology Communications,1988(2):12-16.
[23] 李晓玲,杨进,骆炳山.活性氧代谢与植物的抗逆性 [J].荆门职业技术学院学报,1999,14(3):30-35,50.
LI X L,YANG J,LUO B S.Active oxygen metastasis and plant stress resistance [J].Journal of Jingmen Vocational Technical College,1999,14(3):30-35,50.
[24] 李光亚,范华鹏,王盼,等.褪黑素对百合、月季切花保鲜效应的影响 [J].安徽农学通报,2020,26(22):54-56.
LI G Y,FAN H P,WANG P,et al.Effect of melatonin for cut flower preservation with Lilium spp.and Rosa hybrida [J].Anhui Agricultural Science Bulletin,2020,26(22):54-56.
(责任编辑:顾浩然,郁慧)
