血清胞外囊泡miR-331-5p在早发性帕金森病患者中表达水平的研究
2021-07-14刘郁张静静吕荣祥王文盛
刘郁 张静静 吕荣祥 王文盛
早发性帕金森病(early-onset Parkinson’s dis⁃ease,EOPD)是一种与年龄有关的中枢神经系统退行性病变,可于50岁前出现首发症状[1,2],且EOPD具有特殊的临床特征[3],目前区分EOPD 和晚发性帕金森病(late-onset Parkinson’s disease,LOPD)的分子检测手段仍有限[4]。本次研究比对分析EOPD 和LOPD 患者中血清胞外囊泡的差异表达miRNAs 水平[5],借助生物信息工具挖掘其靶基因及网络互作。现报道如下。
1 资料与方法
1.1 一般资料 收集2018 年2月至2019 年12月于宁波市第六医院神经内科就诊的帕金森病患者18例,其中男性10例、女性8例;年龄42~73岁,平均年龄(52.21±3.24)岁。所有患者均符合帕金森病诊断标准(2016 版中国帕金森病诊断标准)[6];排除标准为:①已知原因引起的继发性帕金森病,如药物、创伤或其他脑血管疾病;②有自身免疫性疾病或其他系统性疾病;③近期接受过药物治疗;④既往严重基础性疾病;⑤患有精神类疾病,不能够配合研究。根据患者起病年龄,将患者分为EOPD 组(≤50岁)7例和LOPD 组(>50岁)11例。EOPD 组男性4例、女性3例;平均年龄(55.29±10.03)岁;LOPD组男性6例、女性5例,平均年龄(50.27±3.60)岁。两组患者的性别、年龄比较,差异均无统计学意义(P均>0.05)。
1.2 方法
1.2.1 胞外囊泡RNA 提取 用血清管收集受试者患者外周血5 ml,在离心机上以1 500 r/min 离心5 min 后收集血清。采用exoRNeasy Serum/Plasma Maxi Kit 试剂盒(由德国QIAGEN 公司生产)通过膜亲和离心柱血清胞外囊泡。将预先过滤的血清与Buffer XBP 进行混合并结合在exoEasy 膜亲和离心柱上。对结合的囊泡小体使用Buffer XWP 进行清洗,并使用400 μl Buffer XE 进行洗脱,收集洗脱液。参考生产商说明,采用该试剂盒对血清囊泡中总RNA进行提取,并保存在-20 ℃冰箱备用。
1.2.2 胞外囊泡miRNA 水平 根据PubMed 数据库检索已报道与EOPD 相关的异常表达miRNAs,遴选出11个相关的miRNAs(miR-1、miR-22、miR-29a、miR-331-5p、miR-141、miR-146b-5p、miR-193a-3p、miR-214、miR-103a、miR-30b、miR-3134)[7]。血清样本提取的胞外囊泡RNA经定量后,采用qRT-PCR方法分析miRNAs 相对水平。根据miRNA第一链cDNA合成加尾法逆转录RNA。将cDNA用作RT-PCR模板,使用MaximaTMSYBR Green qPCR Master Mix试剂(由美国Applied Biosystems 生产),ABI 7500 实时PCR 检测系统(由美国Applied Biosystems 生产)进行实时定量PCR。miRNA 引物由Invitrogen 公司(由美国Thermo Fisher Scientific 生产)合成。所有反应独立重复3次,U6 作为内对照,以2-△△ct进行相对定量分析,以确定囊泡miRNA 的相对表达水平。将差异表达最显著的miRNA 做为研究对象,研究其可能的生物学功能。
1.2.3 miRNA 靶基因的本体分析(gene ontology,GO)在TargetScan 数 据库(http://www.targetscan.org/vert_72/)输入筛选miRNA 后下载靶基因数据,使用String 数据库(https://string-db.org/)对Cumula⁃tive weighted context score<-0.2 的靶基因进行GO分析,找到与神经系统发育相关的靶基因,并分析这些基因所参与的生物学过程、分子功能和细胞成分,以P<0.05表示结果差异具有统计学意义。
1.2.4 蛋白质-蛋白质相互作用(protein-protein in⁃teraction,PPI)和关键靶基因筛选使用String 数据库对神经系统发育相关的靶基因构建PPI 网络图,使用R 软件统计各基因间蛋白质相互作用节点数,并筛选节点数最多的前20个基因与神经元成分相关基因取交集以筛选关键靶基因。
1.3 统计学方法 采用SPSS 23.0 及GraphPad Prism 5 统计软件。正态分布的计量资料以均数±标准差()表示,两组间比较采用独立样本t检验;计数资料以百分率表示,两组间比较采用χ2检验。设P<0.05为差异有统计学意义。
2 结果
2.1 差异miRNAs 在LOPD 和EOPD 患者血清胞外囊泡中的表达水平见图1
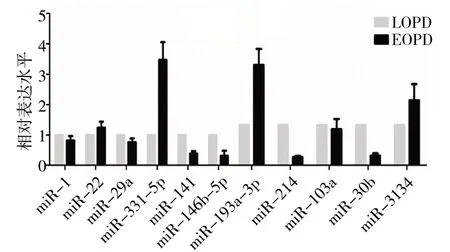
图1 差异miRNAs在LOPD和EOPD患者血清胞外囊泡中的表达水平
由图1 可见,miR-214、miR-30b、miR-141、miR-146b-5p、miR-193a-3p、miR-331-5p 在两组患者血清胞外囊泡中存在表达差异,与LOPD 组患者相比,EOPD 患者的miR-214、miR-30b、miR-141 及miR-146b-5p 表达下调(t分别=-7.12、-6.84、-3.61、-3.52,P均<0.05),而miR-193a-3p 和miR-331-5p表达上调(t分 别=23.14、25.22,P均<0.05),miR-331-5p 在所有差异表达的miRNAs 中变化水平最显著。
2.2 miR-331-5p 靶基因GO 分析 TargetScan 数据库获得miR-331-5p 靶基因数2 235,String 数据库进行GO分析,见表1~3。
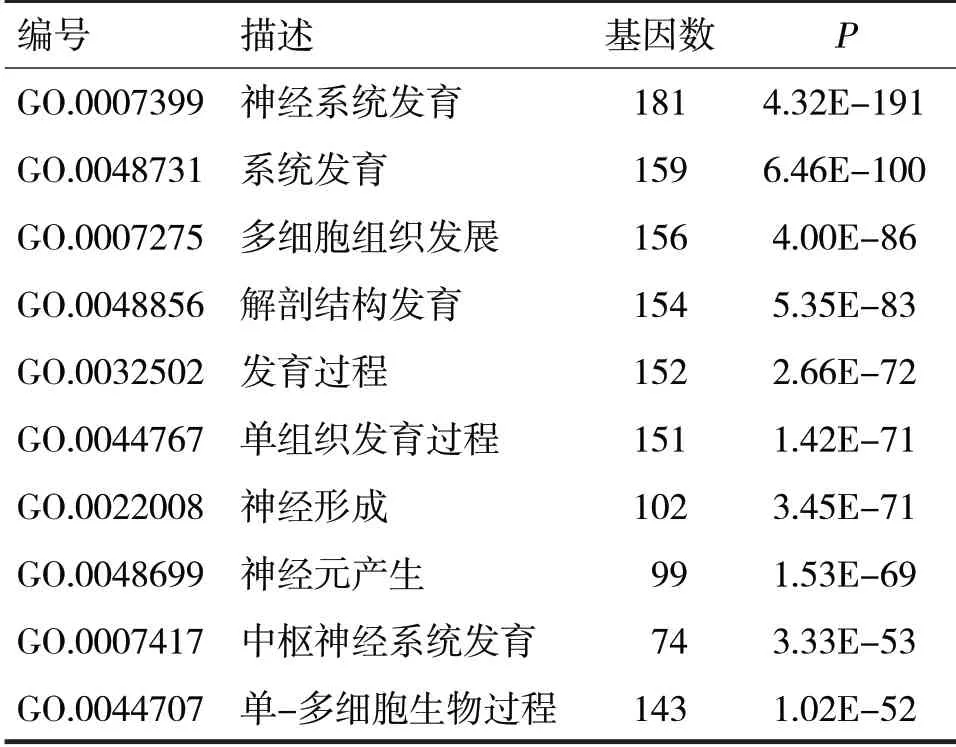
表1 神经系统相关基因的生物学过程分析
由表1 可见,靶基因主要参与神经系统发育、神经形成、神经元产生以及中枢神经系统发育等生物学过程,其中181个靶基因与神经系统发育有关。
由表2 可见,其靶基因主要功能是参与蛋白质结合及DNA连接。

表2 神经系统相关基因的分子功能分析
由表3 可见,靶基因主要参与神经元、轴突、树突和突触的组成。
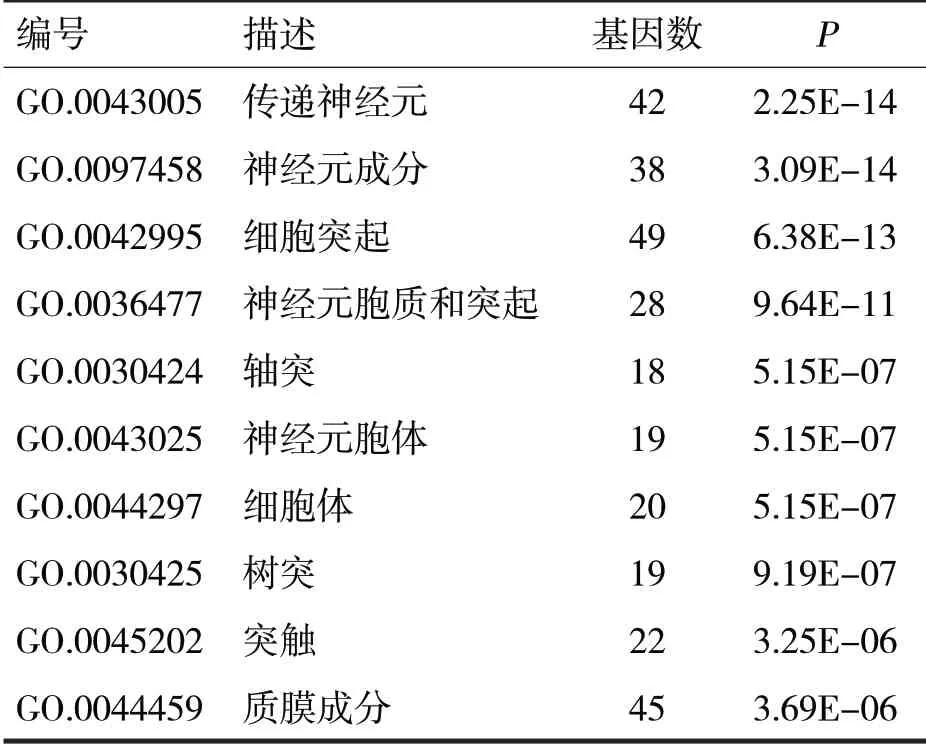
表3 神经系统相关基因的细胞成分分析
2.3 PPI 网络图、节点数统计及基因交集 应用String 数据库对181个与神经系统发育靶基因进行PPI分析,并对整个PPI网络中节点数最多的前20个基因进行统计,见图2~3。

图2 PPI网络图
由图3 可见,在整个PPI 网络中节点数最多的前20个基因分别是TP53、MAPK3、MAPK1、HSP90AA1、BCL2、KRAS、NRAS、PTEN、RHOA、HGF、HDAC9、JAK2、LYN、SMAD4、HDAC4、RUNX2、FGFR2、IRS2、HIF1A 以及GDNF,进一步对上述基因和GO分析结果中作为神经元细胞成分的38个关键基因取交集,结果发现PTEN和MAPK1既是miR-331-5p的关键靶基因,又参与调控神经元细胞组成。

图3 miR-331-5p靶基因构建的PPI网络中节点数最多的前20个基因
3 讨论
帕金森病是一种与年龄相关的神经系统退行性疾病,根据发病年龄可将其分为EOPD 和LOPD,两组患者具有不同的生物学背景。Pandey 等[8]用PCR-Sanger 测序法发现基因PRKN 在80%EOPD 患者中为杂合变异,而在尼日利亚Milanowski 等[9]发现PRKN、PINK1、DJ1、SNCA、LRRK2 在EOPD 患者中异常,张长国等[10]发现清除幽门螺杆菌能改善帕金森病患者运动功能,以上这些证据表明:种族、家族史、遗传学改变及环境因素是EOPD 发生的危险因素,但其发病原因及机制尚未完全明确,需进一步探索。
目前发现EOPD 与LOPD 患者的脑组织[11]、脑脊液[12]及外周血[13]中miRNAs 表达存在差异,然而对胞外囊泡miRNA 的差异表达研究十分有限。血清胞外囊泡中miRNAs 稳定性好、不易降解,有较好临床应用前景[14,15],已成为多种疾病诊断及预后研究热点[16]。本研究发现外周血游离11个经文献报道差异表达miRNAs 中,仅有6个miRNAs(miR-193a-3p、miR-214、miR-30b、miR-331-5p、miR-141、miR-146-5p)在血清胞外囊泡中存在同样差异,且除miR193a-3p 外,其余5个miRNA 变化趋势一致,运用生物信息学重点挖掘181个与神经系统发育有关的miR-331-5p 靶基因,GO分析发现这些靶基因参与神经调节的多个方面,如调节中枢神经系统发育,调控神经元、轴突、树突及突触生成,此外靶基因还参与蛋白质及DNA 间连接。本研究结合PPI 网络图结果,进一步发现PTEN和MAPK1既是神经系统发育互作最显著基因,又参与调节神经元组成。PTEN 是胰岛素信号级联反应负调节因子,其在帕金森病患者脑组织中表达水平显著升高,降低PTEN 核蓄积可改善帕金森病患者的神经退行性变[17],MAPK 激活可阻止神经元死亡[18]。事实上,PTEN 能抑制接头蛋白磷酸化及对MAPK 通路上游的RAS 活化。由于帕金森病发生发展与大脑神经元损伤密切相关[19],而胞外囊泡又易穿透血脑屏障将分子特异递送至中枢神经系统[20],因此推测胞外囊泡miR-331-5p 很可能通过靶向MAPK1与PTEN参与EOPD进展调节。
综上所述,EOPD 患者血清胞外囊泡中miR-331-5p 相对水平明显高于LOPD 患者,初步揭示了MAPK1 和PTEN 为其关键靶基因,胞外囊泡miR-331-5p 可能通过上述基因参与EOPD 发生与发展,但存在一定的局限性,仍需要大样本的体内和体外验证及采用全外显子测序技术进行深度的分子机制研究。
