原发性IgA肾病患者肾脏IgM沉积情况与其临床症状及 病理特征关系探讨
2021-07-13孙静静李龙海
孙静静,王 建,李龙海,董 葆,
(1.阜阳市第二人民医院肾脏病科,阜阳 236015;2.北京大学人民医院肾内科,北京 100044)
IgA肾病为我国常见原发性肾小球疾病,其症状复杂多变,患病率高,约占原发性肾小球疾病的40%左右,损害极为严重[1-2]。临床研究发现[3],IgA肾病的病理类型多种多样,且症状轻重不一,为免疫病理诊断,症状主要表现为:蛋白尿、血尿、血压升高,严重的表现为肾功能不全。IgA肾病以肾小球系膜区IgA、c3沉积为主,同时可能伴有IgM或IgG沉积[4]。有研究证明[5],超过一半的IgA肾病患者经过长达30年的疾病进展至终末期,终末期肾病患者的死亡率极高,严重危及患者生命安全,且引起症状、病理及表现均各不相同,病理特征和影响IgA肾病预后因素也有所不同。临床研究发现[6],肾病范围内的高血压、高尿酸血症、肾功能受损程度和蛋白尿均是疾病进展为终末期肾脏疾病的危险因素,IgM在肾组织中的沉积影响着多种肾脏疾病发展,因此研究IgM 沉积IgA肾病患者的临床和病理关系较为重要,能为早期发现肾脏病理类型提供依据。本次研究将患者分为IgM 沉积和IgM 阴性组,对比其临床症状和病理特征,分析其之间的关系,为临床诊治提供依据,现报道如下。
1 资料与方法
1.1 一般资料选取2016年6月~2019年6月于我院就诊的145例原发性IgA肾病患者作为研究对象,将患者按检查结果分为两组,即IgM沉积组(72例)和IgM阴性组(73例)。纳入标准:①符合原发性IgA肾病诊断标准;②伴有高血压、血尿、蛋白尿及水肿症状;③患者年龄大于18岁;④患者对研究内容知情,并签署同意书;⑤研究经我院伦理委员会批准。排除标准:①患者有严重原发性疾病,如心脑血系统疾病;②患者有消耗性疾病,如活动性结核病、恶性肿瘤等;③患者有肾移植手术史;④患者为继发性IgA肾病,如肝硬化相关肾炎、乙肝病毒相关肾炎和过敏性紫癜肾损害;⑤患者肾活检组织中,肾小球数量小于10个;⑥患者临床资料不全。
其中,两组一般资料比较,无统计学意义(P>0.05),可对比分析,见表1。

表1 两组一般资料情况比较(n)
1.2 方法对2组患者的性别、年龄、病程和临床表现及尿常规、血生化指标、尿系列蛋白、24h尿蛋白定量等资料进行回顾性分析。镜下血尿为尿红细胞大于3个/HP。高血压:非同日2次以上的测量舒张压≥12kPa或收缩压≥18.6kPa。采用CKD-EPI估算肾小球滤过率(eG-FR),进行慢性肾脏病(chronic kidney diseases,CKD)分期。肾病综合征定义:尿蛋白大于3.5g/24h,血蛋白小于30g/L,并伴有水肿、高脂血症。
肾活检取(22.5±10.2)个肾小球,在显微镜下解剖、观察、分割,采用直接免疫荧光法检测患者肾组织中的IgA、IgG、IgM、C1q、C3的沉积部位、强度。采用光镜观察患者肾小球、肾血管病变、肾小管间质情况。肾组织常规处理后,由两名肾脏病理医师采用盲法阅片。
肾脏病理学结果判定[9]:①采用荧光强度判断免疫复合物沉积强度。高倍镜下未见为阴性;低倍镜下勉强可见,而高倍镜下明显可见为+;低倍镜下明显可见,而高倍镜下清晰可见为++;低倍镜下清晰可见,而高倍镜下耀眼为+++;低倍镜下耀眼,而高倍镜下刺眼为++++。本次我院研究中,IgM沉积组为+++~++++,IgM阴性组为阴性。②采用Katafuchi et al半定量积分比较各项病理参数。③采用Lee氏标准评定肾脏病理变化,其主要分为5级。④采用牛津分类标准进行半定量分级,主要有肾小管萎缩或肾间质纤维化、肾小球节段性硬化或粘连、毛细血管内皮细胞增生、系膜细胞增生。
1.3 观察指标 两组患者临床特征情况比较;两组患者尿蛋白指标情况比较;两组患者生化指标情况比较;两组患者肾脏病理学情况比较。
1.4 统计学分析本次我院研究数据,均采用统计软件SPSS 18.0进行分析,采用均数±方差表示计量数据,采用[n(%)]表示计数资料,采用t或x2或u检验进行组间比较,判断统计学是否具有意义的标准是P<0.05。
2 结果
2.1 两组患者临床特征情况比较两组高血压、平均舒张压、平均收缩压、水肿和肉眼血尿均差异不显著(P>0.05),IgM沉积组血尿和肾病综合征明显比IgM阴性组更多(P<0.05),见表2。

表2 两组患者临床特征情况比较 [n(%)]
2.2 两组患者尿蛋白指标情况比较IgM沉积组尿白蛋白、尿转铁蛋白、尿总蛋白、24h尿蛋白/肌酐、24h尿蛋白定量和尿IgG水平明显高于IgM阴性组(P<0.05),两组尿RBP水平差异不显著(P>0.05),见表3。

表3 两组患者尿蛋白指标情况比较 [M(P25,P75)]
2.3 两组患者生化指标情况比较两组血肌酐、血IgM、血IgA水平差异不显著(P>0.05),IgM沉积组血尿素氮明显高于IgM阴性组,血白蛋白、eG-FR、血IgG水平明显低于IgM阴性组,IgM沉积组CKD分期明显重于IgM阴性组(P<0.05),见表4。
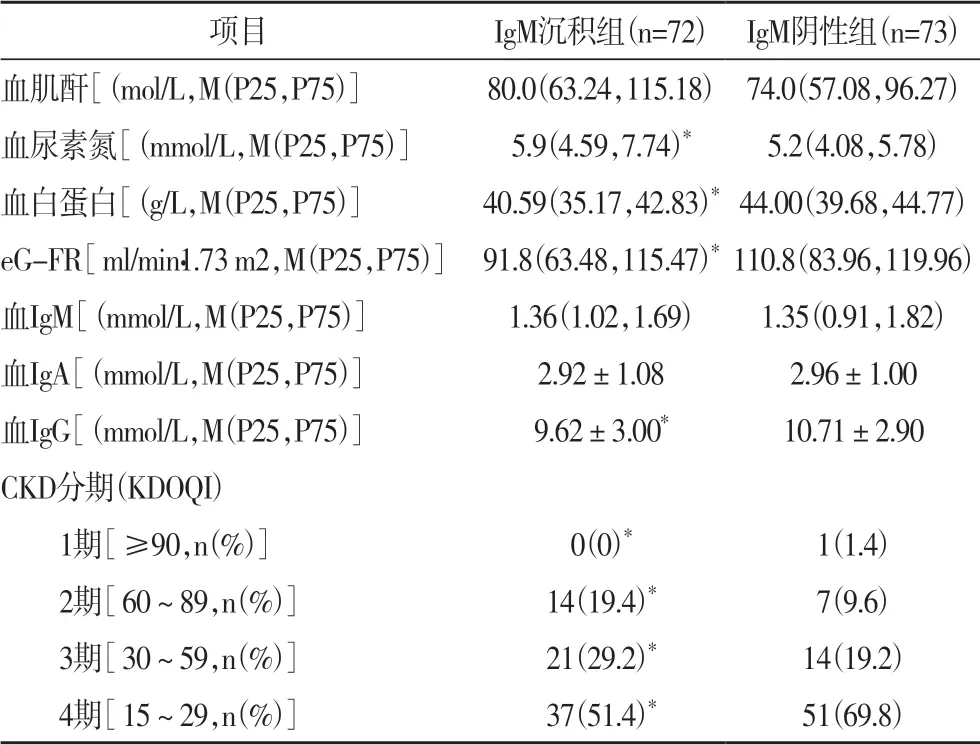
表4 两组患者生化指标情况比较[n(%)]
2.4 两组患者肾脏病理学情况比较IgM沉积组Lee氏分级Ⅳ级多于IgM阴性组,但差异差异不显著(P>0.05),IgM沉积组T1和T2明显多于IgM阴性组,T0明显低于IgM阴性组(P<0.05),IgM沉积组M1、E1和S1多于IgM阴性组,但差异差异不显著(P>0.05),IgM沉积组肾小管间质积分和总积分明显高于IgM阴性组(P<0.05),见表5。

表5 两组患者肾脏病理学情况比较[n(%)]
3 讨论
IgA肾病是一种免疫病理诊断,患者的病变程度可能不一。有文献报道[7],IgA肾病可能发生在任何年龄,其高发人群在20~40岁之间,我国是IgA肾病高发区,并且原发性IgA肾病最多。大量临床研究发现[8],IgA肾病患者的病情呈进行性发展,最终可进展为终末期肾病,危及患者生命健康。本次研究显示,所有患者的临床症状,如高血压、平均舒张压、平均收缩压、水肿和肉眼血尿均差异不显著,但IgM沉积患者的血尿和肾病综合征与IgM阴性患者相比明显更多,由此可知IgM沉积患者的临床症状更为严重,可以用于判断疾病严重程度。
有研究发现[9],肾小球系膜区IgM沉积患者会出现更重的蛋白尿水平,但IgM沉积患者的尿蛋白水平高于IgM阴性患者。本次研究显示,IgM沉积患者尿白蛋白、尿转铁蛋白、尿总蛋白、24h尿蛋白/肌酐、24h尿蛋白定量和尿IgG水平均高于IgM阴性患者,可见IgM沉积患者蛋白尿相对更多,监测蛋白尿水平有助于疾病的判定。
有文献报道称[10-11],IgM是发展过程中最早合成、分泌出的抗体,其在细胞因子作用下会转换成为IgG。有研究认为[12-13],T细胞与肾病患者病情变化关系密切,且多数肾病患者均存在T细胞功能障碍,最终影响IgM向IgM转换,导致IgM水平异常升高,进而加重病情,增加临床治疗难度。临床研究发现[14-15],IgA肾病IgM沉积患者和血IgM水平上升具有相关性,因此推测血IgM沉积是IgA肾病不良预后的指证之一。本次研究显示,IgM沉积患者与IgM阴性患者的血肌酐、血IgM、血IgA水平差异不显著,IgM沉积患者血尿素氮明显高于IgM阴性患者,血白蛋白、eG-FR、血IgG水平明显低于IgM阴性患者,IgM沉积患者的CKD分期则明显重于IgM阴性患者,患者的血IgM差异不显著其原因还需进一步探讨,而血IgG水平明显降低,则与IgA肾病的发病机制有关,由此证明IgM沉积患者的肾功能损失更明显。
本次研究中采用了Lee氏分级、牛津分类和Katafuchi半定量分析病理分级系统评价患者的肾脏病理情况,其获取的信息更为全面,Lee氏分级显示IgM沉积患者Ⅳ级多于IgM阴性患者,但差异差异不显著,IgM沉积患者的T1和T2明显多于IgM阴性患者,T0明显低于IgM阴性患者,IgM沉积患者的M1、E1和S1多于IgM阴性患者,但差异差异不显著,IgM沉积患者肾小管间质积分和总积分明显高于IgM阴性患者,此结果证明IgM沉积患者肾小球硬化明显增多,其间质炎症细胞浸润显著,IgM沉积患者的肾小管间质损害更为严重,肾脏总体病理损伤更显著。有研究认为[16],IgA肾病的临床表现和病理类型无明显相关性,如果临床怀疑为IgA肾病,需尽早进行肾活检准确判断疾病的严重程度,延缓患者的疾病进展。
IgM沉积患者与IgM阴性患者相比,其临床表现更严重,尿蛋白水平明显更高,肾小球损伤更重,其总的病理损害更为显著。
