芳香烃受体新生鼠高氧肺损伤中的表达和调节机制*
2021-07-13王丽珍羊才进谢五菊
王丽珍 ,羊才进 ,谢五菊 ,李 玲△
(海南西部中心医院 1.儿科;2.呼吸内科,儋州 571700)
关键字 支气管肺发育不良;高氧;芳香烃受体;白介素33
支气管肺发育不良(bronchopulmonary dysplasia,BPD)为引起持续性呼吸窘迫的慢性肺部疾病,是早产儿(妊娠期<37周)常见疾病之一[1]。由于子宫内胎肺的成熟过程是处于低氧环境,因此暴露于过早的高氧环境中会导致严重的新生儿肺损伤,从而促进BPD 的发生发展[2]。而高氧导致BPD 的分子机制仍不明确。研究表明,白介素(IL)-33在高氧环境下调控炎症因子的分泌加速BPD 的发生发展[3]。芳香烃受体(the aryl hydrocarbon receptor,AhR)作为一类配体激活的转录因子,参与调控一系列应对环境刺激的分子反应[4]。近年来,AhR 越来越多的被认为是调节免疫细胞应答环境改变的重要分子,同时也参与炎症以及癌症的病理过程[5]。研究表明,在高氧环境下,AhR 减轻新生鼠肺组织的损伤程度[5],但AhR 调节高氧条件下新生鼠肺损伤过程的机制仍未被阐明。由于新生鼠肺组织结构与妊娠26~28周的胎儿肺组织相似[6],因此本研究利用高氧新生鼠肺损伤模型初步探究阐释AhR 对新生儿高氧肺损伤的保护机制。
1 材料与方法
1.1 主要试剂 小鼠肺上皮细胞系MLE-12购自上海ATCC 细胞库;C57BL/6J 小鼠购自美国Jackson实验室;培养基和胰蛋白酶购自美国Hibco 公司;6孔板和培养瓶购自美国Coring公司;RIPA和胎牛血清购自北京索莱宝试剂有限公司;BCA蛋白检测试剂盒购自上海碧云天生物试剂有限公司;AhR、IL-33、GAPDH 引物购自上海生工公司;PVDF 膜购自美国Millipore 公司;ECL 发光液购自美国Promega公司;Myc、AhR、和GAPDH抗体购自美国Cell Signaling公司;IL-33 ELISA kit、L-Kynurenine购自英国Abcam公司。
1.2 小鼠高氧肺损伤模型 出生<24 h,野生型C57BL/6J 雄性小鼠共16 只,采用随机数字表法分为高氧组和正常组,每组8 只,高氧组小鼠体重为(3.43±0.37)g,正常组小鼠体重为(3.64±0.44)g,两组体重比较差异无统计学意义(P<0.05)。高氧组置于氧浓度≥80%高压氧舱内,正常组在室内空气中(RA;21%O2),氧浓度仪持续检测氧浓度。两组小鼠分别由代母鼠喂养,每两天交换代母鼠。分别在开始实验的第3、7天,取4只小鼠进行检测。
1.3 细胞培养与转染 小鼠肺上皮细胞MLE-12培养于10%FBS。培养箱温度为37 ℃,CO2浓度为5%,O2浓度为20%。为模拟高氧环境,将细胞置于O2浓度>70%环境中24 h后收取。正常对照组不做特殊处理将MLE-12 细胞接种于六孔板中,每孔2×105个细胞。分为两组,分别为si-AhR 组和si-NC组。细胞贴壁培养24 h 后,利用liposome2000 进行细胞转染,转染6 h 后更换为完全培养基,24 h 后收取细胞进行分析。
1.4 AhR激动实验 将小鼠肺上皮细胞MLE-12接种于6 孔板中,每孔2×105个,分为实验组和对照组。实验组加入AhR 激动剂L-Kynurenine,对照组不做特殊处理,培养48 h后收取细胞和上清液。
1.5 qPCR检测细胞和小鼠肺组织 加入Trizol后,利用氯仿、异丙醇和75%乙醇溶液提取RNA,分光光度仪测定RNA浓度,并利用试剂盒逆转录成cDNA(Invitrogen)。qPCR 反应体系:95 ℃预变性10 min,(95 ℃5 s,60 ℃30 s,72 ℃30 s)40 个循环。数据以内参GAPDH为参照,根据2–ΔΔCt公式计算目的基因相对表达量。AhR 上游引物为5’-CCCTTCCCGCAAGATGTTAT-3’,下游引物为5’-TCAGCAGGGGTGGACTTTAAT-3’;IL-33 上游引物为5’-ATTTCCCCGGCAAAGTTCAG-3’,下游引物为5’-AACGGAGTCTCATGCAGTAGA-3’。内参GAPDH上游引物为5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物为5’-GGGGTCGTTGATGGCAACA-3’。
1.6 Western blotting 检测 利用BCA 试剂盒进行浓度测定,加入裂解液后煮沸变性。蛋白上样后进行SDS-PAGE 凝胶电泳,湿转后将PVDF 膜8%脱脂奶粉封闭1.5 h,TBST 洗3 次,一抗(1∶1 000)4 ℃孵育过夜。后的用TBST 洗3 次,二抗孵育2 h 后ECL曝光内参GAPDH(1∶2 000)和目的蛋白条带。
1.7 ELISA检测 将肺组织匀浆后取上清液,依照说明书使用IL-33 ELISA试剂盒(Abcam)测定IL-33的表达量。
1.8 统计学方法
采用SPSS 17.0 统计软件进行数据分析,计量资料以均数±标准差()表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 高氧下AhR在肺组织的表达
通过qRT-PCR 测定AhR 在高氧组和正常组新生鼠肺组织的表达水平,利用Western blotting 测定AhR 在高氧组和正常组的蛋白表达含量。第3 天,高氧组Ah R蛋白相对表达量为(0.87±0.08),显著高于正常组(0.11±0.03)(t=25.1595,P<0.001);第7 天,高氧组AhR的相对表达量为(0.93±0.11),显著高于正常组的(0.57±0.10)(t=6.849,P<0.001),见图1A。qPCR 结果显示,第3 天高氧组AhR 的表达量为2.31±0.03,明显高于正常组的(1.02±0.02)(t=101.196,P<0.001);第7 天高氧组AhR 的表达量为(4.21±0.03),明显高于正常组的(1.86±0.02)(t=184.394,P<0.001),见图1B。

图1 高氧条件下AhR在小鼠肺组织中的表达
2.2 肺组织中IL-33的含量
通过ELISA检测肺组织匀浆上清液中IL-33的含量。结果显示,第3 天高氧组IL-33 的表达量206.10±4.24,明显高于正常组的(160.5±3.53)(t=23.378,P<0.001);第7 天高氧组IL-33 的表达量为439.35±5.65,明显高于正常组的(297.98±5.57)(t=50.398,P<0.001),见图2。

图2 高氧环境下IL-33在肺组织的表达
2.3 高氧条件下AhR在肺上皮细胞的表达
通过Western blotting 和qPCR 检测AhR 在肺上皮细胞MLE-2的RNA和蛋白水平,高氧组AhR蛋白相对表达量为(0.59±0.12),明显高于正常组的(0.34±0.09)(t=2.887,P=0.035),见图3A;qPCR 结果显示,AhR 在高氧组表达水平为(4.73±0.40),在正常组表达水平为1.03±0.12,高氧条件下AhR在肺上皮细胞MLE-2 中显著上调(t=15.346,P<0.001),见图3B。
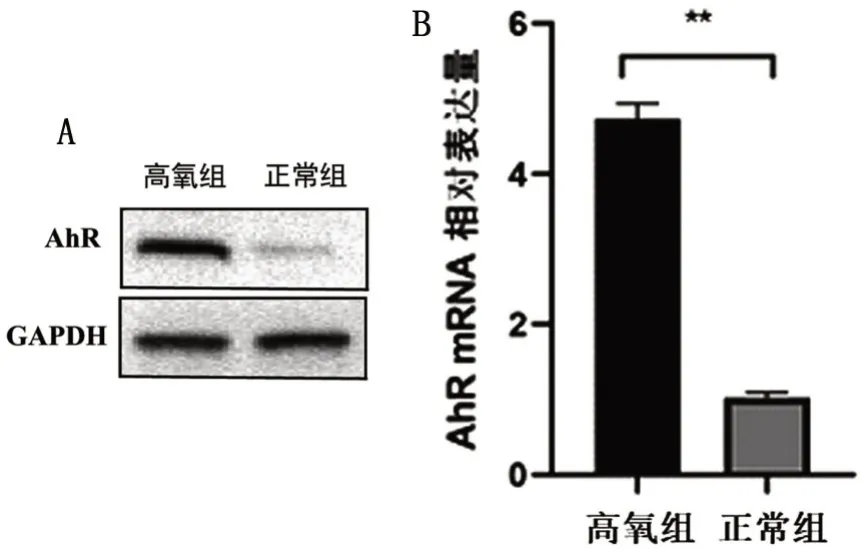
图3 高氧条件下AhR在MLE-12细胞的表达
2.4 AhR转染效率的测定
利用qPCR 技术检测si-AhR 组和si-NC 组MLE-12 细胞中AhR 的表达,结果显示,AhR 在si-NC 组表达为0.47±0.09,明显低于在si-AhR 组中表达(1.04±0.08)(t=8.199,P<0.001),见图4。
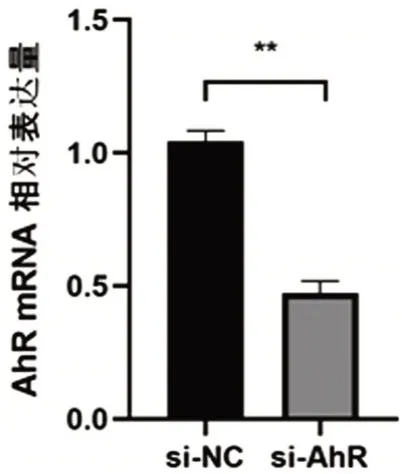
图4 AhR 转染效率的测定
2.5 AHR参与调控IL-33的表达
利用ELISA 检测IL-33 在si-AhR 组和si-NC 组MLE-12 细胞上清液的含量,结果显示,IL-33 在si-AhR组中表达为93.33±9.00,明显低于在si-NC组中的表达(166.70±22.00)(t=5.346,P=0.003),见图5A。通过qPCR 测定si-AhR 组和si-NC 组中IL-33的表达情况,结果显示,IL-33 在实验组表达为(1.00±0.05),明显低于在si-NC 中的表达(4.38±0.09),(t=56.862,P<0.001),见图5B。

图5 A&B AhR转染的MLE-12细胞中IL-33的表达
2.6 AhR激动实验的测定
通过Western blotting 检测AhR 激动试验中的AhR 表达水平,实验组的AhR 相对表达量为0.68±0.14,明显高于对照组的(0.32±0.10)(t=3.624,P=0.015),见图6。

图6 AhR激动效率的测定
2.7 AhR调控IL-33的表达
通过ELISA 检测AhR 激动试验中实验组和对照组细胞上清液中IL-33 的表达。结果显示,IL-33在实验组表达为(167.00±19.00),明显高于对照组的(265.70±12.00)(t=7.607,P=0.001),见图7。
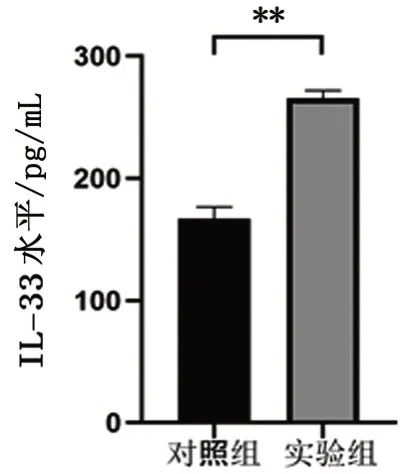
图7 IL-33在AhR激动的MLE-12细胞中的表达
3 讨论
BPD 作为一种临床上多见于早产儿的慢性肺部疾病,组织学上表现为氧含量异常条件下肺上皮受损和肺上皮的局部炎症[7]。有研究报道,BPD 患儿的血液和气管抽吸物中促炎细胞因子(IL-1、IL-6和IL-8)显著升高,提示炎症是BPD 的关键病理过程[8]。有研究表明,IL-33 作为白介素家族的一员,主要由肺上皮细胞中表达,并在肺部固有免疫和特异性免疫中发挥重要功能,尤其是在急性气道炎症中发挥重要作用[9]。
有文献表明,IL-33 参与炎症介质的表达,从而促进高氧所致的新生儿肺损伤的发展[10],且IL-33与支气管肺发育不良的严重程度成正相关[11]。同时,在BPD中IL-33是参与调控肺泡细胞凋亡和炎症反应的重要细胞因子[12-13]。本研究利用新生鼠高氧肺损伤模型来模拟新生儿支气管肺发育不良的病理过程,结果表明,IL-33 在新生鼠肺损伤过程中表达显著上调,这与前人研究结果相符,说明IL-33在高氧致肺损伤过程中发挥重要的作用。但IL-33作为一种分泌性的蛋白因子,在高氧损伤的肺上皮中调控其表达的机制仍不清晰。
作为Per-ARNT-Sim-basic helix-loop-helix 蛋白家族中的一员,AhR是一类高度保守的核受体,通过调控靶基因的表达和改变免疫分化过程,在一系列由免疫反应和炎症反应介导的疾病中均发挥重要的作用[14-15]。有研究表明[16],激活AhR 可以显著增加具有抗炎作用的Treg细胞的数量,同时降低有促炎功能的Th17细胞的数量。更有研究表明[17],AhR的激活可以抑制Th17 细胞的分化,同时抑制NLRP3 炎症小体的活性。芳香烃受体AhR 不仅参与调节炎症细胞的分化和募集,而且通过改变基因表达、细胞黏附、粘蛋白产生和细胞因子表达来影响肺的免疫应答[18]。研究表明[19],AhR 调控巨噬细胞分泌IL-10,从而抑制炎症反应的进行,说明AhR 通过调控炎症因子的表达介导炎症发生发展过程。研究表明[20],在巨噬细胞中,AhR 配体通过修饰IL-33启动子,从而上调IL-33的表达,使气道炎症进一步恶化。因此,推测在高氧损伤的肺上皮中,AhR可能参与调控IL-33的表达和分泌过程。本研究结果发现,在高氧刺激下,新生鼠肺组织中的AhR 上调明显。进一步探究AhR与IL-33在肺损伤过程中的调节关系,利用siRNA和AhR激动剂来处理小鼠肺上皮细胞系MLE-12,结果发现,与对照组相比,肺上皮细胞中AhR 参与调节IL-33 的表达,进一步说明在新生鼠肺损伤过程中,AhR通过调控炎症因子IL-33,调控肺损伤过程的发生与发展。
综上所述,AhR在新生鼠高氧肺损伤的肺组织中特异性高表达并与损伤程度成正相关,并主要参与调控IL-33 的表达,从而发挥一系列的生理功能。AhR 可能可作为评估新生儿高氧肺损伤的损伤程度的关键分子,也可能是药物治疗的潜在靶点。
