不同金属取代Finke型多金属氧酸盐显色检测多巴胺的催化性能
2021-07-13段喜鑫陈秀强柏智先李翔宇
段喜鑫,陈秀强,柏智先,李翔宇
(北华大学材料科学与工程学院,吉林 吉林 132013)
多巴胺(DA)是大脑中含量最丰富的儿茶酚胺类神经递质,为酪氨酸在代谢过程中经二羟苯丙氨酸产生的中间产物[1],在体内起着多种调节作用,影响着人的情绪,其代谢异常会引起帕金森综合征、阿尔茨海默病、癫痫等疾病,同时,DA作为药物还可以治疗缺血性、心源性及感染性休克,以及高血压和心脏病等[2-3].目前,DA检测方法(如电化学分析[4-8]、高效液相色谱法(HPLC)[9]和化学发光法[10]等)均涉及复杂的样品处理程序,且重现性较差.近年来,显色免疫分析逐渐受到关注.该方法无需昂贵的仪器,以及复杂的样品处理程序,成本低、实用性强,分析过程简便快捷,是一种通过肉眼即可观察到颜色变化的快速检测方法[11-15].
在显色免疫检测过程中,生物酶很容易受到外界环境的影响而变性,且制备、储存耗时长,价格昂贵,过程复杂.与天然酶相比,纳米材料具有更好的稳定性,其中,金纳米粒子在显色检测DA领域应用较为广泛[16-19],银纳米粒子[20]、氧化石墨烯[21]和金属氧化物[22]等纳米材料作为催化剂的研究也越来越受到关注.目前,已合成了多种具有过氧化物酶、氧化酶活性的纳米材料,如Fe3O4、CeO2、Co3O4等[23-25].但所开发的方法选择性较低,限制了在实际中的应用.多金属氧酸盐(Polyoxometalates,POMs)是一类具有氧化还原性能的金属氧簇化合物.通过调控多酸结构、取代金属种类和数目可获得不同氧化性的POMs.WANG等[26]首次报道了H3PW12O40的过氧化物酶活性,采用POMs/H2O2/TMB体系用于显色检测H2O2或者葡萄糖[27-28],之后该团队又制备了SiW10Fe2与叶酸复合的新型多酸催化剂,用于癌细胞和H2O2的显色检测[29].本研究采用不同金属调控多酸的氧化性,制备系列Finke型POMs催化剂——PW9M4(M为Co、Cu、Mn和Zn)和P2W15M4(M为Co、Cu和Zn),开发在水相中简单、快速、高选择性显色检测DA的催化体系,研究不同反应条件、干扰物质对显色检测的影响.
1 实验材料及方法
1.1 实验试剂及仪器
主要试剂有Na2WO4·2H2O、H3PO4、NH4Cl、KCl、Co(NO3)2、CuCl2、MnSO4、ZnCl2和盐酸多巴胺等,所有试剂均为分析纯.实验用水为去离子水.
FT-IR采用Shimadzu IR Affinity-1S,样品与KBr混合压片,测试范围为400~4 000 cm-1;通过X射线衍射(XRD)测定催化剂晶体结构,采用Rigaku公司的D/max-2500X型X射线衍射仪,辐射源为Cu-Kα,辐射波长为0.154 2 nm,管电压40.0 kV,管电流40 mA,测试角度10°~80°,步进角度为0.02°,扫描速度为5°/min;UV-Vis为Shimadzu UV-2700紫外-可见分光光度计.
1.2 催化剂制备
P2W15M4(M为Co、Cu和Zn)和PW9M4(M为Co、Cu、Mn和Zn)系列催化剂分别根据先前报道方法[30-31]合成.
1.3 实验过程
显色检测DA过程:将一定体积的PW9M4(1.25 mmol/L)或P2W15M4(2.5 mmol/L)分别与适量H2O2(100 mmol/L)溶于1 mL水中,将一定体积DA(8 mmol/L)加入上述的混合溶液中.混合溶液静置一段时间,用UV-Vis光谱在波长475 nm处测量溶液吸光度.
2 结果与讨论
2.1 PW9M4结构表征
PW9M4红外光谱见图1.由三缺位Dawson型多阴离子构筑的Finke型多酸阴离子IR谱图应在1 100~800 cm-1范围内有明显的特征吸收峰[31],所制备的多酸催化剂在1 080、985、887、807 cm-1处出现4个特征峰,分别归属磷氧振动(P-Oa)、钨氧振动(W-Od)和桥氧对称伸缩振动(W-Ob1-W、W-Ob2-W),证明PW9M4具有Finke型结构.催化剂的XRD见图2.由图2可见:2θ在8°、18°、28°和30°都出现了较为突出的X射线衍射峰,这与Finke型多酸化合物的衍射峰位置基本一致[31],再次证明合成的催化剂具有Finke型结构.

图1 PW9M4红外光谱Fig.1 FTIR spectra of PW9M4

图2 PW9M4的XRD谱 Fig.2 XRD patterns of PW9M4
2.2 P2W15M4结构表征
P2W15M4系列多酸催化剂的红外光谱见图3.由图3可见:在1 170、970、950、615 cm-1处均出现4个特征峰,分别归属磷氧振动(P-Oa)、钨氧振动(W-Od)和桥氧对称伸缩振动(W-Ob1-W、W-Ob2-W),与文献[30]报道一致,证明P2W15M4保持了Finke型结构.图4为P2W15M4的XRD谱图.由图4可见:合成的样品在2θ为7°、16°、18°和28°的4个特征峰与Finke型多酸化合物的衍射峰位置基本一致[30],与IR表征结果一致.

图3 P2W15M4红外光谱Fig.3 FTIR spectra of P2W15M4
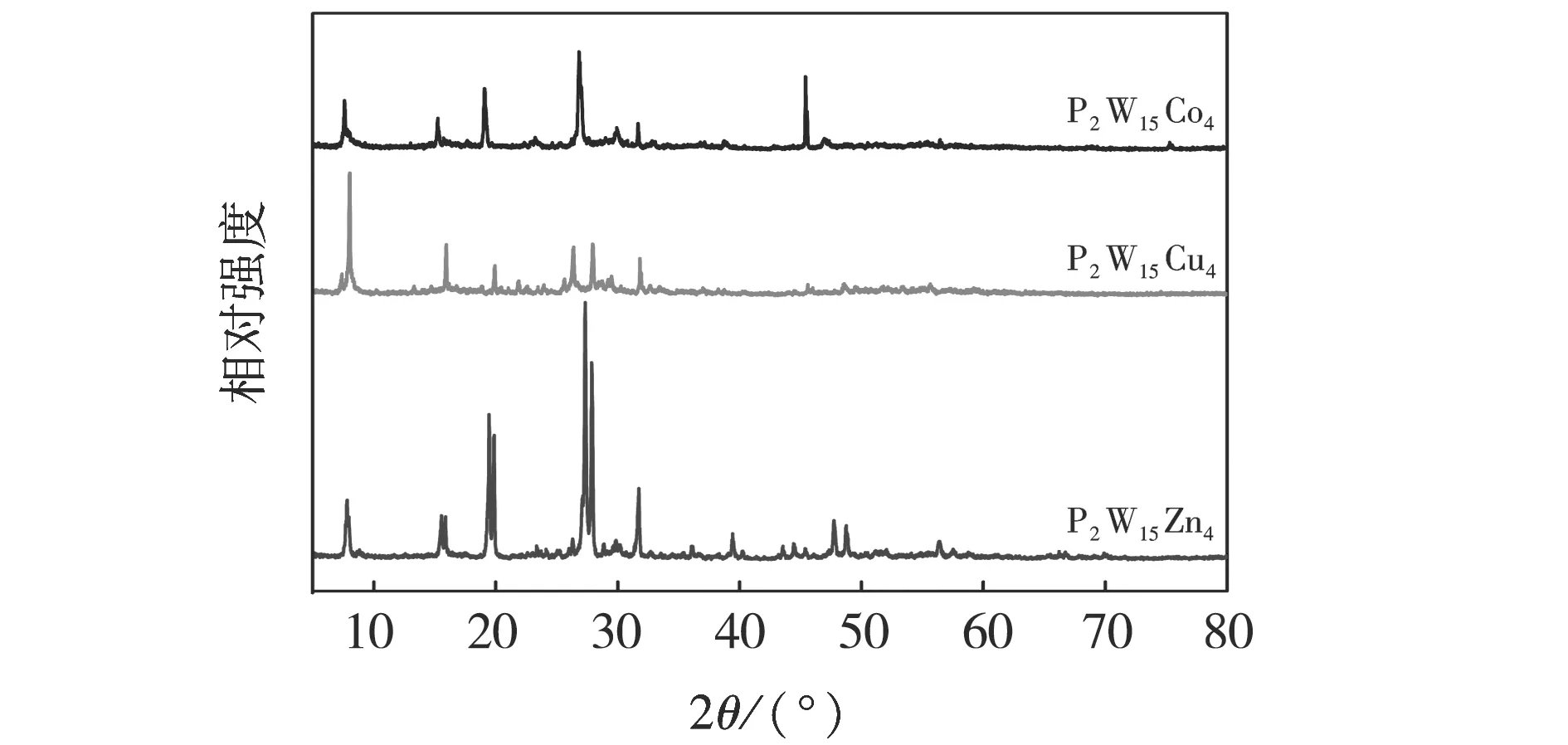
图4 P2W15M4的XRD谱Fig.4 XRD patterns of P2W15M4
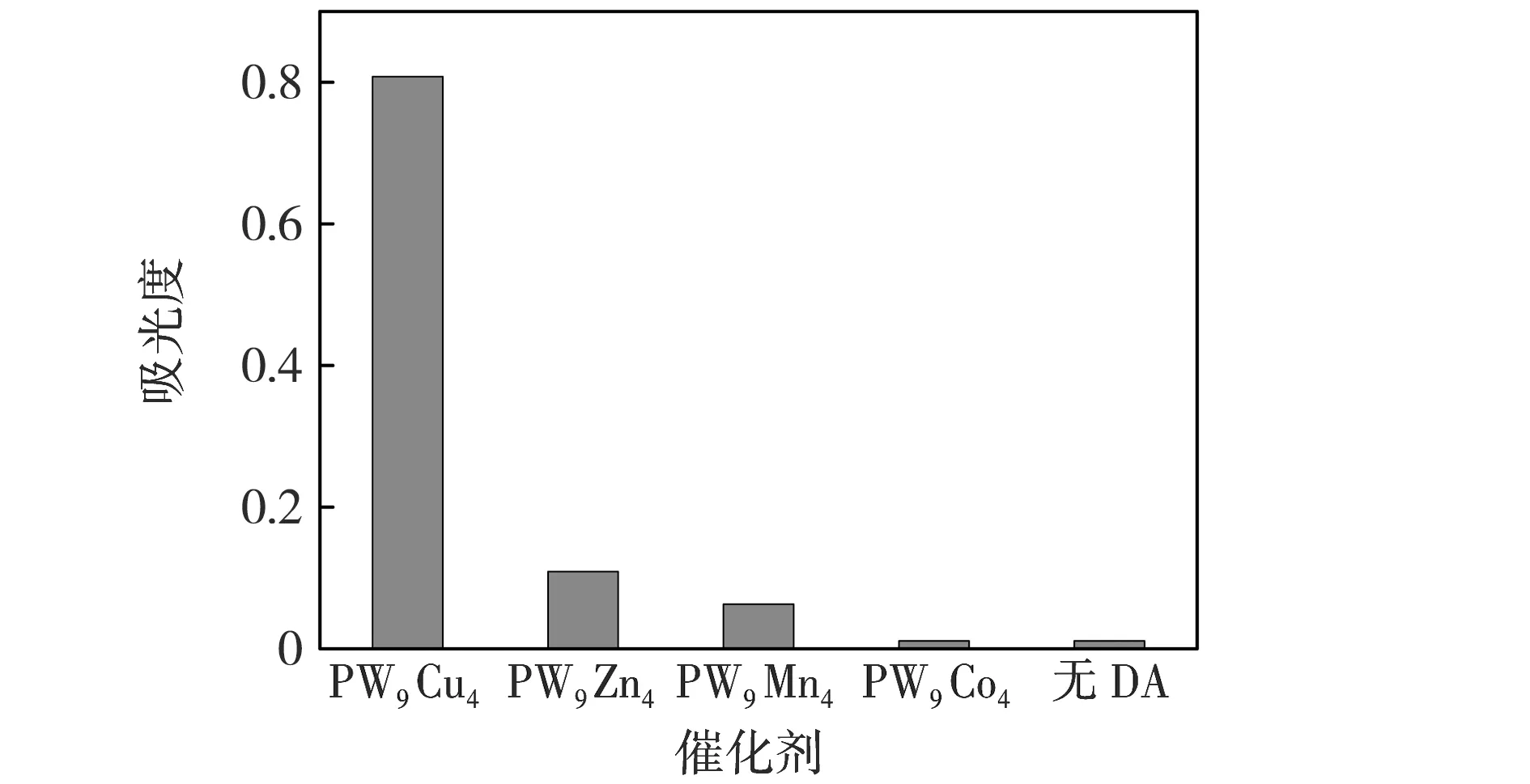
反应条件:200 μL PW9M4,80 μL DA,40 μL H2O2,15 min.图5 PW9M4显色检测DA结果 Fig.5 PW9M4 for the detection of DA
2.3 PW9M4显色检测DA性能
由于金属氧化性不同,PW9M4系列催化剂中取代金属种类对DA显色检测结果具有较大影响.PW9M4显色检测DA结果见图5.由图5可见:PW9M4活性顺序为PW9Cu4>PW9Co4>PW9Mn4>PW9Zn4,其中PW9Cu4显色检测DA的催化活性最好.图6为PW9Cu4显色检测DA颜色变化.由图6可见:没有加入PW9Cu4时,反应15 min溶液颜色为无色透明(图6 a);加入PW9Cu4显色15 min后,可看到溶液颜色为明显的橙红色(图6 b),这是由于H2O2可将DA氧化成橙红色的多巴胺醌类物质,其最大吸收波长位于475 nm,因此,可通过测定溶液在475 nm处的吸光度来检测DA的含量;当反应时间超15 min后,随着反应时间的延长,溶液颜色逐渐变为褐色(图6 c、6 d),这是因为橙色的胺基色素可以重新组合为5,6-二羟基吲哚(5,6-Dihydroxyindole,DHI),后者进一步被氧化为吲哚5,6-醌(Indole-5,6-quinone,IQ),最终产生深棕色神经黑色素.

反应条件:a.DA+H2O2,15 min;b.DA+PW9Cu4+H2O2,15 min;c.DA+PW9Cu4+H2O2,20 min;d.DA+PW9Cu4+H2O2,30 min.图6 PW9Cu4显色检测DA颜色 Fig.6 Detection of DA by PW9Cu4
图7 a为PW9Cu4用量对DA显色反应的影响.结果可见:PW9Cu4用量由120 μL增加至240 μL时,吸光度逐渐增大;PW9Cu4用量为200 μL时,吸光度达到最大值;继续增加PW9Cu4用量,吸光度反而减小,这是由于PW9Cu4的用量虽然增加了,但整个反应体系的H2O2用量保持不变,且随着PW9Cu4浓度增大,H2O2浓度降低,溶液吸光度下降.因此,选择200 μL作为催化剂的最佳用量.
图7 b为H2O2用量对显色反应的影响.结果可见:吸光度随H2O2用量增加而逐渐增大;当H2O2用量为40 μL时,吸光度达到最大值;继续增加H2O2用量,吸光度反而减小.虽然H2O2用量增大,但整个反应体系的PW9Cu4用量保持不变,且随着H2O2用量增大,单位体积内PW9Cu4活性中心减少,溶液吸光度下降.因此,选择40 μL作为H2O2的最佳用量.
图7 c为反应时间对显色反应的影响.结果可见:当反应时间为15 min时,吸收曲线峰形明显,吸光度达到最大值;继续增加反应时间,峰形发生变化,且吸光度增加很小,这主要是由于反应时间延长,橙色的胺基色素重新组合为DHI,后者进一步被氧化为褐色IQ,所以选择15 min为最佳反应时间.
在最佳反应条件下检测DA的线性范围和检出限,结果见图7 d.结果可见:当DA用量由5 μL增加至80 μL时,吸光度逐渐增加;DA用量为80 μL时,吸光度达到最大.DA的线性范围3.17×10-5~4.85×10-4mol/L,检出限为3.17×10-5mol/L.
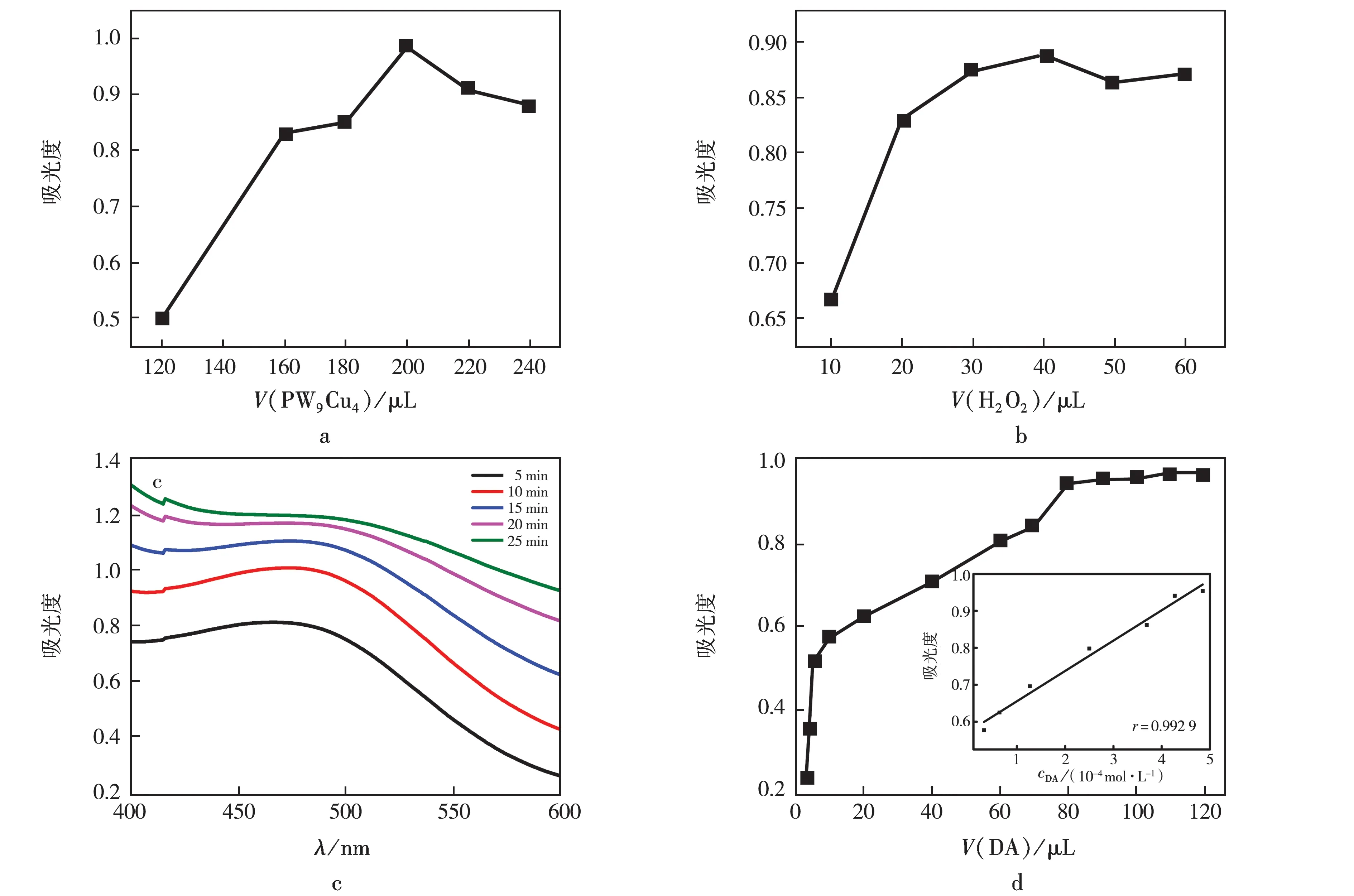
反应条件:a.80 μL DA,40 μL H2O2,15 min;b.200 μL PW9Cu4,80 μL DA,15 min;c.200 μL PW9Cu4,80 μL DA,40 μL H2O2;d.200 μL PW9Cu4,40 μL H2O2,15 min.图7 PW9Cu4显色检测DA的最佳检测条件Fig.7 Optimum reaction condition for colorimetric detection of DA by PW9Cu4
2.4 P2W15M4显色检测DA性能
在P2W15M4系列催化剂对DA显色检测性能测试中,仅有P2W15Cu4对DA具有显色检测效果.显色15 min,溶液颜色由无色变为明显的橙色(图8 b),随着显色时间的增加,溶液吸光度逐渐增加;反应时间增加至40 min,溶液颜色仍为稳定的橙色(图8 c),且溶液吸收光谱峰形没有发生变化(图9 c).文献[32]报道的SiW9Co3和本研究中使用的PW9Cu4催化剂最佳显色时间分别为10 min和15 min,P2W15Cu4显色检测DA的时间没有明显增长(15 min),且延长反应时间后,SiW9Co3和PW9Cu4显色的溶液颜色均呈现深褐色,不但吸收光谱峰形变差,而且吸光度变化不明显.P2W15Cu4在显色检测40 min时溶液颜色和峰形均没有发生明显变化,证明P2W15Cu4温和的氧化性对DA显色检测具有良好的显色稳定性.

反应条件:a.DA+H2O2,15 min;b.DA+P2W15Cu4+H2O2,15 min;c.DA+P2W15Cu4+H2O2,40 min;d.DA+P2W15Cu4+H2O2,60 min.图8 P2W15Cu4显色检测DA的颜色Fig.8 Photographs of detection of DA by P2W15Cu4
在P2W15Cu4显色检测DA性能测试中,研究了催化剂用量(图9 a)、H2O2用量(图9 b)、反应时间(图9 c)对DA显色反应的影响.结果表明:当DA用量为50 μL时,H2O2的最佳用量为140 μL,P2W15Cu4的最佳用量为200 μL,15 min为最佳反应时间.在最佳反应条件下,显色检测DA的线性范围和检出限见图9 d.结果显示:线性范围为3.68×10-5~2.96×10-4mol/L,检出限为3.68×10-5mol/L.上述结果表明:P2W15Cu4催化剂在中性介质中对显色检测DA具有较高的灵敏度.
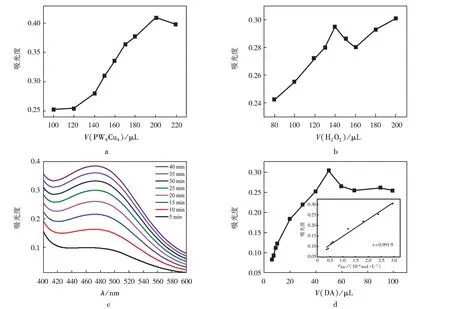
反应条件:a.200 μL P2W15Cu4,50 μL DA,15 min;b.50 μL DA,140 μL H2O2,15 min;c.200 μL P2W15Cu4,50 μL DA,140 μL H2O2;d.200 μL P2W15Cu4,140 μL H2O2,15 min.图9 P2W15Cu4显色检测DA的最佳检测条件Fig.9 Optimum detection condition for colorimetric detection of DA by P2W15Cu4
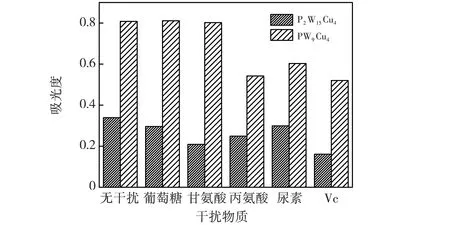
PW9Cu4显色检测DA反应条件:80 μL干扰 (8 mmol/L),200 μL PW9Cu4,80 μL DA,40 μL H2O2,显色时间15 min;P2W15Cu4显色检测DA反应条件:50 μL干扰 (8 mmol/L),200 μL P2W15Cu4,50 μL DA,140 μL H2O2,15 min.图10 干扰物质对显色检测的影响Fig.10 Effect of interferences on colorimetric detection of DA
2.5 干扰物质对多巴胺显色检测的影响
由于DA结构中存在氨基,而氨基是与催化剂发生显色的主要基团,为消除其结构对显色反应的影响,选择尿素、葡萄糖、丙氨酸、甘氨酸、Vc为干扰物质测试催化剂对DA显色检测的特异性,结果见图10.结果表明:干扰物质的加入没有导致溶液吸光度增高,干扰物质与多酸没有发生显色反应,说明两种催化剂对DA检测均具有特异性.
3 结 论
本次研究制备了不同金属取代的Finke型钨系多酸催化剂PW9M4(M为Co、Cu、Mn和Zn)和P2W15M4(M为Co、Cu和Zn),采用FT-IR和XRD表征催化剂结构,用UV-Vis定量检测DA.结果表明:PW9Cu4和P2W15Cu4显色检测DA的催化活性最好.干扰物质(如尿素、葡萄糖、丙氨酸、甘氨酸、Vc等)的加入没有使待测溶液吸光度增大,表明PW9Cu4和P2W15Cu4对DA显色检测具有特异性;PW9Cu4显色检测DA线性范围为3.17×10-5~4.85×10-4mol/L,检出限为3.17×10-5mol/L;P2W15Cu4显色检测DA线性范围为3.68×10-5~2.96×10-4mol/L,检出限为3.68×10-5mol/L,该催化剂具有更高的显色稳定性.综上所述,PW9Cu4和P2W15Cu4对显色检测DA具有较高灵敏度和选择性,显色反应可在中性介质中进行,分析过程简便快捷,具有潜在、广泛的应用价值.
