黄河口近海海草床浮游-底栖营养传递特征
2021-07-12李晓晓崔保山邵冬冬
李晓晓,杨 薇,2,*,孙 涛,2,崔保山,2,邵冬冬,2
1 北京师范大学环境学院,水环境模拟国家重点实验室, 北京 100875
2 黄河口湿地生态系统教育部野外科学观测研究站, 东营 257500
海草是生活于河口、海湾的潮间带和潮下带湿地的单子叶植物,常见于热带和温带海域的浅水水域,大面积分布的海草形成海草床[1]。对全球215项海草床研究分析显示[2],自1980年以来海草的退化速度为110 km2/a,且这种速度正在加快;已知的全球海草分布范围相比1879年已经消失了29%。我国已探寻的海草床总面积约为8765.1 hm2,当前也面临着严重威胁,如华南地区、山东半岛、莱州湾大面积的海草床衰退[3-5]。
生态系统以物种之间复杂的相互作用进行物质循环和能量流动[6]。探究系统内部的营养传递特征对于揭示该生态系统的营养结构和生态功能具有重要作用,是实现生态系统水平管理的基础[7]。目前常用的方法主要有胃含物分析、稳定同位素分析和生态模型分析等[8]。其中,稳定同位素混合模型的发展为定量化物种之间复杂的相互作用进一步提供科学支撑[9-10],近年来,稳定同位素混合模型已由较为简单的线性混合模型、IsoSource模型等发展到考虑数据的不确定性(标准差、营养富集系数)且适用于n个同位素和 >n+1种源的贝叶斯混合模型,如MixSIAR[11]和SIAR[12],引入了先验知识的概念,提高准确性。浮游-底栖(pelagic-benthic)营养传递的耦合表现为浮游生产者(如浮游植物)和底栖生产者(如水生植物、底栖藻类等)之间的能量、物质,以及营养向高营养级物种传递时两种不同能量流动路径的耦合[6,13-15]。这种耦合关系在水生生态系统中发挥着重要作用,促进了系统的能量循环和物质交换。现有研究多集中在探究湖泊食物网浮游-底栖能量耦合在富营养化下的响应,进而与湖泊生态修复相结合以系统的角度提供修复和保护的关键技术[16-17]。而浮游-底栖能流在滨海湿地海草床的耦合特征尚不清晰,难以从能量流动的系统角度对滨海湿地海草床的生态保护和修复提供科学指导。
本研究以黄河口近海海草床为研究案例,利用碳源和消费者功能群的碳氮稳定同位素和基于贝叶斯的稳定同位素混合模型,阐明海草床内消费者功能群的食源构成特征,定量化各消费者功能群的浮游和底栖的贡献比例,揭示该海草床浮游和底栖的营养传递特征和耦合模式,从系统性视角为海草床生态修复与保护提供科学支撑。
1 材料与方法
1.1 研究区概况
本研究选择黄河三角洲孤东海堤外侧的海草床(37°50′59″—37°51′10″N, 119°6′33″—119°6′43″ E)为研究区,该区域海草主要为日本鳗草(Zosterajaponica)。该研究区距黄河入海口较远,约20 km,受淡水入流和泥沙输运的影响较小。该区域海草在靠海侧分布比较密集,与互花米草(Spartinaalterniflora)在近岸侧存在混生区域。地表螺类、壳类等底栖动物较为丰富,包括中华拟蟹守螺(Cerithideasinensis)、秀丽织纹螺(Nassariusdealbatus)、日本镜蛤(Dosinorbisjaponica)、江户明樱蛤(Moerellajedoensis)等。该区域为暖温带气候,其年均气温为11.7—12.6℃,年均降雨量为530—630 mm,年均蒸发量为1750—2430 mm。潮汐为非规则半日潮和半日潮[18]。
1.2 样品采集及稳定同位素测定
于2017年7月10日—25日在研究区进行碳源和消费者功能群的采集。其中,碳源包括悬浮颗粒物、植物、表生藻类基质和浮游植物;消费者主要包括浮游动物、大型底栖动物和鱼。各要素的采集方法如下[19-21]:
水体悬浮颗粒物:使用有机玻璃采水器采集2 L表层水体,将水样通过200 μm的网以去除杂物,静置半小时后,取上清液用马弗炉燃烧过的0.45 μm Whatman GF/F玻璃纤维滤膜(450℃下燃烧6 h)抽滤,冰冻保存。
水生植物:手工采集水生植物(互花米草、海草),每个样品由10株植物的叶子混合而成,所有的样品用蒸馏水冲洗几次以除去附着的碎屑物。
表生藻类基质:在研究区石头、贝壳等表面小心刮取绿色部分。
浮游植物:使用有机玻璃采水器采集至少5 L表层水体,以确保足够稳定同位素的测定。将水样沿25号浮游生物采集网(网长50 cm,网圈内径20 cm,网目0.064 mm)中心倾倒,收集网内水体,用马弗炉燃烧过的0.45 μm Whatman GF/F玻璃纤维滤膜抽滤,冰冻保存。
浮游动物:使用有机玻璃采水器采集至少20 L表层水体,将采集的水体沿13号浮游生物采集网(网长50 cm,网圈内径20 cm,网目0.122 mm)中心倾倒,收集网内水体,用马弗炉燃烧过的0.45 μm Whatman GF/F玻璃纤维滤膜抽滤,冰冻保存。
大型底栖动物:采集33 cm × 30 cm × 20 cm采样框内的沉积物,就近取水对采集的样品经过初步淘洗、分拣,实验室内进一步细选,在显微镜下鉴定其种类。对于虾类,将其整个甲壳和头尾除去后,取肌肉。蟹类个体大的取大螯,个体较小的,去掉内脏,取腹部肌肉。对于端足类、多毛类、甲壳类等体积较小的取其全部个体。
鱼:在海草床的潮沟内选取适当位置放置地笼,于第二天收集地笼中的样品并记录鱼的种类、个数。对每一种鱼,选择大小相近的3个个体,从每个个体剥取其背部的肌肉组织。
共采集21个碳源样品和42个消费者样品。所有样品用1 mol/L 的盐酸酸化处理,以除去碳酸钙等碳酸盐影响,再用蒸馏水淋洗至中性,放入烘箱中60℃烘干(72 h),然后研磨成细粉末状。基于德国Thermo Fisher Scientific公司的稳定同位素质谱仪(DELTA V Advantage)测定碳氮稳定同位素含量。
稳定同位素含量采用稳定同位素比值的形式表示,采用相对测量法,将所测样品的同位素比值与相应的标准物质的同位素比值作比较,即δ13C和δ15N值:
(1)
(2)
式中,15N/14Natmosphere为标准大气氮同位素比值;13C/12CVPDB为国际标准物质VPDB的碳同位素比值。VPDB(Vienna PeedeeBelemnite)在美国国家标准和技术研究所提供的NBS- 19方解石为标准的条件下,其稳定性同位素比值是1.95‰。氮稳定性同位素分析标准为空气,其15N/14N值为(3676.5±8.1)×10-6。δ13C和δ15N值的测定精度分别为±<0.1‰和±<0.2‰。
基于氮稳定同位素确定消费者的营养级[9],其计算公式为:
TL消费者=(δ15N消费者-δ15N基线)/TEF +λ
(3)
式中,TL消费者指消费者的营养级;δ15N消费者和δ15N基线分别指消费者和基线的δ15N值,本研究中基线的δ15N值为浮游动物、腹足类和双壳类样品的平均δ15N值;λ为基线值对应的营养级,此处为2;TEF为相邻营养级同位素富集度,本研究采用3.4‰[9]。
1.3 稳定同位素混合模型
根据以往在渤海、长江口、其他海草生态系统等开展的胃含物分析或稳定同位素特征[20-27],确定捕食者与被捕食者之间的潜在食源关系。构建基于贝叶斯的稳定同位素混合模型(SIAR模型),利用模型输出消费者每个潜在食源的贡献比例范围,若食源贡献比例50%置信区间的下限大于5%,则该食源关系在本研究区成立。
SIAR模型采用马科夫链-蒙特卡洛模拟,利用狄利克雷先验分布产生消费者每个食源的贡献比例范围,模型运行次数设为50000次。参考国内外相关文献[9],确定氮的营养富集因子为(3.4±1.0)‰,碳的营养富集因子为(0.4±1.3)‰。模型主要结构如公式(4—7)。
(4)
(5)
(6)
piki[1],…,piki[Mi]~Dirichlet(αi1,…,αiMi)
(7)

1.4 消费者浮游、底栖碳源贡献比例
基于SIAR模型确定的消费者每个食物来源的贡献比例的均值,计算每个消费者的浮游碳源贡献比例和底栖碳源贡献比例,如下所示:
(8)
(9)
式中,PPj是消费者j的浮游碳源贡献比例,PPi是食源i的浮游碳源贡献比例,PBj是消费者j的底栖碳源贡献比例,PBi是食源i的底栖碳源贡献比例,Ωj为消费者j的所有食源,fij为SIAR模型确定的食源i对消费者j的食源贡献比例均值。对于每个消费者,PPj+PBj=1。
1.5 统计分析
利用单因素分析法(one-way ANOVA)分别分析该区域碳源、消费者功能群的δ13C和δ15N值是否有显著差异,并利用Turkey法对不同碳源和不同消费者功能群进行两两比较,在0.05水平上进行显著性分析。上述方法均通过SPSS 20.0进行。对消费者各功能群的浮游及底栖碳源贡献比例与其δ13C值的响应关系采用线性回归方法分析,利用Origin 2018进行线性回归拟合。
2 结果
2.1 海草床碳源和消费者功能群的碳氮稳定同位素值
黄河口近海海草床碳源的δ13C分布范围较广且呈现出显著性差异(表1,单因素方差分析,F4,20=99.94,P<0.001)。作为浮游碳源的浮游植物δ13C为(-22.26±1.07)‰ (平均值±标准差),显著低于其他碳源的δ13C值(P<0.001)。作为底栖碳源的海草、互花米草和表生藻类基质的δ13C平均值为(-12.75±1.28)‰,其中海草和互花米草的δ13C存在显著性差异(P=0.001),但表生藻类基质与其两者均不存在显著性差异(P>0.05)。悬浮颗粒物的δ13C为(-11.54±1.22)‰,与海草和表生藻类基质均没有显著性差异(P>0.05),且其δ13C与海草接近(分别为-11.54‰和-11.66‰)。主要原因可能是通过地表沉积物的再悬浮作用使得悬浮颗粒物的主要来源为海草和表生藻类基质的碎屑,因此本研究在分析浮游-底栖营养传递耦合时将悬浮颗粒物考虑为底栖营养传递路径。
该区域碳源的δ15N也存在显著性差异(表1,单因素方差分析,F4,20=7.29,P=0.002),从浮游植物的(2.5±0.04)‰到悬浮颗粒物的(5.3±1.2)‰。且浮游植物的δ15N值显著低于悬浮颗粒物(P=0.002),表生藻类基质(P=0.02)和互花米草(P=0.02)。

表1 黄河口近海海草床碳源的δ13C和δ15N值
黄河口近海海草床浮游-底栖碳源的δ13C值及其他水生态系统分析结果如表2所示,浮游碳源的δ13C值明显低于同区域底栖碳源的δ13C值。本研究区浮游碳源和底栖碳源的δ13C值差别约为10‰;东太湖两种碳源之间的差值较小,约为6‰,而Jurien湾海洋公园近岸水域和Superior湖两种碳源差值较高,分别约为15‰和14‰。
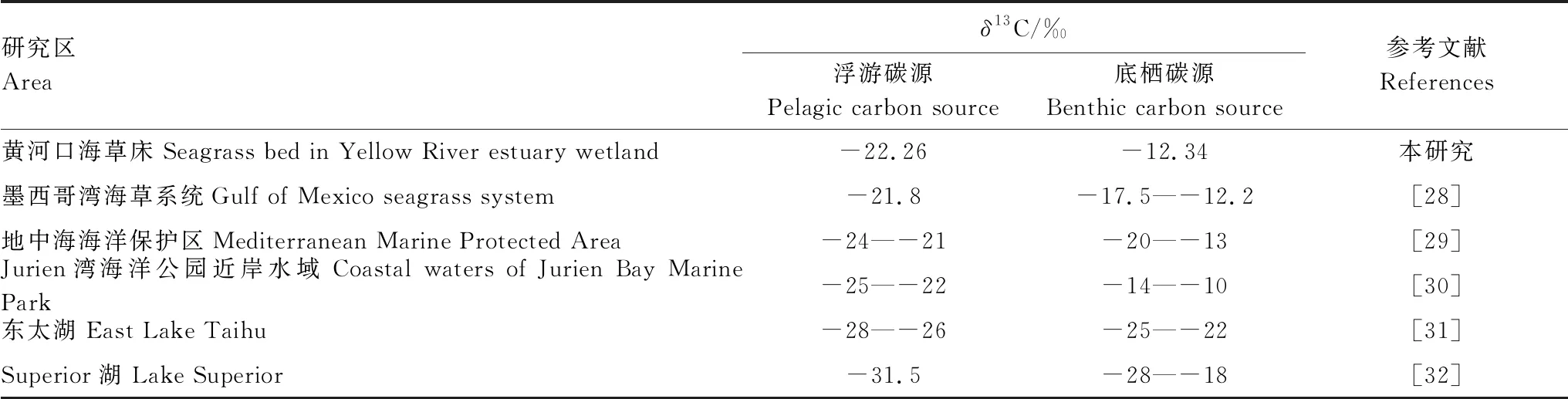
表2 浮游和底栖碳源的δ13C值差异
黄河口近海海草床消费者功能群的δ13C也呈现出显著性差异(表3,单因素方差分析,F9,41=11.11,P<0.001)。浮游动物的δ13C最低,为(-21.78±0.98)‰,与浮游植物最接近。大型底栖动物(包括腹足类、双壳类、蟹、多毛类、虾)的δ13C为(-14.19±2.49)‰,鱼(梭鱼、半滑舌鳎、沙逛鱼、鲈鱼)的δ13C为(-17.37±1.68)‰。腹足类的δ13C最高,为(-12.01±1.46)‰,与螃蟹和多毛类的δ13C没有显著性差异(P>0.05)。
消费者δ15N范围较广且存在着显著性差异(表3,单因素方差分析,F9,41=29,P<0.001)。浮游动物的δ15N显著低于其他消费者(P<0.05),以浮游动物、腹足类和双壳类的平均δ15N为基线时,浮游动物的营养级为1.49。大型底栖动物的δ15N值从双壳类((6.95±1.07)‰)到虾((10.42±2.34)‰),其营养级为2.23—3.25。鱼的δ15N分布范围从梭鱼((10.37±0.35)‰)到鲈鱼((13.65±0.52)‰),其营养级3.23—4.20。鲈鱼和沙逛鱼的δ15N显著高于大型底栖动物(P<0.05)。

表3 黄河口近海海草床消费者δ13C和δ15N比值和营养级
2.2 消费者功能群的食源组成
基于SIAR模型获得了消费者各功能群的潜在食源组成(图1)。由于SIAR模型输出的悬浮颗粒物对浮游动物食源贡献比例50%置信区间的下限<5%,因此本研究仅考虑浮游植物为浮游动物的食源。腹足类对海草具有较高的食源偏好(60%),且对表生藻类基质的食源偏好(22%)略高于对互花米草的食源偏好(18%)。双壳类的食源组成比较均一,由SPM(56%)和浮游植物构成(44%)。入侵的互花米草对螃蟹的食源贡献(28%)高于海草的贡献(16%)。该研究区捕食性多毛类物种所占比例较高,因此腹足类和双壳类对其食源贡献较高(均为28%)。虾对双壳类的食源偏好(31%)略高于其他潜在食源。消费者梭鱼的食源最为丰富且食源组成均一化(11%—17%)。半滑舌鳎、沙逛鱼和梭鱼的潜在食源均包括蟹和虾。

图1 基于SIAR模型的各消费者功能群的食源组成
2.3 浮游-底栖营养传递特征及与碳稳定同位素的关系
基于SIAR模型得到的消费者各功能群食源组成,定量化各个消费者功能群的浮游-底栖贡献比例。其中,浮游动物和腹足类分别属于浮游和底栖营养传递路径(图2),而其他消费者功能群共同依赖于两者。双壳类的底栖营养传递的贡献比例高于浮游贡献,分别为(65±26)%和(35±26)%。底栖食源对蟹和梭鱼的贡献比例最高,分别是85%和86%。浮游食源对虾的贡献比例最高(56%),其次为双壳类(44%)。多毛类、半滑舌鳎、沙逛鱼和鲈鱼的浮游、底栖贡献比例近似,约为30%和70%。

图2 黄河口近海海草床消费者功能群的浮游-底栖营养贡献比例

图3 黄河口近海海草床消费者功能群的浮游-底栖碳源贡献比例与其δ13C值的关系
考虑到浮游碳源和底栖碳源的δ13C值差异明显,我们对消费者各功能群的浮游-底栖碳源贡献比例与其δ13C值进行了线性回归拟合。结果表明,消费者的δ13C值随浮游碳源贡献的增加而逐渐较低,随底栖碳源贡献的增加而逐渐增加(图3)。这与两种碳源的δ13C值的分化现象一致。
3 讨论
本研究获取的黄河口近海海草床碳源和消费者功能群的δ13C的均值范围(-22.26‰—-11.54‰)与宋博等[33]于2018年8月测定的δ13C值均值范围(-21.99‰—-12.13‰)近似,可以较为准确地反映系统的营养结构。浮游碳源和底栖碳源的δ13C值差异显著(表2),主要由于作为浮游、底栖碳源的主要生产者的光合作用途径不同[34],同时也受到水环境扰动、光照和温度的影响。有研究[20]发现作为底栖碳源的陆生C4植物的δ13C值范围为-16‰—-7‰,而作为浮游碳源的温带海洋浮游植物的δ13C值范围为-18‰—-24‰。本研究的浮游碳源和底栖碳源的δ13C值均在上述范围内。
该研究区碳源和消费者功能群的δ15N的均值范围为2.49‰—13.65‰,其中消费者功能群范围为4.44‰—13.65‰。本研究发现鲈鱼的δ15N值是该区域所有消费者功能群的最大值,这与宋博等[33]发现的矛尾刺虾虎鱼的δ15N值(11.05‰)为最大值不同,但与在渤海湾研究发现的鲈鱼δ15N值最高(13.28‰)一致[35]。本研究以植食者(包括浮游动物、腹足类和双壳类)的平均值作为计算消费者营养级的基线,可以避免某一植食者δ15N值过低或过高对营养级估计的影响。该区域消费者的营养级范围为1.49—4.20,较高于宋博等[33]估计的营养级(2.00—3.85)。本研究结果发现,大型底栖动物基本上占据第二营养级,而大多数鱼类为第三或第四营养级,这与Mao等[19]的研究结果一致。
基于浮游-底栖营养传递的研究结果发现,黄河口近海海草床的消费者功能群主要分为三类:以浮游碳源为营养来源的浮游动物、以底栖碳源为营养来源的腹足类、以及共同依赖于浮游和底栖碳源的其余消费者功能群。与浮游、底栖碳源δ13C值的分化现象一致,本研究发现消费者功能群的δ13C值随浮游碳源贡献比例的增加相应的降低,反之增加。有研究[34]发现,由底栖碳源提供营养的消费者功能群的δ13C平均值比依赖于浮游碳源的消费者约富集5‰。因此,δ13C值可作为区分消费者营养来源的初步甄别指标[34,36]。例如通过对海草床栖息的鱼类和大型底栖动物的食性和δ13C值进行meta分析显示[34]:对于大型底栖动物,其依赖于浮游碳源的物种的δ13C值通常低于-18‰,其依赖于底栖碳源的物种的δ13C值通常高于-16‰;对于海草床栖息的鱼类,其依赖于浮游碳源的物种的δ13C值通常低于-15‰,其依赖于底栖碳源的物种的δ13C值通常高于-14‰。本研究中主要依赖于底栖碳源的消费者功能群的δ13C值也高于-16‰,如双壳类、腹足类、蟹、多毛类,而主要依赖浮游碳源的浮游动物和虾的δ13C值则低于-16‰。本研究区域的鱼类的δ13C值均低于-15‰,然而这些鱼类由底栖碳源的贡献比例高于浮游碳源的贡献。我们推测可能的原因是浮游营养传递途径的营养传递效率(Trophic transfer efficiency)高于底栖营养传递途径。如Lischke等[37]发现在浅水湖泊浮游营养传递的效率约高于底栖营养传递效率一个数量级。因此,后续开展基于碳流通量的生态系统能量流转研究,可加强对营养传递效率的定量化,以更全面解析该区域的浮游-底栖营养传递特征,为生态保护和修复提供更系统化的科学支撑。
4 结论
(1)黄河口近海海草床碳源和消费者功能群的碳氮稳定同位素含量均呈现显著性差异(P<0.05),浮游碳源的δ13C值(均值:-22.26‰)显著低于底栖碳源(均值:-12.34‰)。
(2)基于稳定同位素混合模型和浮游-底栖营养路径分析发现该区域浮游动物由浮游路径唯一提供营养来源,腹足类由底栖碳源提供唯一营养来源,其余消费者功能群共同依赖于两种营养传递路径。
(3)消费者功能群δ13C值随浮游营养贡献比例的增加而逐渐降低,且随底栖营养贡献比例的增加而逐渐增加,符合浮游和底栖碳源的δ13C值分化现象。
