6-BA 对火凤凰蝴蝶兰成花诱导的影响
2021-07-12赖思婷陈桦洁唐芸妃黄朝凤陈江萍吴日怡
赖思婷,丰 锋,陈桦洁,廖 菲,唐芸妃,黄朝凤,陈江萍,吴日怡
(广东海洋大学滨海农业学院,广东 湛江 524088)
【研究意义】蝴蝶兰(Phalaenopsisspp.)为兰科(Orchidaceae)蝴蝶兰属多年生草本植物,世界著名的珍贵花卉之一。蝴蝶兰以其美丽多姿、花朵造型独特深受各国人们喜爱,被誉为“洋兰皇后”[1]。蝴蝶兰在热带地区气候条件下自然花期为每年3~5月,为促进蝴蝶兰的开发利用,增大节假日对蝴蝶兰的需求量,尤其是春节等重要节假日用花,可通过人工调节和控制环境因子进行花期调控,实现按时按需供花[2]。蝴蝶兰花期调控一般采用高山低温以及空调制冷方法,但高山基地存在气候波动不稳定、上下山运输成本逐年增高等问题,因此,目前越来越多的从业者采用空调结合植物生长调节剂的方法进行催花[3]。【前人研究进展】金龙等[4]采用6-BA喷施蝴蝶兰叶片自上向下第2、3、4叶片节部位,结果表明大辣椒蝴蝶兰对植物生长调节剂较富乐夕阳敏感,促进其花芽分化的6-BA质量浓度为10、25 mg/L。刘晓荣等[5]采用6-BA喷施大花型线条花系2048蝴蝶兰植株叶片自上向下第2、3、4 叶片节部位的方法,结果发现10、25、50 mg/L 6-BA提高了蝴蝶兰抽梗率、双梗率和开花率,以25 mg/L为最佳浓度。陈凤玲等[6]在蝴蝶兰花芽分化前用GA3涂抹涂抹茎基部,结果表明150~200 mg/L处理可提前开花12~15 d;但小花的畸形率随着GA3质量浓度的提高也随之上升,加入等量IBA或IAA可减少花畸形的发生。国内学者研究使用6-BA和GA3灌根处理对春石斛花芽分化影响时发现,GA3灌根处理也可促进假鳞茎花芽发育,但效果不稳定。施用GA3时,质量浓度不宜超过20 mg/L,高浓度GA3会导致春石斛叶片脱落;使用6-BA灌根处理具有促进春石斛的花芽分化的作用[7-9]。陈昌铭[10]采用不同喷施方式发现,在杂交兰苗期促进花芽分化上,以低浓度6-BA喷施假鳞茎为佳;在促进花梗长度上,以低浓度GA3喷施叶面为宜。在植物生长调节剂其他处理方式和处理部位的研究方面,贵红霞[11]采用1% 6-BA涂抹兰花根系发现,该方式可促进产生不定芽进而萌发增加分枝;采用1% 6-BA涂抹秋海棠叶片,可使叶边产生不定芽,进而萌发形成新株茎枝。【本研究切入点】本试验采用不同质量浓度6-BA喷施处理火凤凰蝴蝶兰成苗,喷施后50 d内每隔10~15 d测定蝴蝶兰叶片可溶性糖、可溶性蛋白质含量以及POD、CAT活性等生理指标,且在抽出花梗后计算各处理抽梗率和双梗率,在抽出花蕾后测定形态指标,分析生理指标在不同6-BA浓度喷施处理下的变化,同时分析这些生理指标变化与形态指标的关联性。目前有关6-BA喷施处理对蝴蝶兰成花诱导影响的研究较多,而对火凤凰蝴蝶兰研究较少,同时也针对6-BA促进蝴蝶兰花芽分化的浓度因种类不同也会产生差异,本文以此为切入点,探讨6-BA喷施处理火凤凰蝴蝶兰成花诱导影响的同时找出促进花芽分化效果最适宜的喷施浓度,进一步研究和验证6-BA对于蝴蝶兰成花诱导作用。【拟解决的关键问题】分析火凤凰蝴蝶兰生理指标与形态指标之间的关联性,探讨6-BA对火凤凰蝴蝶兰成花诱导的影响,为蝴蝶兰催花措施的制定提供技术支撑。
1 材料与方法
1.1 试验材料
供试蝴蝶兰品种为火凤凰,成苗,购于佛山市顺德区陈村花卉世界。
1.2 试验方法
采用单因素随机区组试验设计,在人工空调控温条件下喷施6-BA,控温条件为日温20℃、夜温17 ℃,光照培养架培养(放置盆栽成苗火凤凰蝴蝶兰)。6-BA 质量浓度设5、10、15、20、25、30 mg/L 共6 个处理,以喷施清水为对照。每个处理18 株,共126 株。6-BA 采用小喷壶喷施,喷施部位为自上向下第2、3、4 叶片节部位,避免喷施到新叶导致伤害。花卉运回实验室后用清水灌溉缓苗,2019 年7 月28 日(缓苗4 d 后蝴蝶兰状态良好,均是未抽梗、生长情况一致的蝴蝶兰)进行6-BA 第1 次喷施处理,然后分别在第1 次处理后10、20 d 进行第2、第3 次处理,共喷施3 次。各处理温度、光照、肥水用量等其他裁培管理措施一致。每株蝴蝶兰每隔10 d 浇入100 mL花宝2号(N ∶P ∶K=20 ∶20 ∶20)1 000 倍+磷酸氢二钾(K2HPO4)500 倍混合液。
1.3 测定项目及方法
试验开始后,每隔10 d调查1次抽梗率,至80 d结束调查。
在蝴蝶兰植株抽出花梗后计算抽梗率和双梗率,在蝴蝶兰植株抽出花蕾之后测定花梗长度、处理到抽梗的时间间隔、花径、花蕾数量。
试验后每隔10~15 d 取样1 次,每次测定随机取样每个处理2 株,剪取植株自上而下第2 片叶,用以测定生理指标,结束测定时间为试验后50 d(此时绝大多数植株已经抽梗)。其中,可溶性糖含量采用蒽酮比色法[12]测定;可溶性蛋白质含量采用考马斯亮蓝法[13]测定;CAT 活性的测定参考Torres 等(2003)的方法稍做改动;POD 活性的测定参考Polle 等(1994)的愈创木酚法并加以改进。
试验数据的处理分析采用 SPSS 19.0,采用Duncan多重比较法进行方差分析、采用SPSS 和Excel 2010 进行数据统计分析。
2 结果与分析
2.1 6-BA 对火凤凰蝴蝶兰形态指标的影响
由表1 可知,25 mg/L 6-BA 处理后30 d,蝴蝶兰植株抽梗率为80%,高于清水对照植株的抽梗率11.76%及5 mg/L 6-BA 处理植株的抽梗率5.88%;每个6-BA 浓度处理后30~60 d,植株抽梗率稳步增长;10~30 mg/L 6-BA 处理后60 d,植株均100%抽梗;清水对照植株在70 d 全部抽梗;而5 mg/L 6-BA 处理植株抽梗速度最慢,在处理后80 d 才达到100%抽梗;30 mg/L 6-BA处理植株双梗率达到17.65%。推测10~30 mg/L 6-BA 喷施处理能显著加快火凤凰蝴蝶兰花芽分化速度。
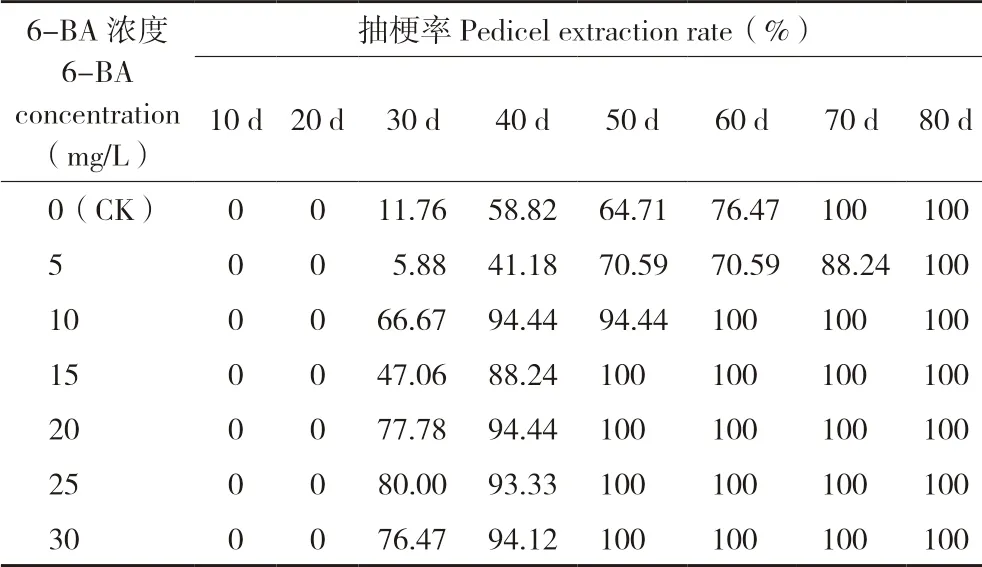
表1 6-BA 对火凤凰蝴蝶兰抽梗率的影响Table 1 Effect of 6-BA on pedicel extraction rate of ‘Huofenghuang’ butterfly orchid
由表2 可知,10 mg/L 6-BA 处理植株的花梗长度为46.33 cm,显著高于15 mg/L 6-BA 处理植株的花梗长度40.61 cm,其他处理间无显著差异。10~30 mg/L 6-BA 处理植株在29~32 d 抽出花梗,显著低于清水处理植株的44.47 d 和5 mg/L 6-BA处理植株的47.41 d。不同6-BA 喷施处理植株花朵直径没有显著差异,集中在11 cm 左右。不同6-BA 处理下,植株花蕾数没有显著差异,集中在5 朵左右。推测6-BA 处理对于火凤凰蝴蝶兰的花梗长度、花朵直径、花蕾数目没有显著影响。

表2 6-BA 对火凤凰蝴蝶兰形态指标的影响Table 2 Effect of 6-BA on morphology index of ‘Huofenghuang’ butterfly orchid
2.2 6-BA 对火凤凰蝴蝶兰叶片可溶性糖含量的影响
由表3 可知,20、25 mg/L 6-BA 喷施处理后30 d 植株叶片可溶性糖含量达到最大值(21.27、19.93 mg/g),显著高于其他处理;喷施处理后30 d 植株进行抽梗,消耗大量可溶性糖,因此呈现下降趋势。5~15 mg/L、30 mg/L 6-BA 处理植株叶片可溶性糖含量在处理后40 d 达最大,喷施处理后40 d 植株进行抽梗。无论是在喷施处理后30 d 还是40 d 可溶性糖含量达到最大值,这都与形态观察结果一致,这时有花芽出现,推测在蝴蝶兰抽梗之前叶片积累大量可溶性糖,因此蝴蝶兰叶片中的可溶性糖含量呈现上升趋势;随着花芽发生、发育和花梗抽生,蝴蝶兰抽梗之后可溶性糖大量输出到花梗中,因此叶片可溶性糖含量在蝴蝶兰抽梗之后呈现下降趋势。从可溶性糖含量的变化可以看出,喷施处理后30 d,20、25 mg/L 6-BA 处理的植株叶片可溶性糖含量高于其他处理,而这两个处理的抽梗率也最高,分别达77.78%和80%。由此推测,在抽出花梗时期蝴蝶兰叶片较高的可溶性糖可能会提高蝴蝶兰抽梗率。

表3 6-BA 对火凤凰蝴蝶兰叶片可溶性糖含量的影响Table 3 Effect of 6-BA on soluble sugar content in ‘Huofenghuang’ butterfly orchid leaves
2.3 6-BA 对火凤凰蝴蝶兰叶片可溶性蛋白质含量的影响
由表4 可知,25~30 mg/L 6-BA 处理蝴蝶兰植株叶片可溶性蛋白质含量在喷施处理后30 d 大幅下降,其余处理植株叶片可溶性蛋白质含量在处理后40 d 降到最小值,这与形态观察结果一致,这时各处理有花芽出现,推测可能是叶片为花芽分化做物质准备而消耗大量可溶性蛋白质;喷施处理后50 d,所有处理可溶性蛋白质含量又趋于上升,在蝴蝶兰抽梗后做好营养物质供应保证。从可溶性蛋白质含量的变化可以看出,在喷施处理后30 d,清水对照、5 mg/L 6-BA 处理植株叶片可溶性蛋白质含量高于其他处理,而这两个处理的抽梗率也是最低的(分别是11.76%、5.88%)。推测在抽出花梗时期蝴蝶兰叶片较高的可溶性蛋白质可能会降低蝴蝶兰的抽梗率。

表4 6-BA 对火凤凰蝴蝶兰叶片可溶性蛋白质含量的影响Table 4 Effect of 6-BA on soluble protein content in ‘Huofenghuang’ butterfly orchid leaves
2.4 6-BA 对火凤凰蝴蝶兰叶片CAT 活性的影响
由表5 可知,在各处理蝴蝶兰抽梗之前的30 d 植株叶片CAT 活性都呈现上升趋势,这与形态观察结果一致,这时有花芽还未出现,CAT活性的上升是为抽出花梗做准备,在喷施处理后30~40 d,清水对照、5 mg/L 6-BA 处理植株叶片的CAT 活性呈现上升趋势,可能是因为这两个处理抽出花梗较慢、在为抽出花梗做准备,所以植株叶片CAT 活性一直维持在上升趋势;蝴蝶兰抽梗后30~40 d,10~30 mg/L 6-BA 处理植株叶片CAT 活性呈现下降趋势,这与形态观察结果一致,这时有花芽出现,植株体内氧自由基减少,有利于蝴蝶兰花芽分化,进行抽梗;推测蝴蝶兰叶片CAT 活性较低时,有利于花梗抽出。从CAT 活性变化可以看出,喷施处理后30 d,20~30 mg/L 6-BA 处理植株叶片CAT 活性高于其他处理,而这3 个处理抽梗率最高,分别为77.78%、80%、76.47% ;推测在抽出花梗时期蝴蝶兰叶片较高CAT 活性可能会提高蝴蝶兰的抽梗率。

表5 6-BA 对火凤凰蝴蝶兰叶片CAT 活性的影响Table 5 Effect of 6-BA on CAT activity in Phalaenopsis amabilis leaves
2.5 6-BA 对火凤凰蝴蝶兰叶片POD 活性的影响
由表6 可知,各处理蝴蝶兰植株叶片在整个过程中POD 活性均有一定差异,但不同处理间差异未达显著水平。在喷施处理后的15~30 d,除清水对照、5 mg/L 6-BA 处理植株叶片POD 活性变化较平缓外,其他处理蝴蝶兰叶片POD 活性均处于上升趋势,这与形态观察结果一致,此时有些花芽未出现,仍处于营养积累阶段,为抽梗做准备。喷施处理后30~50 d,蝴蝶兰叶片POD 活性呈现两种变化:第一种是上升-下降,表明蝴蝶兰处于营养继续积累阶段,植株叶片POD 活性下降的过程就是花梗抽出(处理后40 d)的过程;第二种是下降-上升,花梗抽出(处理后30 d)的过程中,POD 活性下降,之后上升,是蝴蝶兰抽出花梗后进入缓慢生长的阶段,即叶片POD 活性处于上升阶段。总之,叶片较低POD 活性有利于花梗抽出,当进行比较缓慢的营养生长阶段时叶片POD 活性较高。对30 mg/L 6-BA 处理蝴蝶兰叶片POD 活性一直处于上升过程的原因,目前尚不清楚,需要进一步深入研究。从蝴蝶兰叶片POD 活性的变化可以看出,喷施处理后30 d,清水对照、5 mg/L 6-BA 处理植株POD 活性低于其他处理,而这两个处理的抽梗率也最低(11.76%、5.88%),推测在抽出花梗时期蝴蝶兰叶片较低的POD 活性可能会降低其抽梗率。

表6 6-BA 对火凤凰蝴蝶兰叶片POD 活性的影响Table 6 Effect of 6-BA on POD activity in Phalaenopsis amabilis leaves
3 讨论
本试验结果表明,用25 mg/L 6-BA 处理火凤凰蝴蝶兰后30 d,抽梗率高达80.00%,而清水对照植株药后30 d 的抽梗率仅为11.76%,这与金龙等“10 mg/L 6-BA 处理大辣椒蝴蝶兰能显著增加花芽分化速度、促进花芽分化”的结论[4]有差别。由于蝴蝶兰品种不同,生长特性及内源激素变化也不同,导致不同浓度6-BA 促进蝴蝶兰花芽分化的程度可能存在差异,这方面还要扩大品种范围进一步试验。我们发现,不同质量浓度6-BA处理火凤凰蝴蝶兰,植株花梗长度、花朵直径、花蕾数无明显差异,这与黄建等“一定浓度6-BA 处理能在一定程度上增加蝴蝶兰的花蕾数”的结论[14]不一致,而与吕秉韬等提出的“不同浓度6-BA 处理对不同品种的蝴蝶兰花朵数和花朵直径有不同的效果”[15]大致相同。在本试验中,10~20 mg/L 6-BA 处理植株的双梗率均为5.56%,30 mg/L 6-BA 处理植株双梗率为17.65%。关于蝴蝶兰双梗率是否随着6-BA质量浓度增大而提高,还需要进一步试验探讨,针对李奥等[16]提出的“不同浓度 6-BA 明显提高了供试3 个品种蝴蝶兰的双梗率,其中金桔和双霞的最适处理浓度为100 mg/L,而‘富乐夕阳’的最适浓度为200 mg/L”的结论,还需进一步进行质量浓度的筛选。关于在人工空调培养的同时喷施6-BA,低温和6-BA这两个因素是哪个因素促进了蝴蝶兰表型和生理指标的变化这个问题,我们在实验方案过程中设置了在同等条件的人工空调培养的蝴蝶兰植株作为对照,因此可以确定蝴蝶兰表型和生理指标发生改变是由喷施6-BA 所致。
生理指标测定方面,我们推测在蝴蝶兰抽梗之前叶片积累大量可溶性糖,这与黄胜琴等[17]在低温条件下对蝴蝶兰进行花芽诱导所得出的结论相一致。火凤凰蝴蝶兰抽出花梗时,叶片为花芽分化做物质准备而消耗了大量可溶性蛋白质,说明花芽分化消耗了一定量的可溶性蛋白质,这与彭芳等“花器官分化开始前,花芽中可溶性蛋白质含量先逐渐下降,之后再逐渐增加并达到最高水平(花萼原基分化期),这可能是花芽萌出前,一些蛋白质水解酶活性增强,使组合蛋白分解成可溶性蛋白质,或形成特异结构和功能蛋白以满足花芽的形态建成”的结论[18]相一致。
同时,我们发现喷施6-BA 处理后40 d、50 d,各处理蝴蝶兰植株的生理指标都显示出恢复到差异不显著阶段以及各指标之间差距减小的状态,这可能与蝴蝶兰最后测定的形态指标(如花梗长度、花朵直径、花蕾数)差异不显著有一定关系。针对30 mg/L 6-BA 处理植株的双梗率达到最大,还需进一步深入研究生理指标与双梗率之间的关系。本研究仅对较易催花的蝴蝶兰品种火凤凰进行了试验研究,为其他品种蝴蝶兰的催花提供了参考。
4 结论
25 mg/L 6-BA 喷施处理火凤凰蝴蝶兰后30 d,抽梗率为80.00%,清水处理抽梗率仅为11.76%,10~30 mg/L 6-BA 喷施处理蝴蝶兰后40 d抽梗率超过90.00%,喷施处理50 d 后全部抽梗;25~30 mg/L 6-BA 处理到抽梗天数为29 d,显著低于清水对照的44 d。与形态观察相一致的是,花芽未抽出时(即蝴蝶兰抽梗前)叶片可溶性蛋白质含量最低、可溶性糖含量最高;花芽抽出时,蝴蝶兰叶片CAT、POD 活性逐渐下降。推测在抽出花梗时期,蝴蝶兰叶片较高的可溶性糖含量、CAT 活性会提高抽梗率;抽出花梗时期,蝴蝶兰较高的可溶性蛋白质含量、较低的POD 活性会降低抽梗率;抽出花梗后,各生理指标差异不显著以及差异减少导致各处理间花梗长度、花朵直径、花蕾数差异不显著。
