染料木素对人鼻咽癌CNE1细胞生长的抑制作用及靶点预测
2021-07-11何文栋苏雯清韦坤华奎玲王硕龚小妹杨晓男缪剑华
何文栋 苏雯清 韦坤华 奎玲 王硕 龚小妹 杨晓男 缪剑华

中图分类号 R285 文献标志码 A 文章编号 1001-0408(2021)10-1196-09
DOI 10.6039/j.issn.1001-0408.2021.10.07
摘 要 目的:研究染料木素对人鼻咽癌CNE1细胞生长的抑制作用并预测其可能的作用靶点。方法:采用CCK-8法检测0(空白对照)、12.5、25、50、100、150 ?mol/L染料木素分别作用24、48、72 h对CNE1细胞增殖的影响;分别采用流式细胞术检测0(空白对照)、15、30、60 ?mol/L染料木素作用24 h对CNE1细胞周期、凋亡的影响;采用划痕实验检测0(空白对照)、10、20、30 ?mol/L染料木素作用24 h对CNE1细胞迁移能力的影响。采用高通量测序法挖掘0(空白对照)、30 ?mol/L染料木素作用24 h后CNE1細胞中的差异基因,并通过实时荧光定量-聚合酶链式反应法(RT-qPCR)对上述细胞实验相关差异基因mRNA的表达情况进行验证。结果:与空白对照比较,12.5、25、50、100、150 ?mol/L染料木素对细胞的增殖均有显著的抑制作用(P<0.01),且呈浓度-时间-效应趋势;15、30 ?mol/L染料木素可使细胞周期阻滞于G0/G1期(P<0.05或P<0.01),30、60 ?mol/L染料木素可使细胞周期阻滞于G2/M期并显著促进其凋亡(P<0.05或P<0.01);10、20、30 ?mol/L染料木素可显著抑制细胞的迁移能力(P<0.01)。高通量测序共挖掘出2 271个差异基因(padj<0.05),其中1 154个基因上调、1 117个基因下调;结合细胞实验结果共筛选出p53、p21、STC2、FGF2、CDK6、CYCLIN D、PI3K、AKT等8个潜在靶点差异基因。经RT-qPCR法验证,其中p53、p21、STC2、FGF2、CDK6、CYCLIN D、AKT等7个潜在靶点差异基因mRNA的表达均显著下调(P<0.05),与转录组测序结果基本一致。结论:染料木素能有效抑制人鼻咽癌CNE1细胞的生长;其抗鼻咽癌机制可能与抑制突变型p53基因的表达,恢复野生型P53蛋白功能以及抑制磷脂酰肌醇3激酶/蛋白激酶B通路的活性有关。
关键词 染料木素;人鼻咽癌CNE1细胞;高通量测序;突变型p53基因;磷脂酰肌醇3激酶/蛋白激酶B通路
Inhibitory Effect and Target Prediction of Genistein on the Growth of Human Nasopharyngeal Carcinoma CNE1 Cells
HE Wendong1,SU Wenqing2,WEI Kunhua3,4,KUI Ling5,WANG Shuo6,GONG Xiaomei6,YANG Xiaonan3,4,MIAO Jianhua1,2,3,4,6(1. Pharmacy College, Guangxi University of TCM, Nanning 530200, China;2. Pharmacy College, Guangxi Medical University, Nanning 530021, China; 3. Guangxi Key Laboratory of Medicinal Resources Protection and Genetic Improvement, Guangxi Botanical Garden of Medicinal Plants, Nanning 530023, China; 4. Guangxi Engineering Research Center of TCM Resource Intelligence Creation, Guangxi Botanical Garden of Medicinal Plants, Nanning 530023, China; 5. Pharmacy College, Jiangsu University, Jiangsu Zhengjiang 212013, China; 6. National Engineering Laboratory of Southwest Endangered Medicinal Resources Development, Guangxi Botanical Garden of Medicinal Plants, Nanning 530023, China)
ABSTRACT OBJECTIVE: To study the inhibitory effects of genistein on the growth of human nasopharyngeal carcinoma. CNE1 cells and predict its potential target. METHODS: CCK-8 method was used to test the effects of 0(blank control), 12.5, 25, 50, 100, 150 ?mol/L genistein on the proliferation of CNE1 cells after treated for 24, 48, 72 h. Flow cytometry was carried out to detect the effects of 0(blank control), 15, 30, 60 ?mol/L genistein on the cell cycle and apoptosis of CNE1 cells after treated for 24 h. Scratch test was used to investigate the effects of 0(blank control), 10, 20, 30 ?mol/L genistein on the migration ability of CNE1 cells after treated for 24 h. High throughput sequencing was conducted to discover the differential genes in CNE1 cells after treated with 0 (blank control), 30 ?mol/L genistein for 24 h. RT-qPCR assay was adopted to verify the mRNA expression of related differential genes in above trials. RESULTS: Compared with blank control,12.5, 25, 50, 100, 150 ?mol/L genistein showed significant inhibitory effect on the proliferation of CNE1 cells (P<0.01), in a concentration- time-effect manner;15, 30 ?mol/L genistein could arrest CNE1 cell cycle at G0/G1 stage (P<0.05 or P<0.01); 30, 60 ?mol/L could arrest CNE1 cell cycle at G2/M stage and promoted cell apoptosis (P<0.05 or P<0.01). 10, 20, 30 ?mol/L genistein could significantly inhibit the migration ability of CNE1 cells (padj<0.01). High throughput sequencing revealed a total of 2 271 differentialgenes (P<0.05), 1 154 of which were up-regulated while 1 117 of which were down-regulated; 8 potential target genes, including p53, p21, STC2, FGF2, CDK6, CYCLIN D, PI3K, AKT, were screened by cell experiment. After validated by RT-qPCR assay, mRNA expression of p53, p21, STC2, FGF2, CDK6, CYCLIN D and AKT were significantly down-regulated (P<0.05), which consistent with the sequencing results. CONCLUSIONS: Genistein can effectively inhibit the growth of human nasopharyngeal carcinoma CNE1 cells, the mechanism of which may associated with inhibiting the expression of mutant gene p53, restoring the function of wild-type P53 protein and inhibiting the activity of PI3K/Akt pathway.
KEYWORDS Genistein; Human nasopharyngeal carcinoma CNE1 cells; High throughput sequencing; Mutant gene p53; PI3K/Akt pathway
染料木素又称染料木黄酮、金雀异黄酮,分子式为C15H10O5,化学名为4′,5,7-三羟基异黄酮,为淡黄至浅褐色粉末,溶于二甲基亚砜和乙醇,是一种天然的异黄酮类化合,存在于千斤拔、淡豆豉、鸡血藤等多种天然药物中,其结构与动物雌激素雌二醇相似,故有植物雌激素之称[1-3]。现代药理研究表明,染料木素具有清除自由基、抗氧化、保护心脑血管系统、预防动脉粥样硬化、防治阿尔茨海默病等多种作用[4-7]。除此之外,染料木素还因具有显著的抗肿瘤作用而备受关注,如其对乳腺癌、肺癌、肝癌、结肠癌、前列腺癌、口腔癌、喉癌、甲状腺癌等多种癌症均有抑制作用[8-15]。
鼻咽癌是发病率最高的头颈部恶性肿瘤,其发病地区主要集中在我国广东、广西、福建等南部地区以及东南亚地区,具有显著的地域性特征[16]。鼻咽癌的发生主要是因为感染了EB病毒,我国2014年鼻咽癌每十万人口的发病率和死亡率分别为3.26和1.77,显著高于世界平均水平[17]。由于鼻咽癌发病部位深,且与众多重要器官相近,难以手术切除,放、化疗依然是鼻咽癌的主要治疗手段,但其具有较强的副作用,临床治療效果有限[18]。据相关研究表明,染料木素对雌、雄大鼠均无生殖毒性,无致畸性,且对子代大鼠生长、发育的毒性较小,安全耐受,是一种安全性较高的抗肿瘤药物[19-22]。
高通量测序可以准确分析出肿瘤细胞和组织在基因组和转录组水平上的基因图谱,进而为不同癌症的治疗提供更准确的靶点信息[23]。鉴于此,本研究拟以人鼻咽癌CNE1细胞为模型,通过CCK-8实验、流式细胞术、细胞划痕实验等方法考察染料木素对CNE1细胞增殖、细胞周期、凋亡和迁移能力的影响,并与高通量测序相结合,初步考察染料木素抗鼻咽癌的作用及其潜在靶点,再采用实时荧光定量-聚合酶链式反应法(RT-qPCR)验证潜在靶点mRNA的表达情况,为染料木素在抗鼻咽癌领域的进一步研究、利用提供参考。
1 材料
1.1 主要仪器
M200 Pro型多功能酶标仪购自瑞士Tecan公司;GNP-980型恒温细胞培养箱购自上海精密仪器仪表公司;guava easyCyte型流式细胞仪购自默克化工技术(上海)有限公司;IX73型显微镜购自日本Olympus公司;T100型PCR仪购自美国Bio-Rad公司;QuantStudio 3型RT-qPCR仪购自美国Thermo Fisher Scientific公司;BGIDL-50型全自动样品加载系统、BGISEQ-500RS型基因测序仪均购自深圳华大智造科技股份有限公司。
1.2 主要药品与试剂
染料木素对照品(批号RFS-R00111812016,纯度>98%)购自成都瑞芬思生物科技有限公司;胎牛血清购自美国Thermo Fisher Scientific公司;含0.25%乙二胺四乙酸(EDTA)的胰蛋白酶消化液(批号20181218)购自北京索莱宝科技有限公司;CCK-8试剂盒(批号20200720)购自杭州弗德生物科技有限公司;RPMI 1640培养液、细胞周期检测试剂盒(批号20201118)、荧光素FITC标记的膜联蛋白V(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(批号20200610)均购自江苏凯基生物科技股份有限公司;总RNA提取试剂盒(批号10029777)购自美国BioLabs公司;MGIEasy RNA文库制备试剂盒(批号A0002)、MGIEasy DNA纯化磁珠(批号A0212)和BGISEQ-500RS高通量测序试剂盒(批号A20)均购自深圳华大智造科技股份有限公司;cDNA反转录试剂盒(批号N20426)、RT-qPCR反应试剂盒(批号O10318)均购自北京全式金生物技术有限公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
人鼻咽癌CNE1细胞(批号CC-Y1118)购自上海酶研生物科技有限公司。
2 方法
2.1 细胞的培养
将CNE1细胞接种于含10%胎牛血清的RPMI 1640培养液中,置于37 ℃、5%CO2的恒温培养箱中常规培养(培养条件下同)。每3天传代1次,每次用含0.25%EDTA的胰蛋白酶消化液消化3 min后,收集细胞继续培养。待传至10~20代时,取对数生长期细胞进行后续实验。
2.2 染料木素对CNE1细胞增殖的影响
采用CCK-8法进行考察。将CNE1细胞用含5%胎牛血清的RPMI 1640培养液制成密度为1×104 mL-1的细胞悬液,按每孔100 μL接种于96孔板中,常规培养。待细胞贴壁后,按照预实验结果,将其分为空白对照组(0 ?mol/L)和不同浓度染料木素组(12.5、25、50、100、150 ?mol/L),每组设置3个复孔,并另设调零孔。分别于加药干预24、48、72 h时,在每孔中加入CCK-8溶液10 ?L,继续培养2 h。使用酶标仪于450 nm波长处测定各孔的吸光度(A),计算细胞的增殖抑制率:增殖抑制率(%)=(实验组A值-空白对照组A值)/(空白对照组A值-调零孔A值)×100%。使用SPSS 21.0软件分别计算上述3个时间点的半数抑制浓度(IC50)。实验重复3次。
2.3 染料木素对CNE1细胞周期的影响
采用流式细胞术进行测定。将CNE1细胞用含5%胎牛血清的RPMI 1640培养液制成密度为1.5×105 mL-1的细胞悬液,按每孔2 mL接种于6孔板中,常规培养。待细胞贴壁后,将其分为空白对照组(0 ?mol/L)和不同浓度染料木素组(15、30、60 ?mol/L,以CCK-8实验48 h的IC50为中剂量组、1/2倍 IC50为低剂量组、2倍IC50为高剂量组),每组设置3个复孔。加药干预 24 h后,用含0.25%EDTA的胰蛋白酶消化液消化并收集细胞,按细胞周期检测试剂盒方法进行固定、染色,然后采用流式细胞仪进行检测。使用ModFit 5.0软件进行图片分析,计算各个周期细胞的比例。实验重复3次。
2.4 染料木素对CNE1细胞凋亡的影响
采用流式细胞术进行测定。细胞按“2.3”项下方法接种、分组和给药。加药干预 24 h后,用含0.25%EDTA的胰蛋白酶消化液消化并收集细胞,按照Annexin V-FITC/PI细胞凋亡检测试剂盒方法进行染色,然后使用流式细胞仪测定各组细胞的凋亡情况,以Q2、Q3象限细胞所占比例之和为凋亡率。实验重复3次。
2.5 染料木素对CNE1细胞迁移的影响
采用细胞划痕实验进行测定。将CNE1细胞用含5%胎牛血清的RPMI 1640培养液制成密度为4×105 mL-1的细胞悬液,按每孔2 mL接种于6孔板中,常规培养。待细胞贴壁后,将其分为空白对照组(0 ?mol/L)和不同浓度染料木素组(10、20、30 ?mol/L,为避免过高剂量使细胞脱落影响实验结果准确性,以CCK-8实验48 h的IC50值为高剂量组、1/2倍IC50为中剂量组、1/3倍IC50为低剂量组)。常规培养至细胞铺满培养孔的90%时,在6孔板的后侧用标记笔划3条等距黑线,然后用10 ?L枪头在培养孔内划3条平行等距的线垂直于黑线,再给药干预。分别在加药干预0、24 h时,每组随机选取5个点进行拍照。使用Image J 1.48软件分别测定划痕面积,取平均值,然后计算伤口愈合率:伤口愈合率(%)=(0 h时的平均划痕面积-24 h时的平均划痕面积)/ 0 h时的平均划痕面积×100%。重复实验3次。
2.6 染料木素对CNE1细胞中基因表达的影响
将CNE1细胞用含5%胎牛血清的RPMI 1640培养液制成密度为3×105 mL-1的细胞悬液,按每孔2 mL接种于6孔板中,常规培养。待细胞贴壁后,将细胞分为空白对照组和30 ?mol/L染料木素组,每组设置3个复孔。加药干预24 h后,常规消化、收集细胞。按照总RNA提取试剂盒方法提取细胞中总RNA,并按照MGIEasy RNA文库制备试剂盒方法对总RNA进行富集、反转录、扩增和纯化等操作后得到RNA文库,再对RNA文库进行均一化、环化、酶切消化和纯化后,按照高通量测序試剂盒方法对其进行芯片加载和高通量测序,以得到空白对照组和30 ?mol/L染料木素组细胞中基因的碱基序列(即原始测序数据)。用FastQC 0.11.9软件对碱基序列数据进行质量控制,用Trimmomatic 0.36软件去除与接头匹配率超过30%的测序片段并过滤掉长度低于50 bp的片段后,再用Botie2 2.4.2软件将质量控制后的数据映射到人类参考基因组上,并计算人类参考基因组中各基因的表达量(记为“Count”值)。利用DESeq2 3.13软件计算分析各基因表达量的差异倍数的对数值[log2(Fold change)],且得到对应的padj值(矫正后的P值), 以log2(Fold change)<0为表达下调,log2(Fold change)>0为表达上调,以log2(Fold change)>1且padj<0.05为标准筛选差异基因,利用R语言包中的ggplot2包绘制差异基因火山图。结合上述细胞实验结果,筛选出调控相关过程的8个差异基因以进行后续研究,并采用在线网站Morpheus(https://software.broadinstitute.org/morpheus/)以log2Count值绘制热图。
2.7 差异基因表达的验证
采用RT-qPCR法进行验证。按“2.6”项下方法进行细胞培养、给药、收集和提取细胞中总RNA。将总RNA按cDNA反转录试剂盒方法反转录成cDNA后,以cDNA为模板使用SYBR Green Ⅰ法进行RT-qPCR反应。RT-qPCR反应体系(共20 ?L)包括cDNA模板1 ?L,上、下游引物(10 ?mol/L)各0.4 ?L,qPCR反应缓冲液(2×)10 ?L,荧光染料(50×)0.4 ?L,无酶水7.8 ?L。反应程序为94 ℃变性5 s,56 ℃退火15 s,72 ℃延伸10 s,共40个循环。以GAPDH为内参基因,采用2-ΔΔCt法计算各目的基因的相对表达量(将空白对照组的值定义为1)。实验重复3次。引物序列及扩增产物长度见表1(引物序列由本课题组使用Primer 5.0软件自行设计,由广州天一辉远基因科技有限公司合成)。
2.8 统计学方法
采用SPSS 21.0软件对数据进行统计分析。结果以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
3 结果
3.1 染料木素对CNE1细胞增殖的影响结果
加药干预24、48、72 h后,与空白对照组比较,12.5、25、50、100、150 ?mol/L染料木素组细胞的增殖抑制率均显著升高(P<0.01)。在相同浓度染料木素作用下,细胞的增殖抑制率有随作用时间延长而升高的趋势;在加药干预相同时间时,细胞的增殖抑制率有随染料木素浓度增加而升高的趋势。药物作用24、48、72 h时的IC50分别为56.32、34.13、21.90 ?mol/L。可见,染料木素对CNE1细胞的增殖具有明显的抑制作用,且该作用呈浓度-时间-效应趋势。不同浓度染料木素作用不同时间后对CNE1细胞增殖的影响结果见表2。
3.2 染料木素对CNE1细胞周期的影响结果
与空白对照组比较,15、30 ?mol/L染料木素组G0/G1期细胞比例显著升高(P<0.05或P<0.01),但60 ?mol/L染料木素组G0/G1期细胞比例显著降低(P<0.01);15、30、60 ?mol/L染料木素组S期细胞比例均显著降低(P<0.01);30、60 ?mol/L染料木素组G2/M期细胞比例均显著升高(P<0.05或P<0.01)。与15 ?mol/L染料木素组比较,30、60 ?mol/L染料木素组G2/M期细胞比例均显著升高(P<0.05或P<0.01),但60 ?mol/L染料木素组G0/G1期细胞比例显著降低(P<0.01);与30 ?mol/L染料木素组比较,60 ?mol/L染料木素组G0/G1细胞比例显著降低(P<0.01),但G2/M期细胞比例显著升高(P<0.01)。不同浓度染料木素作用24 h后对CNE1细胞周期分布影响的流式细胞图见图1,细胞周期测定结果见表3。
3.3 染料木素对CNE1细胞凋亡的影响
空白对照组和15、30、60 ?mol/L染料木素组细胞的凋亡率分别为(4.37±2.02)%、(13.06±3.96)%、(23.28±6.87)%、(29.41±7.43)%。与空白对照组比较,15、30、60 ?mol/L染料木素组细胞的凋亡率均有不同程度升高,且具有一定的浓度依赖性趋势,其中30、60 ?mol/L染料木素组细胞的凋亡率显著升高(P<0.05或P<0.01)。不同浓度染料木素作用24 h后对CNE1凋亡影响的流式细胞图见图2。
3.4 染料木素对CNE1细胞迁移能力的影响结果
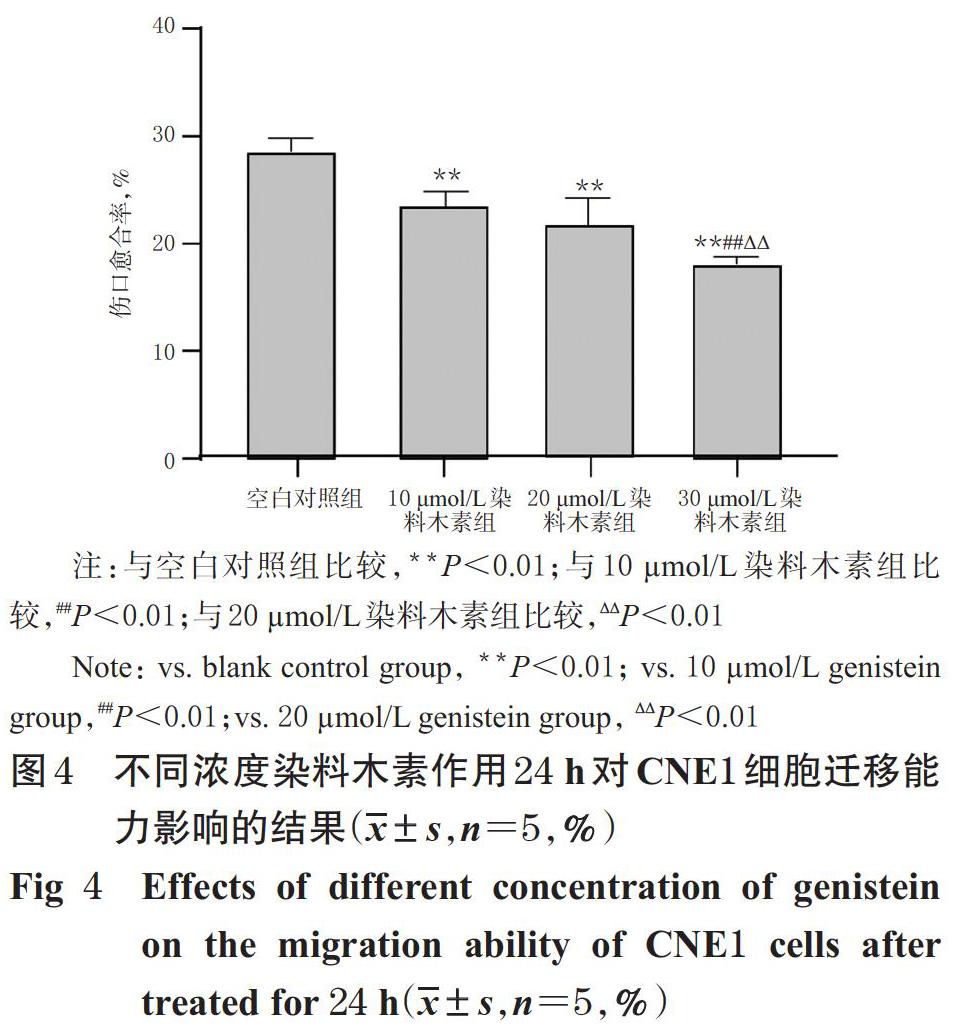
与空白对照组比较,10、20、30 ?mol/L染料木素组细胞的伤口愈合率均显著降低(P<0.01);与10 ?mol/L染料木素组比较,20 ?mol/L染料木素组的伤口愈合率差异无统计学意义(P>0.05),但30 ?mol/L染料木素组的伤口愈合率则显著降低(P<0.01);与20 ?mol/L组比较,30 ?mol/L染料木素组的伤口愈合率也显著降低(P<0.01)。不同浓度染料木素作用24 h后对CNE1细胞迁移能力影响的显微图见图3,伤口愈合率测定结果见图4。
3.5 染料木素对CNE1细胞中基因表达的影响
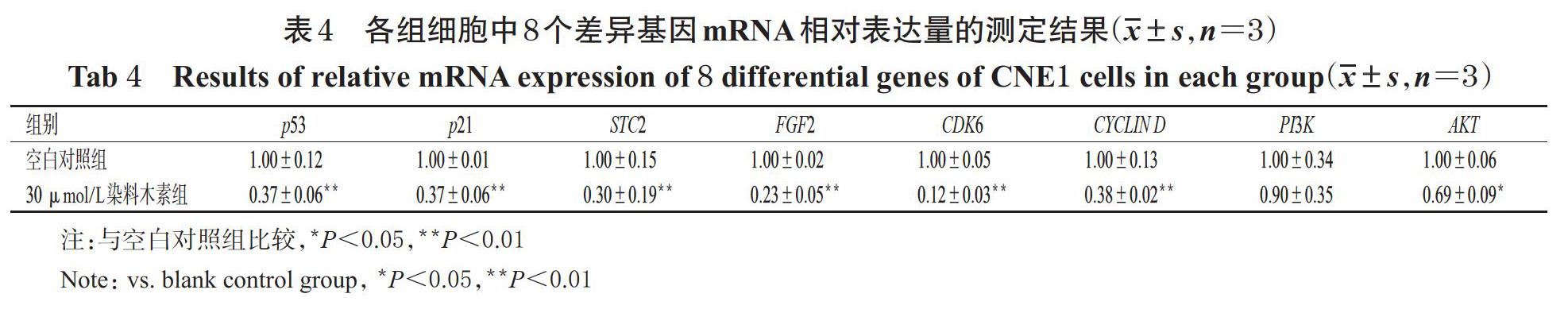
经染料木素干预后,产生了众多差异基因,如图5A所示(图中,每个点代表1个基因,灰色代表无显著变化的基因,红色代表显著上调的基因,蓝色代表显著下调的基因,且差异越显著其离散程度越高)。与空白对照组比较,30 ?mol/L染料木素组细胞中共有2 271个差异基因(padj<0.05),其中有1 154个基因表达显著上调、 1 117个基因表达显著下调。结合本研究中相关细胞实验,筛选出p53、p21、STC2、FGF2、CDK6、CYLIN D、PI3K、AKT等8个相关基因进行后续实验,这8个基因表达量趋势如图5B所示(图中,从蓝色到红色代表了差异基因表达量从低到高的变化趋势)。结果显示,与空白对照组比较,30 ?mol/L染料木素组细胞中上述8个基因的表达均呈下调的趋势。
3.6 CNE1细胞中8个差异基因mRNA表达情况的验證结果
与空白对照组比较,30 ?mol/L染料木素组细胞中上述8个差异基因mRNA的相对表达量均有不同程度降低,其中p53、p21、STC2、FGF2、CDK6、CYCLIN D、AKT等7个基因mRNA的相对表达量均显著降低(P<0.05或P<0.01)。各组细胞中8个差异基因mRNA相对表达量的测定结果见表4。
4 讨论
本研究结果显示,12.5~150 ?mol/L染料木素对CNE1细胞的增殖均有不同程度的抑制作用,10~30 ?mol/L染料木素可以抑制CNE1细胞的迁移,15~60 ?mol/L染料木素可不同程度地促进CNE1细胞凋亡,且可以阻滞细胞周期进程。其中,30 ?mol/L的染料木素可以使CNE1细胞的G0/G1期和G2/M期都发生阻滞;而当染料木素浓度提高到60 ?mol/L时,CNE1细胞则大量阻滞于G2/M期,这可能是由于高浓度的染料木素对CNE1细胞G2/M期相关基因或蛋白的调控作用更加显著所造成的,但具体的作用过程及机制仍然需要进一步研究。
本研究用30 ?mol/L的染料木素干预CNE1细胞后共获得2 271个差异基因,并用RT-qPCR法验证了其中8个基因的mRNA表达与测序结果相符,这8个基因也在染料木素对鼻咽癌CNE1细胞的抑制作用中发挥重要作用。p53基因已被证实在抗肿瘤方面作用明显,通常过表达的p53基因会通过调控其下游基因的表达,直接或间接参与肿瘤细胞的生长、发展和死亡过程,其主要通过阻滞细胞周期和诱导细胞凋亡而产生抗肿瘤作用[24]。然而,本研究发现,在染料木素干预后的CNE1细胞中,p53基因的表达水平并没有升高反而显著降低,因此笔者推测p53基因可能在CNE1细胞中发生了突变。已有研究表明,p53基因突变在人类肿瘤细胞中非常常见,约有50%的人类肿瘤细胞都会发生p53基因突变,30%~50%的头颈部肿瘤患者细胞中会发生p53基因突变[25-26]。与野生型p53基因不同,突变型p53基因并没有表现出抗癌的作用,反而会促进肿瘤细胞的生长,加快肿瘤发展进程,表现出了与野生型p53基因完全相反的作用[27-29]。研究表明,野生型P53蛋白可以促进E3型泛素化连接酶MDM2的表达,而后者可使P53蛋白泛素化降解;然而,突变型P53蛋白不会激活MDM2,因此导致突变型P53蛋白积聚于肿瘤细胞内[30]。又有报道证实,抑制突变型p53基因的表达或使突变型P53蛋白与某些小分子结合,使突变型P53蛋白发生稳定折叠而恢复其野生型P53蛋白的功能后,可达到抗肿瘤的目的[31-32]。因此笔者推测,在CNE1细胞中突变型p53基因编码翻译的突变型P53蛋白无法激活MDM2,导致其积聚于细胞内难以降解,而染料木素能抑制细胞中突变型p53基因表达,甚至与突变型P53蛋白结合,使突变型P53蛋白发生折叠而恢复了野生型P53蛋白的功能,从而阻滞CNE1细胞周期、诱导其凋亡,最终发挥抗鼻咽癌的作用。而人类正常细胞不表达突变型p53基因[33-34],这意味着染料木素在抑制突变型p53基因表达的同时不会对正常组织造成严重损伤,因此该化合物针对突变型p53基因靶向治疗鼻咽癌有望得以实现。
STC2基因是锡钙素家族的成员,STC2以及其所编码的锡钙素2(STC2)蛋白具有调节钙和磷酸盐分泌的重要作用[35]。目前,已有研究证实,STC2的异常表达与鼻咽癌患者预后不良存在一定关系[36]。STC2蛋白是人头颈部鳞状细胞癌细胞生长、转移和侵袭的正向调节剂;而成细胞纤维生长因子2(FGF2)作为TGF家族的一员,与肿瘤细胞增殖、迁移和侵袭密切相关;STC2、FGF2蛋白对磷酸化蛋白激酶B(p-Akt)、磷脂酰肌醇3激酶(PI3K)等PI3K/Akt通路中关键蛋白的表达均有正向调节作用,可增强头颈部鳞状细胞HNSCC的增殖、侵袭和肿瘤转移能力[37-40]。而本研究结果表明,染料木素可以显著抑制CNE1细胞的增殖和迁移,且可以显著降低CNE1细胞中STC2、FGF2基因的表达,而调控PI3K/Akt通路的关键基因AKT、PI3K的表达也有不同程度的下降,因此笔者推测是STC2、FGF2基因表达的下调导致了PI3K/Akt通路活性被抑制。细胞周期蛋白依赖性激酶(CDK)家族和D型细胞周期蛋白(CYCLIN D)是PI3K/Akt通路的下游蛋白,CDK家族依赖CYCLIN D与其结合才能被激活,从而发挥调控细胞周期、转录、生长的作用[41-42]。同时,有研究发现,染料木素可直接与CDK6/CYCLIN D复合物结合,从而直接发挥抗鼻咽癌的作用[43]。本研究已经证实,经染料木素干预后,CNE1细胞中CDK6、CYCLIN D基因表达均显著下调,细胞周期阻滞于G2/M期,这可能是CDK6基因表达下调直接导致了CDK6激酶的表达水平降低;同时,CYCLIN D基因调控CYCLIN D的表达,使蛋白表达水平降低从而抑制CDK6激酶的活性,导致细胞周期被阻滞、转录受阻,最终使CNE1细胞生长受到抑制。因此,染料木素的抗鼻咽癌机制可能与其抑制PI3K/Akt通路活性有关。已有的研究表明,染料木素可以通过调控p21、ART、p15等基因mRNA的表达和凋亡调节剂相关X蛋白、胱天蛋白酶8(Caspase-8)、裂解型胱天蛋白酶9(Cleaved-caspase-9)等蛋白靶点,参与鼻咽癌细胞生长、转移和发展的过程,已确定染料木素能通过抑制Hedgehog通路活性发挥抗鼻咽癌作用[44-45]。p21可以参与多条信号通路转导,如P53通路和PI3K/Akt通路,其可正向调控P53通路,负向调控PI3K/Akt通路[46-47]。而本研究结果显示,p21基因表达量显著下降,与p53基因表达趋势相同,提示其可能是受到P53通路的调控。
綜上所述,本研究除了通过体外细胞实验证实了染料木素抗鼻咽癌的活性外,还通过高通量测序技术和RT-qPCR方法相互印证,挖掘出了p53、STC2、FGF2、AKT、PIK、CDK6和CYCLIN D等抗鼻咽癌的相关靶点,发现染料木素可能通过抑制突变型基因p53的表达,恢复野生型P53蛋白的功能,从而发挥抗鼻咽癌的作用。笔者还在mRNA水平上初步证明了染料木素可以抑制PI3K/Akt通路的活性,从而抑制鼻咽癌的生长、转移。虽然本研究只涉及了基因水平,仍需蛋白水平和体内实验的验证,但本研究依托高通量测序技术挖掘出了新的染料木素抗鼻咽癌靶点和通路,也为该化合物的后续研究以及鼻咽癌的治疗提供了理论基础。
参考文献
[ 1 ] 林玲,胡耶芳. HPLC测定千斤拔染料木苷及染料木素含量[J].国际中医中药杂志,2019,41(2):182-184.
[ 2 ] 冯果,施晓伟,蔡琨,等.黔产纯种发酵淡豆豉中大豆黄素及染料木素的含量测定[J].广东农业科学,2011,38(23):118-119.
[ 3 ] 梁永枢,安冉,刘军民,等.不同产地鸡血藤药材中染料木素及芒柄花素的含量测定[J].时珍国医国药,2013,24(7):1655-1657.
[ 4 ] 张晓松,金花,闫惠丽,等.去甲基化法制备黄豆苷元和染料木黄酮及抗氧化性分析[J].食品科学,2018,39(2):240-246.
[ 5 ] FANG Y C,CHEN B H,HUANG R F,et al. Effect of genistein supplementation on tissue genistein and lipid per- oxidation of serum,liver and low-density lipoprotein in hamsters[J]. J Nutr Biochem,2004,15(3):142-148.
[ 6 ] UDDIN M S,KABIR M T. Emerging signal regulating potential of genistein against alzheimers disease:a promi- sing molecule of interest[J]. Front Cell Dev Biol,2019(7):197-208.
[ 7 ] 张岭,张丽婧,胡文敏,等.染料木黄酮对小鼠卵母细胞成熟的抑制作用[J].中国食品卫生杂志,2018,30(4):353-356.
[ 8 ] GUAN Y,ZHANG Y,ZOU J,et al. Synthesis and biological evaluation of genistein-IR783 conjugate:cancer cell targeted delivery in MCF-7 for superior anti-cancer therapy[J]. Molecules,2019,24(22):4120-4136.
[ 9 ] ZHANG Z,JIN F,LIAN X,et al. Genistein promotes ionizing radiation-induced cell death by reducing cytoplasmic Bcl-xL levels in non-small cell lung cancer[J]. Sci Rep,2018,8(1):328-336.
[10] ZHANG Q,BAO J,YANG J. Genistein-triggered anticancer activity against liver cancer cell line HepG2 involves ROS generation,mitochondrial apoptosis,G2/M cell cycle arrest and inhibition of cell migration[J]. Arch Med Sci,2019,15(4):1001-1009.
[11] ZHOU P,WANG C,HU Z,et al. Genistein induces apoptosis of colon cancer cells by reversal of epithelial-to-me- senchymal via a Notch1/NF-κB/slug/E-cadherin pathway[J]. BMC Cancer,2017,17(1):813-822.
[12] WU Y,ZHANG L,NA R,et al. Plasma genistein and risk of prostate cancer in Chinese population[J]. Int Urol Nephrol,2015,47(6):965-970.
[13] JOGSONT L,LAI M B,LAI J C,et al. Inhibition of cell proliferation and MAP kinase and Akt pathways in oral squamous cell carcinoma by genistein and biochanin A[J]. Evid Based Complement Alternat Med,2010,7(3):351- 358.
[14] DU R,LIU Z,HOU X,et al. Trichostatin a potentiates genistein-induced apoptosis and reverses EMT in Hep2 cells[J]. Mol Med Rep,2016,13(6):5045-5052.
[15] FERRARI S M,ANTONELLI A,GUIDI P,et al. Genotoxicity evaluation of the soybean isoflavone genistein in human papillary thyroid cancer cells. study of its potential use in thyroid cancer therapy[J]. Nutr Cancer,2019,71(8):1335-1344.
[16] 張少华,吕波,蔡悦成.肇庆市5 352例鼻咽癌流行病学调查[J].中国基层医药,2005,12(7):809-810.
[17] 付振涛,郭晓雷,张思维,等. 2014年中国鼻咽癌发病与死亡分析[J].中华肿瘤杂志,2018,40(8):566-571.
[18] TSAI C J,HOFSTEDE T M,STURGIS E M,et al. Osteoradionecrosis and radiation dose to the mandible in patients with oropharyngeal cancer[J]. Int J Radiat Oncol Biol Phys,2013,85(2):415-420.
[19] 许建宁,王全凯,崔涛,等.染料木素对大鼠生殖毒性的实验研究:Ⅰ:一般生殖毒性[J].中草药,2003,34(9):65-67.
[20] 许建宁,王全凯,李忠生,等.染料木素对大鼠生殖毒性的实验研究:Ⅱ:致畸敏感期毒性[J].中草药,2004,35(8):78-79.
[21] 许建宁,王全凯,崔涛,等.染料木素对大鼠生殖毒性的实验研究:Ⅲ:围产期毒性[J].中草药,2004,35(11):83-86.
[22] PINTOVA S,DHARMUPARI S,MOSHIER E,et al. Genistein combined with FOLFOX or FOLFOX-Bevacizu- mab for the treatment of metastatic colorectal cancer:phase Ⅰ/Ⅱ pilot study[J]. Cancer Chemother Pharmacol,2019,84(3):591-598.
[23] BUESCHER J M,DRIGGERS E M. Integration of omics:more than the sum of its parts[J]. Cancer Metab,2016(4):4-11.
[24] LEVINE A J,OREN M. The first 30 years of p53:growing ever more complex[J]. Nat Rev Cancer,2009,9(10):749-758.
[25] HOLLSTEIN M,SIDRANSKY D,VOGELSTEIN B, et al. P53 mutations in human cancers[J]. Science,1991,253(5015):49-53.
[26] OLIVIER M,HUSSAIN S P,CARON DE FROMENTEL C,et al. TP53 mutation spectra and load:a tool for gene- rating hypotheses on the etiology of cancer[J]. IARC Sci Publ,2004(157):247-270.
[27] LISEK K,CAMPANER E,CIANI Y,et al. Mutant p53 tunes the NRF2-dependent antioxidant response to support survival of cancer cells[J]. Oncotarget,2018,9(29):20508-20523.
[28] ROM?N-ROSALES A A,GARC?A-VILLA E,HERRERA L A,et al. Mutant p53 gain of function induces HER2 over-expression in cancer cells[J]. BMC Cancer,2018,18(1):709-720.
[29] BUTERA G,BRANDI J,CAVALLINI C,et al. The mutant p53-driven secretome has oncogenic functions in pancreatic ductal adenocarcinoma cells[J]. Biomolecules,2020,10(6):884.
[30] SOBHANI N,DANGELO A,WANG X,et al. Mutant p53 as an antigen in cancer immunotherapy[J]. Int J Mol Sci,2020,21(11):4087.
[31] TAL P,EIZENBERGER S,COHEN E,et al. Cancer therapeutic approach based on conformational stabilization of mutant p53 protein by small peptides[J]. Oncotarget,2016,7(11):11817-11837.
[32] PARRALES A,IWAKUMA T. Targeting oncogenic mutant p53 for cancer therapy[J]. Front Oncol,2015(5):288-300.
[33] GOLDSTEIN I,MARCEL V,OLIVIER M,et al. Understanding wild-type and mutant p53 activities in human cancer:new landmarks on the way to targeted therapies[J]. Cancer Gene Ther,2011,18(1):2-11.
[34] BINAYKE A,MISHRA S,SUMAN P,et al. Awakening the “guardian of genome”:reactivation of mutant p53[J]. Cancer Chemother Pharmacol,2019,83(11):1-15.
[35] MCCUDDEN C R,JAMES K A,HASILO C,et al. Cha- racterization of mammalian stanniocalcin receptors. Mitochondrial targeting of ligand and receptor for regulation of cellular metabolism[J]. J Biol Chem,2002,277(47):45249-45258.
[36] LIN S,GUO Q,WEN J,et al. Survival analyses correlate stanniocalcin 2 overexpression to poor prognosis of nasopharyngeal carcinomas[J]. J Exp Clin Cancer Res,2014,33(1):26.
[37] YANG S,JI Q,CHANG B,et al. STC2 promotes head and neck squamous cell carcinoma metastasis through modulating the PI3K/AKT/Snail signaling[J]. Oncotarget,2017,8(4):5976-5991.
[38] MA H F,LV G X,ZHANG D H. MiR-381 mediates the development of head and necksquamous cell carcinoma via targeting STC2[J]. Onco Targets Ther,2020(13):4485-4493.
[39] HE H,QIE S,GUO Q,et al. Stanniocalcin 2(STC2)expression promotes post-radiation survival,migration and invasion of nasopharyngeal carcinoma cells[J]. Cancer Manag Res,2019(11):6411-6424.
[40] HE Q,REN X,CHEN J,et al. MiR-16 targets fibroblast growth factor 2 to inhibit NPC cell proliferation and invasion via PI3K/AKT and MAPK signaling pathways[J]. Oncotarget,2016,7(3):3047-3058.
[41] WANG H,NICOLAY B N,CHICK J M,et al. The metabolic function of cyclin D3-CDK6 kinase in cancer cell survival[J]. Nature,2017,546(7658):426-430.
[42] TADESSE S,YU M,KUMARASIRI M,et al. Targeting CDK6 in cancer:state of the art and new insights[J]. Cell Cycle,2015,14(20):3220-3230.
[43] ZHANG J,ZHANG L,XU Y,et al. Deciphering the bin- ding behavior of flavonoids to the cyclin dependent kinase 6/cyclin D complex[J]. PLoS One,2018,13(5):e0196651.
[44] HAN H,ZHONG C,ZHANG X,et al. Genistein induces growth inhibition and G2/M arrest in nasopharyngeal carcinoma cells[J]. Nutr Cancer,2010,62(5):641-647.
[45] ZHANG Q,CAO W S,WANG X Q,et al. Genistein inhi- bits nasopharyngeal cancer stem cells through sonic hedgehog signaling[J]. Phytother Res,2019,33(10):2783-2791.
[46] XIAO B D,ZHAO Y J,JIA X Y,et al. Multifaceted p21 in carcinogenesis,stemness of tumor and tumor therapy[J]. World J Stem Cells,2020,12(6):481-487.
[47] ZHANG Y,WANG S,QIAN W,et al. Uc.338 targets P21 and CYCLIN D1 via PI3K/AKT pathway activation to promote cell proliferation in colorectal cancer[J]. Oncol Rep,2018,40(2):1119-1128.
(收稿日期:2021-02-04 修回日期:2021-03-02)
(編辑:林 静)
