芥子酸对Aβ1-42致PC12细胞损伤的改善作用及对BDNF/TrkB/ERK信号通路的影响
2021-07-11薛迪刘宇超汪娜刘学伟
薛迪 刘宇超 汪娜 刘学伟

中圖分类号 R285;R741 文献标志码 A 文章编号 1001-0408(2021)10-1181-06
DOI 10.6039/j.issn.1001-0408.2021.10.05
摘 要 目的:研究芥子酸对β-淀粉样蛋白1-42(Aβ1-42)诱导的大鼠肾上腺髓质嗜铬细胞瘤细胞(PC12细胞)损伤的改善作用,并探讨其对脑源性神经营养因子(BDNF)/酪氨酸激酶B(TrkB)/细胞外信号调节激酶(ERK)信号通路的影响。方法:将PC12细胞分为空白组、模型组和芥子酸低、高剂量组(50、100 μmol/L)。除空白组外,其余各组均用2 μmol/L的Aβ1-42诱导细胞损伤;建模24 h后,药物组加入相应药液,培养24 h。观察各组细胞形态变化,检测细胞存活率和细胞中BDNF mRNA的表达情况及其蛋白水平,以及TrkB、ERK1/2、磷酸化ERK1/2(p-ERK1/2)蛋白的表达情况,并计算p-ERK1/2与ERK1/2的比值(p-ERK/ERK比值)。结果:与空白组比较,模型组细胞突触变短,细胞连接较松,贴壁性差,胞质较暗淡,胞浆中有较多颗粒,细胞存活率以及细胞中BDNF mRNA的相对表达量及其蛋白水平,TrkB、p-ERK1/2蛋白的相对表达量和p-ERK/ERK比值均显著降低(P<0.05或P<0.01)。与模型组比较,芥子酸高剂量组细胞病理变化明显改善,细胞存活率以及细胞中BDNF mRNA的相对表达量及其蛋白水平,TrkB、p-ERK蛋白的相对表达量和p-ERK/ERK比值均显著升高(P<0.05或P<0.01)。结论:芥子酸可改善Aβ1-42诱导的PC12细胞损伤,其作用机制可能与激活BDNF/TrkB/ERK信号通路有关。
关键词 芥子酸;阿尔茨海默症;β-淀粉样蛋白1-42;脑源性神经生长因子;酪氨酸激酶B;细胞外信号调节激酶
Effects of Sinapic Acid on Improving PC12 Cell Damage Induced by Aβ1-42 and BDNF/TrkB/ERK Signaling Pathway
XUE Di1,LIU Yuchao2,WANG Na3,LIU Xuewei4(1. School of Pharmacy,Qiqihar Medical University, Heilongjiang Qiqihar 161006, China; 2. Office of Academic Research, Qiqihar Medical University,Heilongjiang Qiqihar 161006,China; 3. School of Basic Medicine,Qiqihar Medical University,Heilongjiang Qiqihar 161006,China; 4. School of Mental Health,Qiqihar Medical University,Heilongjiang Qiqihar 161006,China)
ABSTRACT OBJECTIVE:To study the improvement effects of sinapic acid (SA) on PC12 cell damage induced by Aβ1-42, and to investigate its effect on brain-derived neurotrophic factor (BDNF) /tyrosine kinase B (TrkB) /extracellular signal-regulated kinase (ERK) signaling pathway. METHODS: PC12 cells were divided into blank group,model group, SA low-dose and high-dose groups (50, 100 μmol/L). Except for blank group, cell damage was induced by Aβ1-42 in other groups; 24 h after modeling,administration groups were added with the corresponding solution and cultured for 24 h. Morphological changes of cells in each group were observed. Cell survival rate, mRNA expression and protein level of BDNF,protein expression of TrkB,ERK1/2 and phosphorylated ERK1/2 (p-ERK1/2) were detected. p-ERK/ERK ratio was calculated. RESULTS:Compared with blank group,the model group had shorter synapses,looser intercellular junctions,poor adhesion,dim cytoplasm and more granules in cytoplasm. Cell survival rate and mRNA expression and protein level of BDNF, the relative expression of TrkB and p-ERK1/2 protein, p-ERK/ERK ratio were significantly decreased (P<0.05 or P<0.01). Compared with model group,in SA high-dose group the pathological changes of the cells were significantly improved,the survival rate of the cells,the mRNA expression and protein level of BDNF,the relative expression of TrkB and p-ERK1/2 protein, p-ERK/ERK ratio were significantly increased (P<0.05 or P<0.01). CONCLUSIONS:SA can improve PC12 cells damage induced by Aβ1-42, the mechanism of which may be associated with activating BDNF/TrkB/ERK signaling pathway.
KEYWORDS Sinapic acid; Alzheimers disease; Aβ1-42; Brain-derived neurotrophic factor; Tyrosine kinase B; Extracellular signal-regulated kinase
阿尔茨海默病(AD)是一种以认知障碍为主要表现的中枢神经系统退行性病变[1]。β-淀粉样蛋白(Aβ)在脑内过度累积形成的淀粉样蛋白斑块是AD的典型病理特征[2]。Aβ主要包括Aβ1-40和Aβ1-42两种亚型,其中Aβ1-42在AD患者脑内最具神经元毒性,易引起老年斑的形成[2-3]。
目前,美国FDA批准用于治疗AD的药物有两类,一类是胆碱酯酶抑制剂,如多奈哌齐、加兰他敏等;另一类是N-甲基-D-天冬氨酸(NMDA)受体拮抗药,如盐酸美金刚;但这两类药物均不能有效逆转AD的进程[4]。2019年11月,国家药品监督管理局批准了治疗AD的新药——九期一?(甘露特钠胶囊,GV-971)的上市申请,该药的主要成分是海洋褐藻中的低分子酸性寡糖类化合物,能够通过调节肠道菌群的靶向脑-肠轴而改善患者的认知功能,从而治疗轻中度AD[5]。由此可见,从天然药物中寻找用于防治AD的有效成分是可行的。
芥子酸,又称3,5-二甲氧基-4-羟基肉桂酸,广泛分布于水果、蔬菜、谷物中,其衍生物有芥子碱、丁香醛等。研究指出,芥子酸对AD、共济失调、帕金森病等神经退行性疾病有一定的治疗作用[6]。相关药理实验发现,芥子酸作为一种神经保护剂,能够减轻Aβ1-42诱导的小鼠海马CA1区神经细胞损伤,并能够改善红藻氨酸引起的小鼠认知障碍,提示该化合物可能对Aβ1-42诱导的神经元毒性具有拮抗作用,但其作用机制不详[7-8]。另有研究报道,脑源性神经营养因子(BDNF)与酪氨酸激酶B(TrkB)受体结合后,可使TrK受体二聚化,从而激活细胞外信号调节激酶(ERK)/核糖体S6蛋白激酶(RSK)、磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)等下游信號转导通路,诱导信号级联反应;BDNF将上游信号转移至细胞核内,使部分核内的转录因子发生磷酸化,对神经元存活、突触功能和突触可塑性具有重要作用[9-10]。基于此,本研究在前期研究的基础上,以BDNF/TrkB/ERK信号通路为研究切入点,探讨芥子酸对Aβ1-42致PC12细胞损伤的保护作用机制,为开发防治AD的创新候选药物提供科学的实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括DL-CJ-2NDII Ⅱ型超净工作台(北京东联哈尔仪器制造有限公司)、Series 8000型CO2培养箱和QuantStudio 5型实时荧光定量聚合酶链式反应(PCR)仪(美国Thermo Fisher Scientific公司)、M200 PRO型多功能酶标仪(瑞士Tecan公司)、CKX41- A32PH型倒置显微镜(日本Olympus公司)、AL204型电子天平(上海梅特勒-托利多仪器有限公司)、5804R型离心机(德国Eppendorf公司)、C1000 Touch型基因扩增仪和Gel Doc XR型凝胶成像系统(美国Bio-Rad公司)、S11-6-S型恒温水浴锅(上海跃进医疗器械厂)、LDZH-200KBS型高压蒸汽灭菌器(上海申安医疗器械厂)等。
1.2 主要药品与试剂
芥子酸对照品(批号S30697,纯度≥97%)购自上海源叶生物科技有限公司;Aβ1-42蛋白(批号bs-0107p)购自北京博奥森生物技术有限公司;RPMI 1640培养基(改良型,货号SH30809.01)购自美国HyClone公司;胎牛血清(批号04-007-1A)购自美国BI公司;大鼠BDNF酶联免疫吸附测定(ELISA)试剂盒(批号E30664)购自北京诚林生物科技有限公司;RIPA细胞裂解液、苯甲基磺酰氟(PMSF)蛋白酶抑制剂(100×)、BCA蛋白浓度试剂盒、特超敏ECL化学发光试剂盒(批号分别为P0013B、P1005、P0010S、P0018AS)均购自上海碧云天生物技术有限公司;磷酸酶抑制剂混合物(100×)(批号CW2383S)购自江苏康为世纪生物科技股份有限公司;十二烷基硫酸钠(SDS)、过硫酸铵(APS)、四甲基乙二胺(TEMED)、二甲基亚砜(DMSO)购自美国Sigma公司;预染蛋白质Maker(批号26616)购自加拿大Fermentas公司;胰蛋白酶、青链霉素混合液(100×)、噻唑蓝(MTT)、脱脂奶粉(批号分别为TB150、P1400、M8180、D8340)均购自北京索莱宝科技有限公司;小鼠β-肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗、HRP标记的山羊抗小鼠IgG二抗(批号分别为151218、122826、122011)均购自北京中杉金桥生物技术有限公司;兔ERK1/2、TrkB多克隆抗体(批号分别为11257-1-AP、13129-1-AP)均购自武汉三鹰生物技术有限公司;兔磷酸化ERK1/2(p-ERK1/2)多克隆抗体(批号#4377)购自美国CST公司;总RNA提取试剂(RNAiso Plus)、PrimeScripTM RT reagent Kit(Perfect real time)试剂盒、SYBR? Premix Ex TaqTM(Tli RNaseH plus)试剂盒(批号分别为D9108A、RR037A、RR420A)均购自宝生物工程(大连)有限公司;PCR引物由上海生物工程股份有限公司设计、合成;所用试剂均为分析纯,水为超纯水。
1.3 细胞
大鼠肾上腺髓质嗜铬细胞瘤细胞(PC12细胞)购自中国科学院上海细胞生物研究所。
2 方法
2.1 Aβ1-42溶液的制备
将1 mg的Aβ1-42溶解于221.5 μL的水中,制成浓度为1 000 μmol/L的溶液,置于37 ℃、5%CO2培养箱中孵育24 h(培养条件下同),于-20 ℃保存,备用。
2.2 分组
根据课题组前期MTT实验结果,Aβ1-42诱导PC12细胞损伤的最适浓度为2 μmol/L,芥子酸对PC12细胞损伤具有改善作用的浓度范围为32~128 μmol/L。本研究将细胞分为4组,即空白组、模型组(Aβ1-42,2 μmol/L)和芥子酸低、高剂量组(50、100 μmol/L,以DMSO为溶剂)。
2.3 芥子酸对Aβ1-42诱导的PC12细胞形态及细胞活性影响的检测
采用MTT法进行检测。收集对数期的PC12细胞,接种至96孔板中,每孔100 μL,使细胞密度为5×104 mL-1,按“2.2”项下方法分为4组,每组设置8个复孔,并设置不含细胞的凋零组。各组细胞置于培养箱中继续培养24 h后,除空白组外,模型组和芥子酸低、高剂量组分别用终浓度为2 μmol/L的Aβ1-42作用24 h以诱导PC12细胞损伤;然后,芥子酸低、高剂量组加入相应浓度的芥子酸继续培养24 h。将各组细胞置于倒置显微镜下观察并拍照,采用MTT法以酶标仪于570 nm波长处检测各孔的光密度(OD)值,计算细胞存活率:存活率(%)=(实验组OD值-调零组OD值)/(空白组OD值-调零组OD值)×100%。实验重复3次。
2.4 芥子酸对Aβ1-42诱导的PC12细胞中BDNF mRNA表达影响的检测
采用实时定量PCR法进行检测。按“2.3”项下方法接种、分组、造模、给药,每组设置3个复孔。于给药培养24 h后,收集细胞,使用RNAiso Plus快速提取各組细胞总RNA;以RNA为模板,将PrimeScripTM RT reagent Kit和SYBR? Premix Ex TaqTM配合使用以逆转录成cDNA,以β-actin为内参基因,进行扩增。反应体系(25 μL)包括SYBR? Premix Ex TaqTM(Tli RNaseH Plus)(2×)12.5 μL,上游引物(10 μmol/L)0.5 μL,下游引物0.5 μL,cDNA模板2 μL,ddH2O 9.5 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸34 s,40 个循环。BDNF上游引物为5′-AGGCTTGACATCATTGGCTGACAC-3′,下游引物为5′-GGCACTTGACTACTGAGCATCACC-3′,产物片段长度为135 bp;β-actin上游引物为5′-AGAGGCATCCTGACCCTGAAG-3′,下游引物为5′-GGTTGGCCTTAGGGTTCAGAG-3′,产物片段长度为128 bp。按2-ΔΔCT法计算其相对表达量,以空白组结果为“1”,计算其他各组的比值。实验重复3次。
2.5 芥子酸对Aβ1-42诱导的PC12细胞中BDNF蛋白水平影响的检测
采用ELISA法进行检测。收集对数期的PC12细胞,接种至6孔板中,每孔1.5 mL,使细胞密度为10×104 mL-1,按“2.2”项下方法分为4组,每组设置4个复孔。按“2.3”项下方法造模、给药。于给药培养24 h后,收集细胞,反复冻融使细胞破坏并释放出胞内成分,于4 ℃下以2 000 r/min离心20 min,取上清液,于-80 ℃保存,备用。采用ELISA法以酶标仪检测细胞中BDNF水平。严格按照相应试剂盒说明书进行操作,实验重复3次。
2.6 芥子酸对Aβ1-42诱导的PC12细胞中TrkB、ERK1/2、p-ERK1/2蛋白表达影响的检测
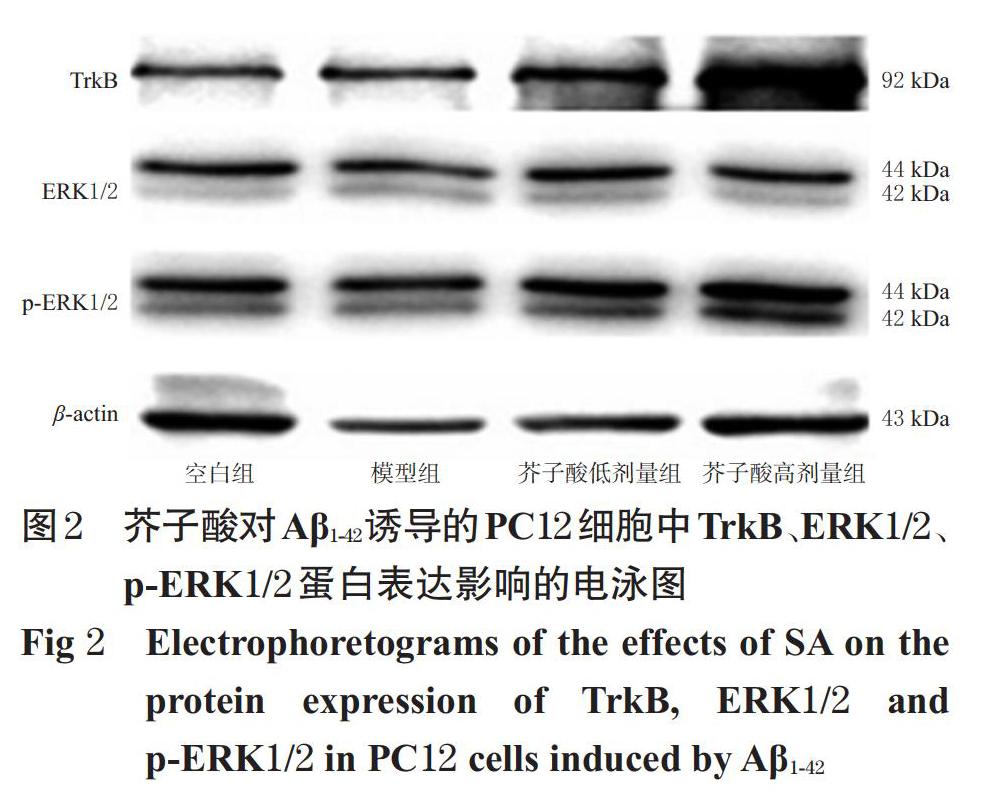
采用Western blot法进行检测。按“2.3”项下方法接种、分组、造模、给药,每组设置3个复孔。于给药培养24 h后,收集细胞,按照RIPA细胞裂解液-PMSF蛋白酶抑制剂-磷酸酶抑制剂体积比100 ∶ 1 ∶ 1配制细胞裂解液,每孔加入细胞裂解液100 μL提取细胞总蛋白,冰上裂解15 min后,以12 000 r/min离心15 min,吸取上清液,采用BCA法测定总蛋白含量,加入5×Loading buffer于95 ℃下煮沸5 min使蛋白变性。将变性后的蛋白样品加至丙烯酰胺(用SDS、APS、TEMED、水等配制)凝胶中,以恒流(电流60 mA)电泳分离,再以恒压(电压75 V,2 h)转膜;用5%脱脂奶粉于37 ℃下封闭1 h,加入TrkB、ERK1/2、p-ERK1/2、β-actin一抗(稀释比例均为1 ∶ 400),于4 ℃过夜,用TBST溶液清洗3次,每次5 min;加入相应二抗(稀释比例均为1 ∶ 1 000),于37 ℃下反应1 h,用TBST溶液清洗3次,每次5 min;以ECL显色后,置于凝胶成像系统上曝光成像。采用Image Lab 4.0.1图像分析软件检测蛋白条带灰度值,以目的蛋白与内参蛋白(β-actin)条带灰度值的比值表示目标蛋白的相对表达量,以p-ERK1/2与ERK1/2的比值(简写“p-ERK/ERK”)表示ERK1/2磷酸化水平。以空白组结果为“1”,计算其他各组的比值。实验重复3次。
2.7 统计学方法
采用SPSS 22.0软件对数据进行统计分析。数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
3 结果
3.1 芥子酸对Aβ1-42诱导的PC12细胞形态及细胞活性的影响
倒置显微镜下,空白组细胞连接紧密,可见长短不一的突触,部分突触相互连结,细胞周围有光圈且有立体感(图1A);模型组细胞突触变短,细胞连接较松,贴壁性差,胞质较暗淡,胞浆中有较多颗粒(图1B);芥子酸低剂量组细胞突触有轻微损毁,突触较模型组增多,细胞圆润性增强,细胞碎片变少(图1C);芥子酸高剂量组细胞突触相对模型组增多变长,细胞密集且光圈变明显(图1D)。
MTT实验结果显示,与空白组比较,模型组细胞的OD值和存活率均显著降低(P<0.05)。与模型组比较,芥子酸低、高剂量组细胞的OD值和存活率均有所升高,其中高剂量组显著升高(P<0.01),详见表1。
3.2 芥子酸对Aβ1-42诱导的PC12细胞中BDNF mRNA表達的影响
与空白组比较,模型组细胞中BDNF mRNA的相对表达量显著降低(P<0.01)。与模型组比较,芥子酸低、高剂量组细胞中BDNF mRNA的相对表达量均有所升高,其中高剂量组显著升高(P<0.01),详见表2。
3.3 芥子酸对Aβ1-42诱导的PC12细胞中BDNF蛋白水平的影响
与空白组比较,模型组细胞中BDNF蛋白水平显著降低(P<0.01)。与模型组比较,芥子酸低、高剂量组细胞中BDNF蛋白水平均有所升高,其中高剂量组显著升高(P<0.05),详见表2。
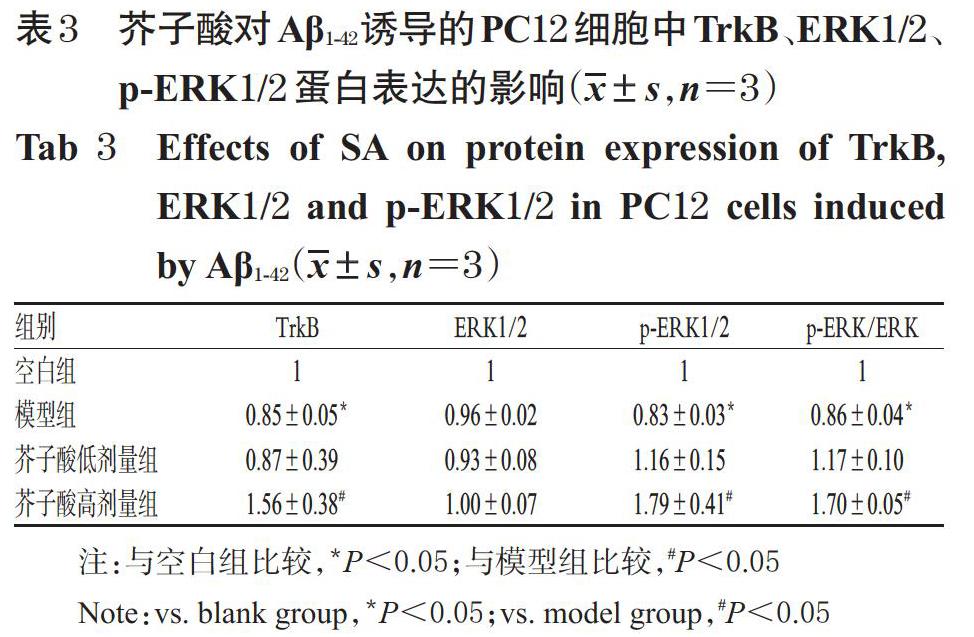
3.4 芥子酸对Aβ1-42诱导的PC12细胞中TrkB、ERK 1/2、p-ERK1/2蛋白表达的影响
与空白组比较,模型组细胞中TrkB、p-ERK1/2蛋白的相对表达量和p-ERK/ERK比值均显著降低(P<0.05),而ERK1/2蛋白的相对表达量无明显变化(P>0.05)。与模型组比较,芥子酸高剂量组细胞中TrkB、p-ERK1/2蛋白的相对表达量和p-ERK/ERK比值均显著升高(P<0.05),而ERK1/2蛋白的相对表达量无明显变化(P>0.05);此外,芥子酸低剂量组细胞的上述指标均无明显变化(P>0.05),详见图2、表3。
4 讨论
Aβ是诱发AD的关键病理产物,其中Aβ1-42可导致患者神经细胞凋亡、神经突触脱失、认知记忆能力受损[11]。研究发现,Aβ1-42可损伤神经元信号通路,导致大鼠神经突触损伤及学习记忆障碍;同时亦发现,AD患者血清中Aβ1-42水平显著高于正常人群,且Aβ1-42异常与其轻度认知障碍相关[12-15]。中药远志可作用于中枢神经系统,能够保护神经元、改善学习记忆功能[16]。本课题组前期研究发现,灌服远志乙醇提取物后,大鼠脑脊液成分中可检测到芥子酸,且远志中寡糖酯和远志皂苷的部分成分(如西伯利亚远志糖A1、西伯利亚远志糖A6、远志糖苷B、3,6′-二芥子酰基蔗糖、黄花远志素A等)均含有芥子酸残基或其前体代谢产物(相关内容待另文发表),提示远志中含有或经代谢可产生芥子酸,其可能是远志保护神经元、改善学习记忆功能的重要成分之一。本实验通过Aβ1-42诱导PC12细胞损伤,显微镜下可见损伤细胞突触变短,细胞连接较松,胞质较暗淡,胞浆中有较多颗粒,细胞存活率显著降低;但经100 μmol/L的芥子酸干预后,PC12细胞损伤明显得到抑制,突触明显长于模型组,细胞密集且光圈明显,细胞存活率也显著升高。由此说明,Aβ1-42可抑制细胞生长,降低细胞活性,影响其正常形态;而芥子酸能明显抑制Aβ1-42诱导的细胞损伤,改善受损细胞的形态,增强细胞活性,提示芥子酸具有保护PC12细胞、拮抗Aβ1-42诱导PC12细胞损伤的作用。
BDNF存在于大脑皮层、海马等部位,主要参与合成突触蛋白、促进突触连接,可增强突触可塑性、提高突触传递效率、促进神经元发育、修复神经元损伤,对神经元的存活、分化等发挥重要作用,亦可改善患者的学习记忆障碍[17-18]。近年来研究发现,BDNF/TrkB信号通路的功能障碍可导致AD的发生,同时发现AD模型大鼠脑内BDNF水平下降;BDNF亦可以调节Aβ在大脑中的沉积,减少Aβ导致的大鼠神经元损伤[19-20]。本研究发现,Aβ1-42可抑制PC12细胞中BDNF蛋白水平及其mRNA的相对表达量;芥子酸可改善Aβ1-42导致的PC12细胞BDNF蛋白水平及其mRNA相对表达量的降低,表明芥子酸可通过提高BDNF水平来降低Aβ1-42的细胞毒性从而起到保护细胞的作用。
目前研究认为,BDNF发挥保护神经细胞的作用机制可能是其与神经细胞表面特异性TrkB受体相结合,刺激细胞内信号转导,并启动相关生物学反应,对神经元的存活、分化、增殖及突出可塑性起到关键作用[21]。研究指出,BDNF/TrkB信号通路的异常可引起认知障碍,多奈哌齐可通过激活该信号通路改善AD模型大鼠的认知功能下降;此外,TrkB信号通路还能够抑制中间神经元内皮质抑制素的基因表达[22-24]。药理学研究发现,向大鼠海马组织注射Aβ1-42建立AD模型后,海马中Aβ1-42含量明显增加,TrkB蛋白表达明显降低,海马神经元受损、调亡[25]。本研究发现,Aβ1-42可导致PC12细胞TrkB蛋白表达降低,推测可能是由于细胞中BDNF蛋白表达下降,引起其结合性受体TrkB蛋白表达受到抑制,Aβ1-42的细胞毒性效应引起了失偿反应;而经芥子酸干预后,TrkB蛋白表达明显升高,说明随着BDNF蛋白水平的升高,其特异性结合受体TrkB蛋白的表达得以补偿性升高,表明芥子酸可以通过上调TrkB蛋白的表达而拮抗Aβ1-42诱导的细胞损伤。
BDNF与TrkB结合可进一步活化细胞内丝裂原活化蛋白激酶(MAPK)/ERK1/2及PI3K/Akt等下游信号通路,调控神经递质的合成和释放[26]。其中,ERK是学习和记忆形成信号转导通路中重要的信号分子,主要在神经元、胶质细胞中表达,激活ERK信号通路后,经三级级联反应进一步激活RSK,使得环磷腺苷效应元件结合蛋白磷酸化,对神经细胞增殖与分化、细胞形态维持产生重要作用[27-29]。相关研究证实,ERK通路被抑制后,神经细胞活性也会下降,神经功能损伤会随之加重,提示ERK信号通路的激活与神经保护有关[30]。本研究结果显示,Aβ1-42使p-ERK1/2蛋白的相对表达量及p-ERK/ERK比值均显著降低;使用高剂量芥子酸干预后,p-ERK1/2蛋白的相对表达量和p-ERK/ERK比值均显著升高,说明Aβ1-42干扰了细胞外信号转导通路。此外,模型组细胞中ERK1/2蛋白的相对表达量不变,但p-ERK1/2蛋白的相对表达量却明显降低;而芥子酸可通过促进磷酸化ERK1/2蛋白表达激活ERK信号通路,进而调控上游BDNF/TrkB信号通路,促进BDNF及其受体TrkB的表达,从而拮抗神经细胞的损伤、提高神经细胞活性。
综上所述,芥子酸可改善Aβ1-42诱导的PC12细胞损伤,其作用机制可能与激活BDNF/TrkB/ERK信号通路有关。本研究可为芥子酸作为新的神经元保护剂提供相关分子生物学依据,但其具体的作用靶点仍有待后续进一步研究。
参考文献
[ 1 ] ROYCHAUDHURI R,YANG M F,HOSHI M M,et al.Amyloid beta-proteinassembly and Alzheimer disease[J]. J Biol Chem,2009,284(8):749-753.
[ 2 ] FINDEIS M A. The role of amyloid beta peptide 42 in Alz- heimers disease[J]. Pharmacol Ther,2007,116(2):266- 286.
[ 3 ] CORREIA S C,RESENDE R,MOREIRA P I,et al. Alzheimers disease-related misfolded proteins and dysfunctional organelles on autophagy menu[J]. DNA Cell Bio,2015,34(4):261-273.
[ 4 ] BDLOCK R,TOUCHON J,BERGMAN H. Rivastigmine and donepezil treatment in moderate to moderately-severe [J]. Curr Med Res Opin,2005,8(21):1317-1327.
[ 5 ] 羅勤.治疗阿尔茨海默症新药:甘露特钠GV-971[J].健康生活,2020(1):48-49.
[ 6 ] ALEXANDER T,KAI M,NILS T,et al. A novelintegra- ted downstream processing approach to recover sinapic acid,phytic acid and proteins from rapeseed meal[J]. Chem Technol Biotechnol,2015,90(11):1999-2006.
[ 7 ] LEE H E,KIM D H,PARK S J,et al. Neuroprotective effect of sinapic acid in a mouse model of amyloid β1-42 protein-induced Alzheimers disease[J]. Pharmacol Biochem Behav,2012,103:260-266.
[ 8 ] KIM D H,YOON B H,JUNG W Y,et al. Sinapic acid attenuates kainic acid-induced hippocampal neuronal da- mage in mice[J]. Neuropharmacology,2010,59(1/2):20- 30.
[ 9 ] NUMAKAWA T,SUZUKI S,KUMAMARU E,et al. BDNF function and intracellularsignaling in neurons[J].Histol Histopathol,2010,25(2):237-258.
[10] GIRARDET C,LENBRUN B,CABIROL-POL M,et al.Brain-derived neurotrophic factor/TrkB signaling regulates daily astroglial plasticity in the suprachiasmatic nucleus:electron-microscopic evidence in mouse[J]. GLIA,2013,61(7):1172-1177.
[11] GANDY S. The role of cerebral amyloid β accumulation in common forms of Alzheimer disease[J]. J Clin Invest,2005,115(5):1121-1129.
[12] KRISHTAL J,BRAGINA O,METSLA K,et al. In situ fibrillizing amyloid-beta1-42 induces neurite degeneration and apoptosis of differentiated SH-SY5Y cells[J]. PLoS One,2017,12(10):e0186636.
[13] ZHANG J,ZHEN Y F,REN P B C,et al. Salidroside attenuates beta amyloid-induced cognitive deficits via modulating oxidative stress and inflammatory mediators in rat hippocampus[J]. Behav Brain Res,2013,244:70-81.
[14] 张乐国,朱翠敏,吴强,等. β-淀粉样蛋白1-42与颈部动脉粥样硬化及轻度认知障碍的相关性研究[J].世界复合医学,2019,5(5):19-21.
[15] 张照阳,范立华,蔡庆春. Hcy、淀粉样蛋白、TNF水平变化在阿尔茨海默病中的表达及意义[J].实验与检验医学,2019,37(5):925-927.
[16] CHEN Y J,HUANG X B,CHEN W Q,et al. Tenuigenin promotes proliferation and differentiation of hippocampal neural stem cells[J]. Neurochem Res,2012,37(4):771- 777.
[17] DINIZ B S,TEIXEIRA A L. Brain-derived neurotrophic factor and Alzheimers disease:physiopathology and beyond[J]. Neuromolecular Med,2011,13(4):217-222.
[18] WATERHOUSE E G,XU B J. New insights into the role of brain-derived neurotrophic factor in synaptic plasticity[J].Mol Cell Neurosci,2009,42(2):81-89.
[19] WU B W,WU M S,GUO J D. Effects of microRNA-10a on synapse remodeling in hippocampal neurons and neuronal cell proliferation and apoptosis through the BDNF- TrkB signaling pathway in a rat model of Alzheimers di- sease[J]. J Cell Physiol,2018,233(7):5281-5292.
[20] EREMENKO E,MITTAL K,BERNER O,et al. BDNF- producing,amyloid β-specific CD4 T cells as targeted drug-delivery vehicles in Alzheimers disease[J]. EBioMedicine,2019,43:424-434.
[21] LUO L,LIU X L,LI J,et al. Macranthol promotes hippocampal neuronal proliferation in mice via BDNF-TrkB- PI3K/AKT signaling pathway[J]. Eur J Pharmacol,2015,762:357-363.
[22] ZIELINSKI M R,KRUEGER J M. Sleep and innate immunity[J]. Front Biosci(Schol Ed),2011,3:632-642.
[23] ZHENG H,NIU S,ZHAO H,et al. Donepezil improves the cognitive impairment in a tree shrew model of Alz- heimers disease induced by amyloid-β1-40 via activating the BDNF/TrkB signal pathway[J]. Metab Brain Dis,2018,33(6):1961-1974.
[24] MAYNARD K R,KARDIAN A,HILL J L,et al. TrkB signaling influences gene expression in cortistatin-expressing interneurons[J]. eNeuro,2020,7(1):310-319.
[25] 张誉丹,袁德培,毛剑琴.基于BDNF/TrkB/CREB 途径探讨固本健脑液改善 AD大鼠海马区神经元损伤的内在机制[J].中药材,2020,43(9):2232-2237.
[26] LIU L,ZHANG R,LIU K,et al. Tissue kallikrein protect scortical neurons against in vitro ischemia-acidosis/reperfusion-induced injury through the ERK1/2 pathway[J].Exp Neurol,2009,219(2):453-465.
[27] EASTON J B,ROYER A R,MIDDLEMAS D S. The protein tyrosinephosphatase,SHP2,is required for the complete activation of the RAS/MAPK pathway by brain-derived neurotrophic factor[J]. J Neurochem,2006,97(3):834-845.
[28] PANDYA C D,KUTIYANAWALLA A,PILLAI A. BDNF- TrkB signaling and neuroprotection in schizophrenia[J].Asian J Psychiatr,2013,6(1):22-28.
[29] IRVING E A,BARONE F C,REITH A D,et al. Differential activation of MAPK/ERK and p38/SAPK in neruones and glia following focal cerebral ischemia in the rat[J].Brain Res Mol Brain Res,2000,77(1):65-75.
[30] GUO X,YUAN J,WANG J,et al. Calcitriol alleviates global cerebral ischemia-induced cognitive impairment by reducing apoptosis regulated by VDR/ERK signaling pathway in rat hippocampus[J]. Brain Res,2019,1724(1):146430.
(收稿日期:2020-12-14 修回日期:2021-04-20)
(編辑:邹丽娟)
