外源8
2021-07-11龚定芳孙杰赵萍萍胡忆
龚定芳 孙杰 赵萍萍 胡忆


摘要:本实验以高羊茅作为供试材料,研究了干旱胁迫下(25%PEG-6000)施加外源脱落酸(ABA)类似物8'-炔基脱落酸(8′-(C2H)ABA)后,对高羊茅抗旱性的影响。通过对高羊茅生长、相对电导率(REC)、相对含水率(RWC)、丙二醛含量(MDA)、超氧阴离子(O2—)、光合性能、抗氧化酶活性、渗透调节物质等的测定,初步探讨了8′-(C2H)ABA作用于高羊茅耐干旱胁迫的效应。结果表明:喷施8′-(C2H)ABA 和ABA均促进了干旱胁迫下高羊茅的生长,提高了叶片叶绿素含量以及RWC,同时也提高了高羊茅叶片中超氧物歧化酶(SOD)活性以及可溶性蛋白等渗透调节物质的含量,降低了REC及MDA、O2—含量,有效缓解了干旱胁迫对高羊茅植株造成的伤害。由此可见,喷施外源8′-(C2H)ABA诱导的防御信号可以通过调控体内酶活性降低MDA及O2—含量,提高RWC和叶绿素含量,有效缓解干旱造成的损伤,以增强高羊茅抗旱能力,且与ABA的效果类似,可作为ABA的替代物进行研究和应用。
关键词:8′-炔基脱落酸;干旱胁迫;高羊茅;生理特性
本文选用高羊茅为植物材料,通过PEG模拟干旱胁迫的方法:探究了叶面喷施8'-(C2H)ABA对25% PEG胁迫下高羊茅生长、相对电导率、丙二醛含量、光合性能、抗氧化酶活性、渗透调节物质等的影响,初步探讨了8'-(C2H)ABA作用于高羊茅耐干旱胁迫的效应,对比分析了8'-(C2H)ABA 和ABA对高羊茅抗干旱能力的差异性,旨在为8'-(C2H)ABA在植物抗干旱上的应用提供理论依据。
1 材料与方法
1.1 实验材料
实验选用高羊茅为实验对象,种植于实验室温室内,备实验用,温室最高/最低温度为24/20℃,光照时长为12 h/d。所施加的脱落酸(ABA,纯度为95%)购于上海源叶生物科技有限公司、ABA类似物(8'-(C2H)ABA,纯度为95%)购于武汉艾布斯生物科技有限公司,所用浓度皆为20 mg·L-1;施加方式皆为叶面喷洒,且在夜间进行。
1.2 实验设计
选用生长良好、长势基本一致的40天龄高羊茅幼苗,移至含有1/2 Hoagland溶液的锥形瓶中,并将其置于温室培养7天。待幼苗恢复正常生长,将幼苗移入250mL锥形瓶(10株/瓶)中,采用PEG6000模拟干旱胁迫,进行试验处理,即进行以下4个实验处理,具体如下:CK(1/2Hoagland营养液)、DS(25%PEG+1/2Hoagland营养液)、DS+ABA(20 mg/L ABA+25%PEG+1/2Hoagland营养液)、DS+8'-ABA(20 mg/L 8'-(C2H)ABA +25%PEG+1/2Hoagland营养液),每个处理 4个重复。ABA及其类似物8'-(C2H)ABA喷洒处理以叶片湿润而不滴水为限,且在开始进行干旱胁迫的当晚进行。处理7天后分别测定高羊茅叶片的叶绿素含量,相对含水率,相对电导率,丙二醛(MDA),超氧阴离子(O2—),可溶性蛋白质,可溶性糖,主要抗氧化酶(SOD、POD、CAT)等相关指标。
1.3 项目测定方法
高羊茅叶片中叶绿素含量采用手持式叶绿素荧光仪SPAD-502进行测定,相对电导率(REC)采用电导仪法测定,相对含水率(RWC)和超氧阴离子(O2—)的测定参照聂坚等方法进行。丙二醛(MDA)含量采用硫代巴比妥酸法(TBA)法测定,参照李合生等的方法进行测定。
蛋白质及其各抗氧化酶活性的前处理提取方法相同,方法过程:称取0.2~0.3g新鲜植物叶片,加入3 ml预冷的50 mmol/L且含有1 mmol/L EDTA和2% PVP的磷酸缓冲液(pH 7.4),在冰浴条件下研磨至匀浆,转至离心管中,再用2ml清洗研钵并倒入离心管中,在4℃条件下8 000 r/min离心10 min,取上清液用来测定蛋白质含量、SOD、POD、CAT酶的活性。
蛋白质含量的测定采用考马斯亮蓝G-250法,参照李合生等的测定方法进行。采用试剂盒(南京建成生物技术有限公司)对样品中抗氧化酶(SOD、POD、CAT)活性进行分析测定,具体操作按照说明书进行。
1.4 数据处理
Excel2010进行数据处理,图表中数据为平均值±标准差,SPSS20.0进行误差分析,利用Origin9.0软件进行作图。
2 结果与分析
2.1 高羊茅生长状况
高羊茅遭受干旱胁迫后展现出不同的生长状况,未受干旱处理的高羊茅生长正常,当遭受干旱胁迫后,生长受阻变慢,植株矮小且叶片随着干旱程度的加深逐渐卷曲;而DS+8'-ABA和DS+ABA组的高羊茅草植株生长情况好于DS组。结果说明,8'-(C2H)ABA和ABA能够一定程度地提高高羊茅的耐旱性。
由图1可知,干旱胁迫7天后,高羊茅叶片的相对含水量均有下降的趋势。与对照组(CK)相比,干旱处理(DS)明显降低了高羊茅相对含水量,而DS+8'-ABA和DS+ABA处理使高羊茅的相对含水量高于DS组,分别较DS处理提高了6.1%、7.4%(P<0.05)。此结果说明,高羊茅遭受干旱胁迫后相对含水量有所下降,而8'-(C2H)ABA和ABA则降低了下降速度,使高羊茅的相对含水量高于干旱组。说明在干旱条件下,8'-(C2H)ABA和ABA均能降低高羊茅葉片水分的散失,保持叶片较高的相对含水量,维持其生理生化的正常运转,从而增强其抗旱能力。
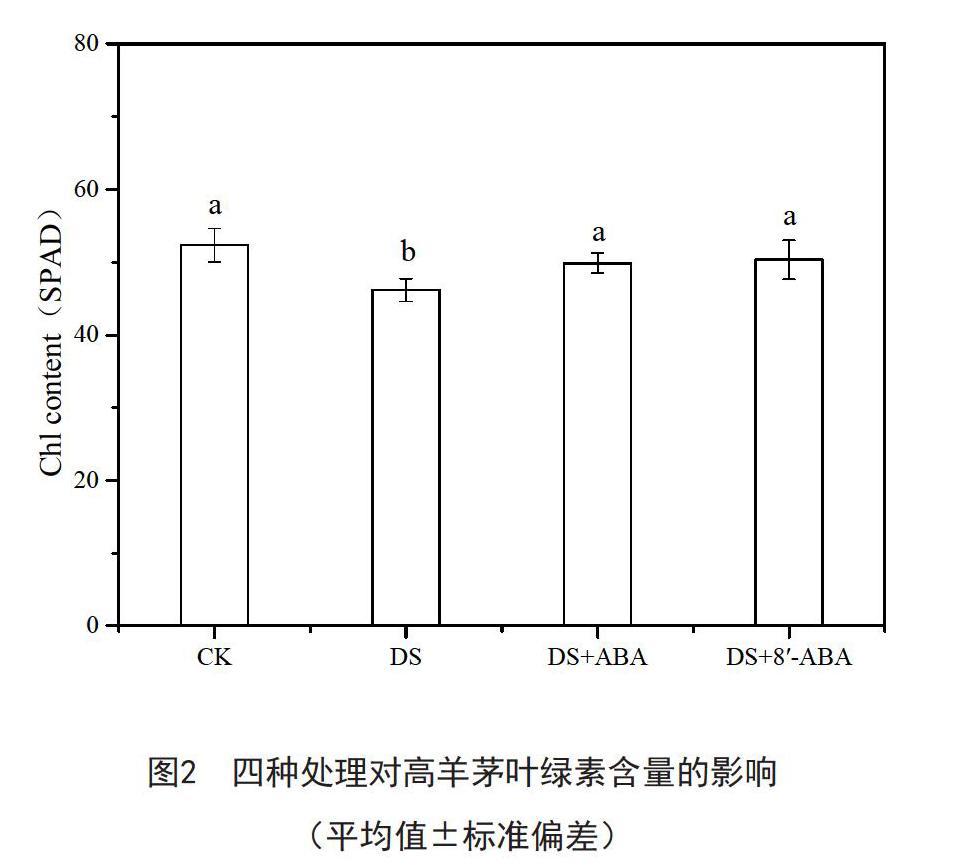
2.2 高羊茅叶绿素含量的变化
8'-(C2H)ABA和ABA处理对干旱胁迫下高羊茅叶绿素含量的影响如图2所示。干旱处理7天后,高羊茅叶绿素含量明显下降,而DS+8'-ABA和DS+ABA处理与DS均提高了叶绿素含量,使叶绿素含量较DS分别增加了9.0%、8.1%。结果说明,干旱胁迫使叶绿素含量降低,而8'-(C2H)ABA和ABA处理提高了干旱条件下叶绿素含量,从而促进高羊茅生长,降低了干旱对高羊茅的损害,说明适量的8'-(C2H)ABA和ABA能一定程度地提高高羊茅的抗旱能力。
2.3 高羊茅叶片中丙二醛含量的变化
由图3可知,干旱胁迫下,高羊茅叶片中丙二醛(MDA)的含量明显增加,DS较CK增加了2.2倍,而DS+8'-ABA和DS+ABA处理则明显降低了高羊茅叶片中MDA的含量,且较DS分别降低了40.6%、53.1%(P<0.05)。以上结果表明干旱处理使高羊茅发生氧化胁迫,造成氧化损伤,导致MDA含量增加,但8'-(C2H)ABA和ABA处理可以降低氧化损伤的程度使MDA含量降低,从而使高羊茅抗干旱能力增强。
在干旱胁迫的环境中,植物细胞会积累大量的活性氧,导致植物细胞发生膜脂过氧化,MDA是膜脂过氧化的产物之一,其含量的多少可以反映植物遭受伤害的程度。在本实验中,高羊茅在干旱胁迫的作用下,其体内MDA水平呈上升的趋势,这说明了干旱胁迫对高羊茅的细胞膜造成了一定的伤害;但经8'-(C2H)ABA和ABA处理后,MDA水平整体上升的趋势降低,说明了8'-(C2H)ABA和ABA能够缓解干旱对高羊茅的伤害程度,使其抗旱能力增强。
2.4 高羊茅叶片中超氧阴离子含量的变化
植物正常生理代谢过程中会产生自由基,而植物本身的抗氧化系统能及时地清除自由基以保持其在体内的相对稳定,高羊茅叶片中超氧阴离子(O2—)含量的变化如图4所示。正常生长条件下,高羊茅体内存在一定含量的O2—;当干旱处理7天后,高羊茅体内的抗氧化系统无法清除掉过量积累的O2—,DS处理使其增加了43.5%(P<0.05);DS+8'-ABA和DS+ABA处理使高羊茅体内的O2—含量明显降低,较DS分别降低了14.7%、19.8%(P<0.05)。结果说明,ABA 和8'-(C2H)ABA处理降低了干旱条件下高羊茅体内过量积累的O2—,缓解了干旱对高羊茅带来的氧化损伤,从而进一步说明ABA 和8'-(C2H)ABA能够提高高羊茅的抗旱能力。
2.5 高羊茅叶片中渗透调节物质的变化
可溶性糖、可溶性蛋白质是植物体内重要的三种渗透调节物质,植物体内渗透调节物质的积累是植物响应干旱胁迫最常见的反应之一,植物对干旱的重要生理适应方式就是渗透调节。干旱处理和8'-(C2H)ABA处理对高羊茅叶片中渗透调节物质可溶性糖和可溶性蛋白质的影响如图5、6所示。
由图5可知,处理7天后,DS处理降低了高羊茅叶片中蛋白质含量,而DS+8'-ABA和DS+ABA处理均能提高蛋白质的含量以响应干旱胁迫,一定程度提高其抗旱能力。这说明一定浓度的外源ABA 和8'-(C2H)ABA均能提高渗透调节物质蛋白质的含量,维持体内渗透压,有助于细胞或组织吸水,从而进一步提高其抗旱能力。
由图6可知,DS处理的高羊茅叶片中可溶性糖的含量增加,较CK增加了36.1%(P<0.05)。DS+8'-ABA和DS+ABA处理使干旱条件下高羊茅叶片中可溶性糖的含量均降低,较DS分别降低了21.2%、45.4%(P<0.05),且DS+8'-ABA处理低于CK。实验结果表明,虽然8'-(C2H)ABA和ABA处理均降低了干旱條件下可溶性糖的含量,但DS+8'-ABA和DS+ABA处理之间存在明显差异,还需进一步研究。
3 讨论
干旱胁迫作为一种非生物胁迫,影响着植物生理代谢的各个方面。干旱其诱导的化学信号中,ABA是主要的化学信号,通常在植物根部合成,并运输到叶片中调节气孔关闭,或在叶片中快速生物合成并对气孔关闭做出反应。ABA介导气孔关闭并消除胁迫条件的限制,以调节植物生长和发育。ABA能通过多种途径来完成对植物抗逆性的调节作用,如提高植物体内渗透物质的含量和酶活性,或者直接调节相关抗旱基因表达等,但无论是哪种途径都表明ABA可以作为一种防御信号提高植物的抗逆性。ABA在植物应对干旱、寒害、盐害等胁迫环境时起着重要的作用。大量研究表明,施加一定的外源物质(如脱落酸、水杨酸、茉莉酸甲酯等)可增强植物对氮、磷、钾等营养元素的吸收,以促进植物正常生长发育,缓解干旱对植物造成的伤害。
相对电导率是反映植物抗逆能力的一个重要生理指标,当处于干旱等逆境环境时,植物细胞膜会受到一定程度的损害,使植物体内的细胞膜透性发生变化,细胞质外渗,从而使电解质的浓度也不断增加,导致相对电导率呈向上的趋势。目前,研究植物的抗逆能力比较常用的一种生理指标就是相对电导率,其高低在一定程度上反映了植物抵御干旱胁迫的能力。本试验中,在干旱胁迫下,对经过外源浓度为20mg/L的8'-(C2H)ABA和ABA处理过的高羊茅植物进行测定发现,经过外源8'-(C2H)ABA和ABA处理过的高羊茅植物相比未经处理的高羊茅,均能明显降低相对电导率,说明外源8'-(C2H)ABA与ABA一样,能够有效地增强高羊茅植物在干旱胁迫下的抗旱能力。
光合作用是植物生长发育的主要物质能量来源,植物要进行光合作用,叶绿素是必不可少的,其含量的高低严重影响着光合作用的效率,对植物光合作用具有重要意义。叶绿素含量能在一定程度上反应植株光合能力的强弱,而光合作用的强弱会直接影响植株生物量积累的多少。MDA 含量的高低反映了细胞膜脂过氧化的强弱和脂膜破坏程度,而抗氧化酶活性的高低是细胞抗逆能力的强弱指标之一。植物体内清除 ROS的SOD、POD 和 CAT这三种酶能够防御活性氧自由基对细胞膜的伤害,抑制膜脂过氧化。本研究中,在干旱条件下,8'-(C2H)ABA与ABA处理后的高羊茅叶绿素含量增加,使光合能力增强,长势更佳,生物量得以增加;同时高羊茅植株细胞内抗氧化酶活性显著增强,明显抑制了细胞内ROS含量的积累,防止膜脂过氧化,使得细胞中MDA的含量下降,从而减轻了细胞膜脂过氧化损伤程度,这些变化使高羊茅能更好地适应干旱环境,该结果与前人的研究结果相一致。将8'-(C2H)ABA与ABA对比发现,8'-(C2H)ABA与ABA效果一致,同样能够增强高羊茅适应干旱能力。
4 结论
本实验研究了在干旱胁迫的条件下,通过PEG模拟干旱胁迫的方法,外源施加一定浓度的8'-(C2H)ABA和ABA对高羊茅抗旱能力的影响。在干旱胁迫下,通过叶面喷施8'-(C2H)ABA能够提高高羊茅叶片中过氧化物酶(POD)、超氧化物歧化酶(SOD)的活性、增加可溶性蛋白质含量、降低丙二醛(MDA)和超氧阴离子(O2—)含量以及降低相对电导率、提高叶片相对含水率和叶绿素含量等,明确外源8'-(C2H)ABA提高高羊茅抗旱性的生理机制,为减轻干旱对高羊茅的危害、增强高羊茅的耐旱性提供理论依据。通过与ABA进行对比发现,8'-(C2H)ABA稳定性好、生产成本低,且具有与ABA在增强高羊茅抗旱性方面相似的效果,能够在植物抗干旱方面作为ABA的替代物进行进一步研究和应用。
参考文献
[1] 江生泉,杨志民,程建峰.不同品种高羊茅种子吸水特性研究[J].云南农业大学学报(自然科学),2018,33(3):474-479.
[2] 岳鹏鹏,纪晓玲,张静,等.保水剂对高羊茅种子萌发的影响[J].江苏农业科学,2014,42(4):144-145.
[3] 赵丽丽,吴佳海,陈瑩,等.干旱对高羊茅生理特性的影响及抗旱性评价[J].中国草地学报,2015,37(4):15-20.
[4] 唐晓梅,王艳,马东伟,等.干旱胁迫下高羊茅基因组甲基化分析[J].草业学报,2015,24(4):164-173.
[5] 赵状军,胡龙兴,胡涛,等.不同品系高羊茅应答高温胁迫的初级代谢产物分析[J].草业学报,2015,24(3):58-69.
[6] 李学玲,庞海颖,牛东伟,等.不同外源激素对李花抗寒性及相关生理指标的影响[J].北方园艺,2017(11):17-22.
[7] 魏鑫,倪虹,张会慧,等.外源脱落酸和油菜素内酯对干旱胁迫下大豆幼苗抗旱性的影响[J].中国油料作物学报,2016,38(5):605-610.
[8] 胡志群,冯学兰,吴楚彬,等.脱落酸和细胞分裂素对香根草抗旱性的影响[J].草地学报,2015,23(6):1220-1225.
[9] 王一静.不同外源激素处理对库尔勒香梨抗寒生理变化的研究[D].新疆:新疆农业大学,2015.
