基于KDSR基因探究花旗泽仁改善HepG2细胞胰岛素抵抗机制研究
2021-07-09陈思琦李佳欣葛鹏玲
陈思琦,李佳欣,葛鹏玲
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
糖尿病(diabetes mellitus,DM)是一种多病因的代谢性疾病,其特征是由于胰岛素释放紊乱、胰岛素作用失调或两者兼而有之造成的慢性高血糖[1]。2型糖尿病(type 2 diabetes mellitus,T2DM)占糖尿病的90%以上,目前认为T2DM的主要发病机制为胰岛素抵抗(insulin resistance,IR),IR贯穿了2型糖尿病发生发展的全过程[2-3],同时也是高血压、冠心病、动脉硬化、肥胖等多种疾病共同联系的病理基础。神经酰胺(ceramides,Cer)是鞘脂(sphingolipid,SPL)的重要中间代谢产物,对鞘脂类的生物合成具有重要意义[4]。近年来研究表明[5],神经酰胺代谢异常参与胰岛素抵抗等疾病的病理生理过程,神经酰胺可通过抑制Akt 磷酸化从而影响胰岛素信号通路,进而导致胰岛素抵抗的发生。
在前期研究中,我们发现IR细胞中KDSR(3-ketodihy-drosphingosine reductase,3-酮二氢鞘氨醇还原酶)基因表达上调,且通过调控神经酰胺/PKCζ/Akt/Foxo1信号通路而引发IR。花旗泽仁是治疗2型糖尿病胰岛素抵抗疗效确切的临床经验方,包括西洋参、泽泻、薏苡仁三味中药,本课题组前期已证实花旗泽仁具有明显的改善胰岛素抵抗的作用,本文以前期研究为基础,从KDSR基因角度探讨花旗泽仁改善IR的作用机制。
1 材料
1.1 HepG2细胞系HepG2人肝癌细胞株(FH0067),购于上海中医药大学,保存于黑龙江中医药大学方剂学重点实验室。
1.2 试剂西洋参(批号:120997)、泽泻(批号:020001421)和薏苡仁(批号:17052009)购于河北润和医药有限公司,罗格列酮(批号:122320-73-4)购于阿拉丁试剂(上海)有限公司;KDSR过表达质粒由通用生物系统有限公司提供;β-actin由英国Abcam公司提供;KDSR抗体、PKCζ抗体、p-PKCζ抗体、Akt2抗体、p-Akt2抗体、Foxo1抗体、p-Foxo1抗体由美国CST公司提供;神经酰胺C14(d18 ∶1/14 ∶0)标准品、神经酰胺C16(d18 ∶1/16 ∶0)标准品、神经酰胺C17标准品、神经酰胺C18 ∶1(d18 ∶1/18 ∶1(9Z))标准品、神经酰胺C18(d18 ∶1/18 ∶0)标准品、神经酰胺C20(d18 ∶1/20 ∶0)标准品、神经酰胺C24 ∶1(d18 ∶1/24 ∶1(15Z))标准品、神经酰胺C24(d18 ∶1/24 ∶0)标准品由美国Avanti Polar Lipids公司提供;GOD-POD检测试剂盒购于北京雷根生物有限公司。
1.3 仪器超净工作台(北京泸净净化设备厂);恒温CO2培养箱(美国Thermo Fisher公司);生物安全柜SCB-1360(北京东联仪器制造公司);电泳仪(美国BIO-RAD公司);紫外分光光度计(岛津有限公司);半干转膜仪(美国BIO-RAD公司);酶标仪(日本Olympus公司);IX70倒置显微镜(日本Olympus公司);ISO134083冻干机(美国Agilent公司);安捷伦1290超高效液相色谱(美国Agilent公司);安捷伦6460三重四级杆串联质谱(美国Agilent公司);正压装置(美国Waters公司);涡旋仪器(德国Eppendorf公司)。
2 方法
2.1 HepG2细胞的培养500 mL高糖培养基(DEME)中加入10%胎牛血清(FBS),以及1%青霉素-链霉素混合液,摇匀,4 ℃保存备用。从-192 ℃的液氮罐中取出细胞,迅速放入37 ℃水浴锅中快速摇晃复苏。加入2 mL混合好的DMEM培养基,以37 ℃,5% CO2的条件培养备用。
2.2 胰岛素抵抗模型的建立根据本课题组前期对HepG2细胞胰岛素抵抗(IR)模型建立条件的模索,利用高糖高胰岛素处理HepG2细胞,诱导其产生胰岛素抵抗。向配制好的高糖培养基中加入10-10mol·L-1胰岛素,混匀,培养HepG2细胞48 h,使其发展成IR模型,胰岛素作用时间、浓度及模型的稳定性在本课题组前期工作中已验证。
2.3 花旗泽仁冻干粉的制备取花旗泽仁各中药西洋参15 g、泽泻15 g、薏苡仁30 g,浸泡12 h,第一次加12倍水煎煮,水沸后文火煎煮60 min;第二次加8倍水煎煮,水沸后继续用文火煎煮45 min,第三次加6倍水,水沸后文火煎煮30 min,合并三次水煎液,过滤后水浴浓缩至每毫升含生药量1 g,采用冷冻干燥机真空冷冻干燥而成。4 ℃保存,使用前水浴加温至37 ℃。
2.4 花旗泽仁的给药剂量本课题组前期对花旗泽仁在HepG2胰岛素抵抗细胞模型上的给药剂量及作用时间进行摸索,得出花旗泽仁最佳给药浓度为1/9 g·L-1,作用时间为24 h。
2.5 阳性对照药罗格列酮的准备实验前称取罗格列酮粉末,加蒸馏水配制成所需浓度0.04 g·L-1的溶液。4 ℃保存,使用前取出,达到常温后使用。
2.6 KDSR过表达质粒的合成与转染由通用生物系统(安徽)有限公司针对人KDSR基因,根据人工构建的方式在目的基因上游加入调控元件,合成特异性KDSR基因过表达质粒(KDSR-OE),以腺病毒包裹,冷冻保存,同时制备未包裹过表达质粒的腺病毒(NC)。
2.7 超高效液相色谱-质谱联用技术
2.7.1母液的配置 分别精密称取神经酰胺C14、C16、C17、C18 ∶1、C18、C20、C24 ∶1、C24标准品适量,并用异丙醇定容至1 g·L-1,所有母液均贮存在-20 ℃条件下备用。
2.7.2工作溶液的配制 将上述标准品溶液采用10%甲醇稀释得到上述标准品溶液的浓度:C14、C24 ∶1和C24为6.25 mg·L-1;C16和C18 ∶1为 3.125 mg·L-1;C18和C20为12.5 mg·L-1。内标(C17)由蛋白沉淀剂配置而成,浓度为 100 μg·L-1。
2.7.3标准曲线和质控样本溶液的配制 利用上述工作溶液与0.5×PBS 溶液(模拟基质)配制标准曲线溶液,标准曲线溶液为七个等级,各个物质的标准曲线浓度范围在本课题组前期实验中已完成测定。质控样本在分析前新鲜配制,分为低、中、高三个等级,每个等级分别对应标准曲线的第2、4、6浓度点。
2.7.4色谱与质谱条件 有机相和水相中同时加入0.2%的甲酸以保证洗脱系统中pH值恒定。神经酰胺C17作为内标:流动相为含有0.2%甲酸的甲醇和0.2%甲酸的水相,流速为0.3 mL·min-1,柱温设置在30 ℃。所选质谱柱为 waters Xbrige BEH C18(2.1×50 mm,2.5 μm)。分别精密称取神经酰胺C14,C16,C17,C18 ∶1,C18,C20,C24 ∶1,C24标准品适量,并用异丙醇定容至 1 g·L-1,所有母液均贮存在-20 ℃条件下备用。
液相洗脱梯度如Tab 1所示。
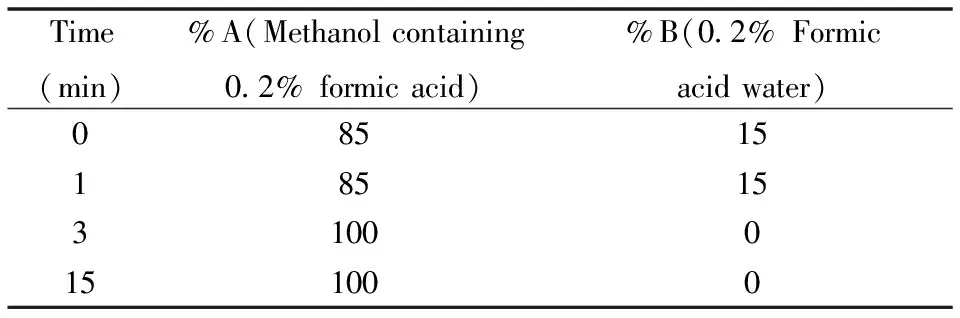
Tab 1 Liquid phase conditions of HPLC-MS/MS
采用电喷雾离子化源,干燥气温度为350 ℃,鞘流气温度为325 ℃,采用多反应监测(MRM)模式对待分析化合物进行监测。具体MS参数如Tab 2所示。
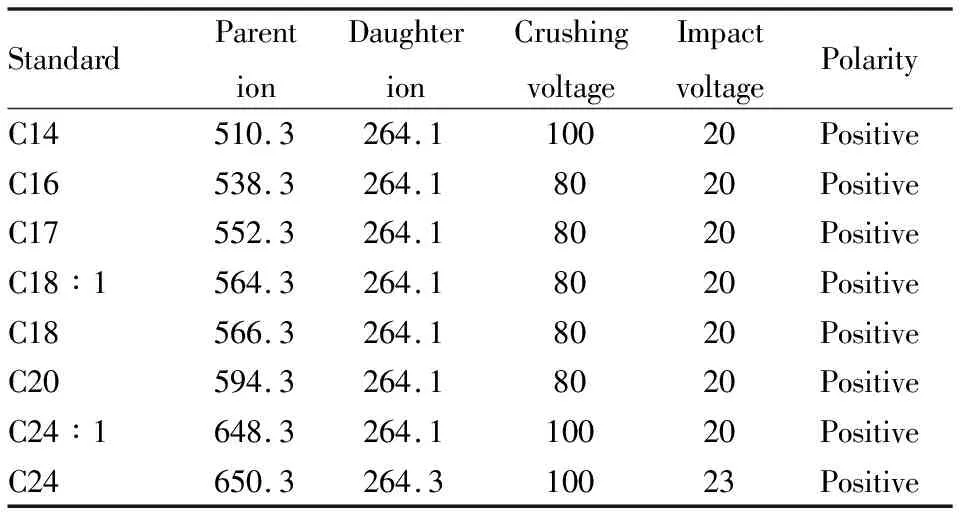
Tab 2 Mass spectrum conditions
2.7.5样品处理 将研究样品(100 μL)转移到EP管中。向每个管中添加蛋白质沉淀溶液(400 μL),蛋白沉淀剂为异丙醇-氯仿(9 ∶1),涡旋振荡3 min,以3 000×g离心10 min,然后将250 μL上清液转移到干净的进样小瓶中,并进行LC-MS/MS分析。本研究采用0.5×PBS的作为空白样品作为对照,排除基质的干扰。
2.7.6方法专属性 分别配制空白溶液、标准品溶液、待测样品,同“样品处理”方法操作后,进样分析,对比空白溶液、含有混合对照品的肠菌液和待测样品色谱图。观察待测组分和内标物的出峰位置。
2.7.7标准曲线的制备 在本研究中,标准曲线包括7个水平,标准曲线样本经过样本前处理方法处理分析后,以待分析化合物的质谱相应值与对应内标的质谱响应值的比值为因变量,以待测化合物的浓度为自变量进行分析。标准曲线在本课题组前期工作中已完成测定。
2.7.8精密度和准确度的测定 取3个浓度的QC样本,经过样本前处理后进样分析,并连续3 d平行配制,进样后通过标准曲线计算浓度。计算每日(日内)和3 d(日间)样本的测定结果精密度,以变异系数(CV)表示,应小于15%;准确度通过真实值和标示量的差异进行计算,以相对误差表示(RE),应小于±15%。
2.7.9提取回收率和基质效应 配制低、中、高浓度的质控样本,经过既定的前处理方法进行处理,经过进样分析得到待测化合物的响应值为A;取空白0.5×PBS样本进行前处理,加入标准品水溶液制备和QC样本浓度一致的溶液,进样分析,得到待测化合物的响应值B;取标准品水溶液,制备和QC样本浓度相同的溶液,进样分析,得到待测化合物的响应值C,A与B的比值即为提取回收率,B与C的比值为基质效应。
2.7.10样品检测 分别取各组样品,按“2.7.5样品处理”方法制备供试品溶液,依照上述方法进行检测,记录各色谱峰面积,代入标准曲线,计算样品各成分的含量。
2.8 实时荧光定量PCR倾倒培养液,加入PBS溶液洗涤细胞,滴加Trizol溶液反复吹打,室温放置5 min;离心取上层清液并转移至离心管,加入氯仿溶液,涡旋振荡,常温放置5 min;12 000×g离心15 min。将上层透明水相取出滴加异丙醇混匀,室温静置;离心去上清液,加入70%乙醇涡旋混匀,离心弃上清,室温下干燥10 min;滴入失活水溶解,-80 ℃低温存放。根据试剂盒说明书所述步骤进行试验。
2.9 蛋白印迹法洗涤细胞后加入细胞裂解液(1 mL RIPA+10 μL PMSF+10 μL蛋白酶抑制剂+10 μL磷酸酶抑制剂)使细胞充分裂解;4 ℃ 12 000 r·min-1离心15 min;配制分离胶及浓缩胶,用微量进样器加待测样品及Maker;以电压80 V开始电泳;电泳结束后,取出凝胶放入转膜液中,将准备好的PVDF膜先放入甲醇中30 s,后转移到转膜液中,恒流转膜45-50 min;放入装有适量的5%牛奶封闭液的平皿中封闭1 h;洗膜3次;分别将一抗,即KDSR抗体、PKCζ抗体、p-PKCζ抗体、Akt2抗体、p-Akt2抗体、Foxo1抗体以及p-Foxo1抗体用TBST稀释比例为1 ∶1 000,将PVDF膜放入一抗中4 ℃过夜;洗膜3次;将二抗用TBST稀释比例为1 ∶5 000,将PVDF膜放入二抗中37 ℃,孵育1 h;洗膜3次;显影拍照。
2.10 葡萄糖检测试剂盒配置好GOD-POD工作液,将标准品按梯度依次稀释到2.5,1.25,0.625,0.3 125,0.15 625 mmol/L。取上述各组处理后的细胞适量(>106),离心保留细胞沉淀,加入200 μL 1% Triton X-100冰上裂解30 min。设立空白组,标准组和样品组,统一加入300 μL GOD-POD工作液,空白孔加入dd H2O,标准组分别加入上一步配置好的标准品,样品组加入需测定的样品,充分混匀,37 ℃孵育15 min。用酶标仪测定505 nm处的吸光度(OD值),以空白孔调零,读取标准组,样品组的吸光度,根据标准组绘制标准曲线,根据标准曲线计算样品组的样品浓度,再根据葡萄糖含量换算公式计算葡萄糖含量。
3 结果
3.1 花旗泽仁对KDSR基因及蛋白表达的影响
3.1.1花旗泽仁可降低KDSR mRNA的高表达 qRT-PCR实验结果如Fig 1所示,与对照组相比,IR细胞中KDSR mRNA表达较高,与IR组相比,给予花旗泽仁后IR细胞中KDSR表达明显下降,差异具有显著性(P<0.01);于正常HepG2细胞中过表达KDSR(KDSR-OE)后给予花旗泽仁,与KDSR-OE组相比,KDSR表达也存在一定程度的下降,差异具有显著性(P<0.01)。综上,花旗泽仁可降低KDSR基因的高表达。
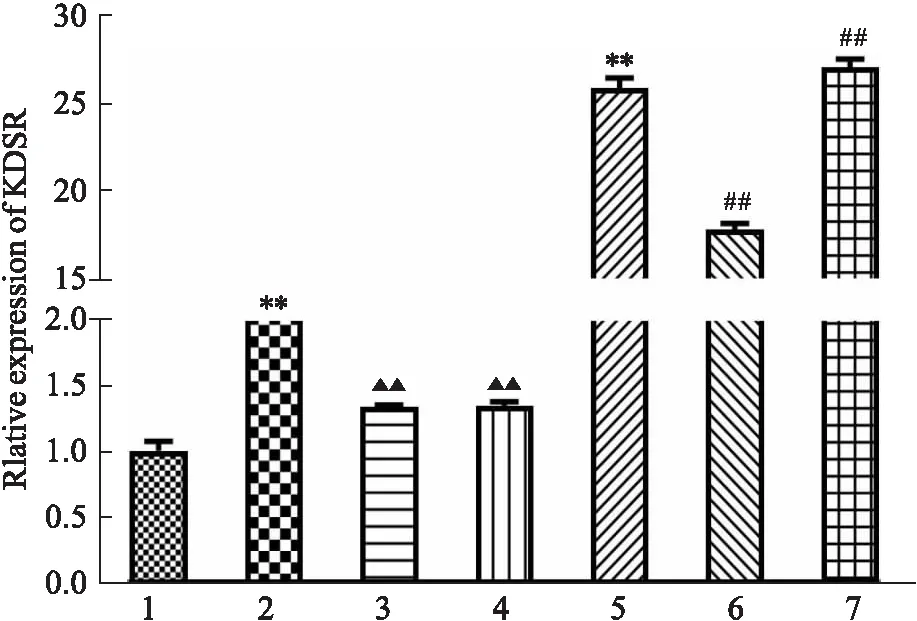
Fig 1 Effect of Huaqizeren on KDSR mRNA expression
3.1.2花旗泽仁可降低KDSR 蛋白的高表达 结果如Fig 2(A、B)所示,与对照组相比,IR细胞中KDSR蛋白表达上调,与IR组相比,给予花旗泽仁后IR细胞中KDSR蛋白表达有所下降,差异具有显著性(P<0.01);转染KDSR-OE的正常HepG2细胞中KDSR蛋白上调,给予花旗泽仁后KDSR蛋白表达量有所下降,差异具有显著性(P<0.01),故花旗泽仁可降低KDSR蛋白的高表达。

Fig 2 Effect of Huaqizeren on KDSR protein expression
3.2 花旗泽仁对细胞神经酰胺含量的影响利用HPLC-MS/MS技术检测各组神经酰胺各单体及总神经酰胺含量,结果如Tab 3、Fig 3所示,与IR组相比,给药花旗泽仁后细胞总神经酰胺含量明显下降,且与空白组接近,差异具有显著性(P<0.01);而当KDSR-OE组给予花旗泽仁后,细胞神经酰胺含量也有一定程度下降,且差异具有显著性(P<0.01)。故花旗泽仁可降低IR细胞中神经酰胺含量。
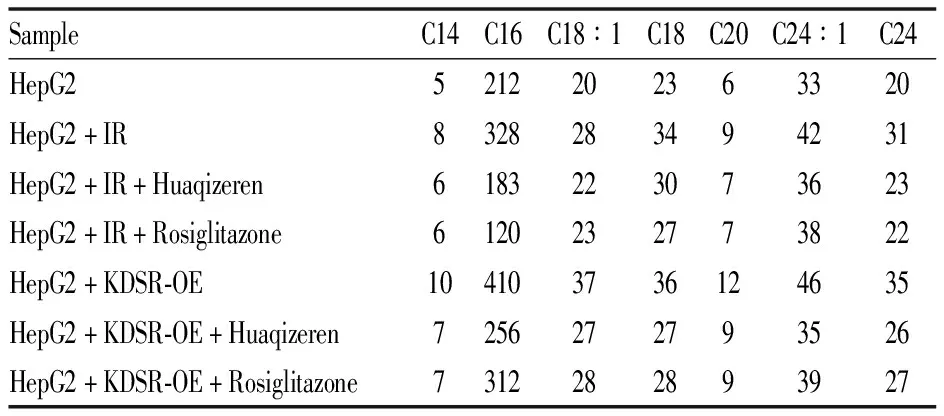
Tab 3 Contents of ceramide in different samples(μg·L-1)
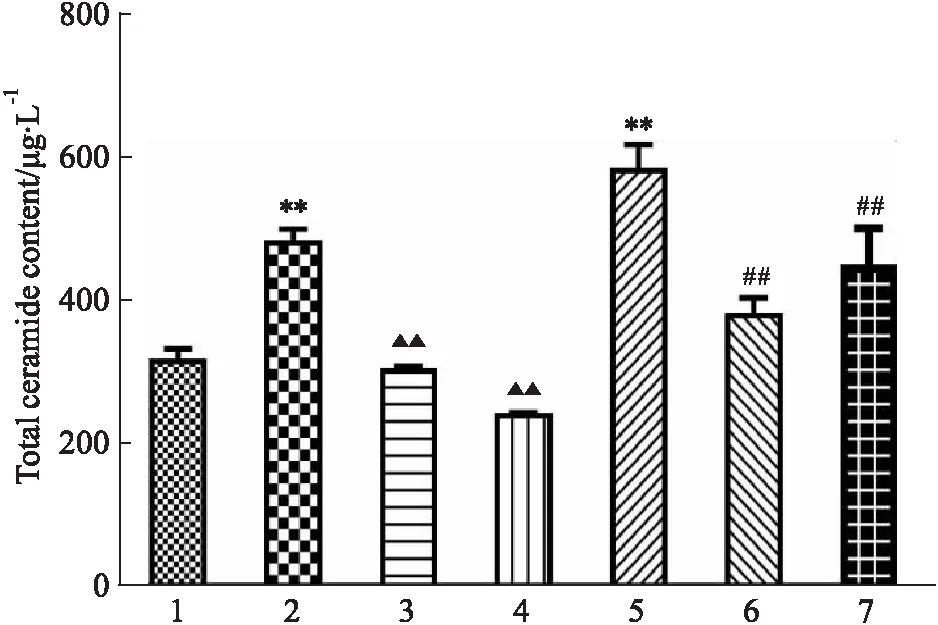
Fig 3 Total ceramide content in cells of each group
3.3 花旗泽仁对神经酰胺通路PKCζ/Akt/Foxo1的影响Western blot结果显示,如Fig 4、5、6(A、B)所示,与对照组相比,IR细胞中PKCζ磷酸化水平上调、Akt2磷酸化水平下降、Foxo1磷酸化水平上升,差异具有显著性(P<0.01);与IR组相比,给药花旗泽仁后PKCζ磷酸化水平下降、Akt2磷酸化水平上升、Foxo1磷酸化水平下降,差异具有显著性(P<0.01);与对照组相比,正常HepG2细胞中转染KDSR-OE后PKCζ磷酸化水平上调、Akt2磷酸化水平下降、Foxo1磷酸化水平上升,差异具有显著性(P<0.01);转染KDSR-OE后给予花旗泽仁,PKCζ磷酸化水平下降、Akt2磷酸化水平上升、Foxo1磷酸化水平下降,差异具有显著性(P<0.01)。故花旗泽仁可改善IR细胞中神经酰胺通路PKCζ/Akt/Foxo1过度激活的状态。
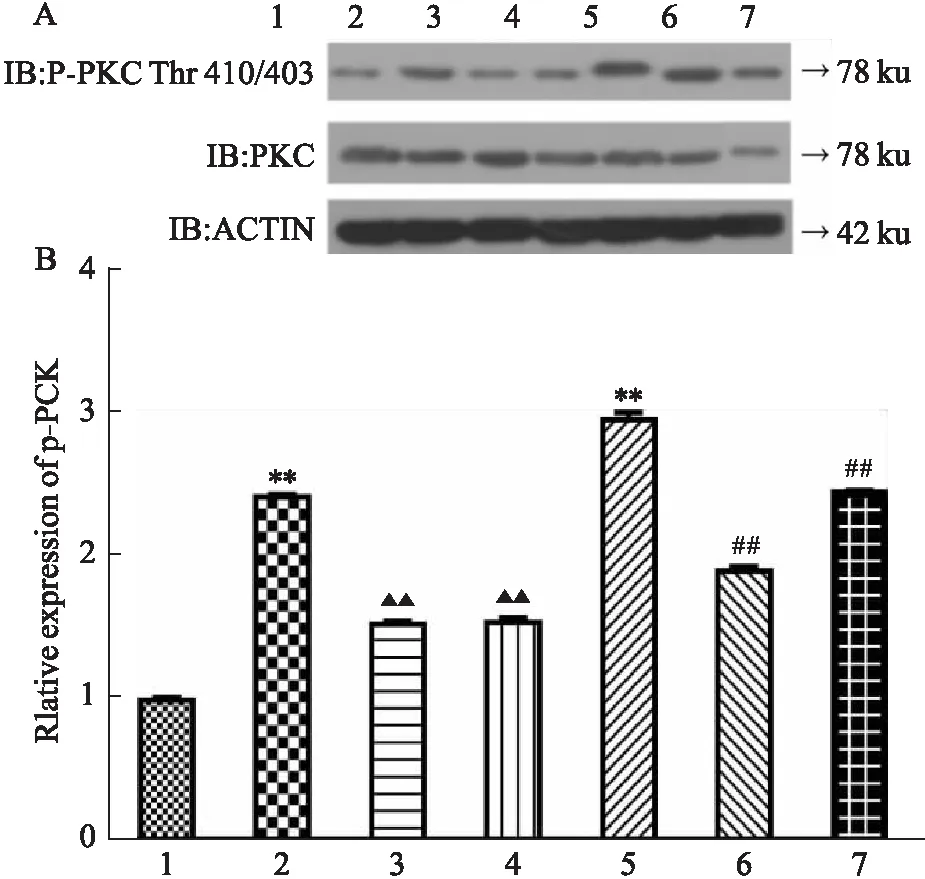
Fig 4 Effect of Huaqizeren on PKC zeta phosphorylation level

Fig 5 Effect of Huaqizeren on AKT2 phosphorylation level
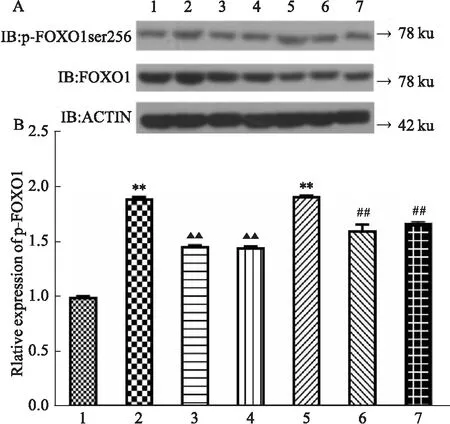
Fig 6 Effect of Huaqizeren on FoxO1 phosphorylation
3.4 花旗泽仁对细胞葡萄糖消耗的影响我们采用花旗泽仁浓度为1/9 g·L-1进行给药,并以0.04 g·L-1罗格列酮作为阳性对照药,检测细胞葡萄糖含量。结果如Fig 7所示,与对照组相比,IR细胞中葡萄糖含量明显升高,差异具有显著性意义(P<0.01);与IR组相比,给药花旗泽仁后IR细胞葡萄糖含量明显下降,且与空白组接近,差异具有显著性意义(P<0.01);根据本课题组前期研究所得结果可知,KDSR-OE可提高细胞葡萄糖含量至IR程度,而当KDSR-OE组给予花旗泽仁后,细胞葡萄糖含量也有一定程度下降,且差异具有显著性意义(P<0.01)。故花旗泽仁可在一定程度上降低IR细胞中葡萄糖含量,改善细胞胰岛素抵抗状态。

Fig 7 Effect of Huaqizeren on cell glucose content
4 讨论
胰岛素抵抗(IR)是2型糖尿病的病理基础和主要特征,也是高血压、高脂血症、冠心病等疾病的主要病因[7]。研究表明[8],多种中药及其有效成分通过减弱IR在治疗2型糖尿病中发挥重要作用,已成为近年来防治IR的研究热点。中药复方花旗泽仁为临床治疗2型糖尿病IR的有效经验方,其治疗病症明确,药物疗效确切,主要活性成分相对清楚。本方基于中医药整体观念和辨证论治的理论,从2型糖尿病IR脾虚湿盛,湿热内蕴的病理特点出发,以补气养阴、清火生津之功的西洋参为君药,渗湿健脾的薏苡仁为臣药,利水渗湿、泄热之泽泻为佐药,配伍组成花旗泽仁中药复方,共奏补气、健脾、生津、清热、利湿之功。本课题基于中医药对IR的防治作用,探讨花旗泽仁改善IR的作用机制。
本课题组前期已进行了花旗泽仁的成药性研究,其中包括确定花旗泽仁(西洋参、泽泻、薏苡仁)的最佳药量配比;完成体内实验的相关药效学指标和体外实验的相关药效学指标[9];确定花旗泽仁药代动力学特征;明确肠道菌群对花旗泽仁的影响[10-11];完成安全性早期评价实验;在体内研究中我们发现,花旗泽仁可明显降低胰岛素抵抗大鼠的空腹血糖,使其胰岛素敏感性升高;在体外研究中,我们也证实了花旗泽仁具有改善肝脏、脂肪、骨骼肌细胞胰岛素抵抗的作用[12-14],但其作用机制仍需进一步探究。
在前期的研究中我们发现,花旗泽仁对IR关键信号分子Akt的活性具有一定影响,而我们前期筛选的KDSR基因对Akt上游信号分子神经酰胺具有一定的调控作用,并通过神经酰胺下游PKCζ/Akt/Foxo1信号通路参与IR的发生。本课题组前期研究已证实,IR细胞中KDSR基因的表达水平升高、神经酰胺含量明显提高、神经酰胺下游PKCζ/Akt/Foxo1信号通路活化程度异常,且细胞中葡萄糖含量较高,而抑制IR细胞中KDSR基因的表达可降低神经酰胺含量、减少PKCζ/Akt/Foxo1信号通路表达异常的状态,同时细胞的葡萄糖含量有所下降;当正常HepG2细胞中KDSR基因过表达时,可使正常HepG2细胞中神经酰胺含量升高、PKCζ/Akt/Foxo1信号通路活化程度异常,同时也使正常HepG2细胞产生与IR细胞类似的葡萄糖含量升高的情况。这表明,KDSR基因的高表达通过提高神经酰胺含量并调节其下游PKCζ/Akt/Foxo1信号通路参与IR的发生,这可能是IR发生的机制之一。基于此结论,我们探究花旗泽仁是否通过调节KDSR基因的表达改善IR。
本部分实验对IR细胞给药花旗泽仁,同时对正常HepG2细胞进行KDSR基因过表达实验,转染KDSR过表达质粒(KDSR-OE),并给予花旗泽仁处理,观察这两种细胞KDSR基因表达情况、神经酰胺含量、PKCζ/Akt/Foxo1信号通路活性及葡萄糖含量,深入探讨花旗泽仁改善IR的作用机制。结果显示,给药花旗泽仁后,IR细胞及KDSR过表达细胞中KDSR的表达水平明显下降,神经酰胺含量降低,且PKCζ/Akt/Foxo1信号通路表达异常的状态有所改善,同时,给药后两种细胞中葡萄糖含量明显下降。
综上所述,花旗泽仁改善IR的作用机制之一可能是通过下调IR细胞中KDSR基因的表达,降低IR细胞内神经酰胺的含量,调节PKCζ/Akt/Foxo1信号通路的活化状态,进而改善IR。
