大豆北方茎溃疡病菌荧光RAA检测方法的建立
2021-07-09陈吴健范宇博严颖鹏林晓佳任琰吴志毅程帆郭利川应清界
陈吴健,范宇博,严颖鹏,林晓佳,任琰,吴志毅,程帆,郭利川,应清界
(1.杭州海关技术中心,浙江 杭州 310016;2.江苏奇天基因生物科技有限公司,江苏 无锡 214000)
大豆茎溃疡病是由大豆茎溃疡病菌感染大豆所引起的疾病,大豆茎溃疡病分大豆北方茎溃疡病和大豆南方茎溃疡病,其病原体分别为大豆北方茎溃疡病菌(Diaporthephaseolorumvar.caulivora,DPC)和大豆南方茎溃疡病菌(Diaporthephaseolorumvar.meridionalis,DPM),DPC属子囊菌门、球壳目、间座壳科、间座壳属。该病菌侵染植株后迅速发展形成茎杆环状损伤,并可导致正在生长的植株死亡。发病严重的田块有80%的植株受到侵染,造成严重的经济损失。在美国、阿根廷、巴西、加拿大、巴拉圭、意大利、前南斯拉夫、克罗地亚等欧洲部分国家及地区有发生报道,是国外大豆生产上的重要病害[1]。
2005年,我国首次从美国进境大豆发现有大豆北方茎溃疡病菌[2],进境大豆携带大量的豆杆、豆荚及其他杂质,带菌的可能性很大。在进境大豆的运输、加工、下脚料的处理过程中都有传播扩散的可能,一旦传入将对我国大豆生产造成严重影响。由于传入风险高,我国绝大部分地区都适合该病菌生长[3],因此,被我国列为检疫性有害生物,由此亟需一种快速简便的方法应对口岸进出粮谷的检测。
重组酶介导扩增(recombinase aid amplification,RAA)是一种新的在恒温下可以快速扩增核酸的技术,RAA扩增法采用来自于大肠杆菌的recA重组酶,利用其在常温下可以与DNA紧密结合的特性,并结合引物形成聚合体扫描双链DNA,在与引物同源的序列处使双链DNA解旋。在单链结合蛋白(SSB)和DNA聚合酶的作用下,新的DNA片段可以在体外快速地扩增出来。这个体外DNA扩增的过程不需要高温,一般在37 ℃或者室温下反应15~30 min即可得到与传统高温PCR相同的目的片段[4]。
本研究建立了大豆北方茎溃疡病的荧光RAA检测方法,并对方法的特异性、灵敏度及对实际样品的检测进行了系统研究。为我国进口大豆的DPC检测提供了一种灵敏、精准、简便的新方法。
1 材料与方法
1.1 供试菌株
取大豆常见病害及其近似菌株进行试验,验证引物的特异性。供试菌株均为本实验室分离鉴定(表1)。

表1 供试菌株基本情况
1.2 标准样品的制备
通过NCBI(http://www.ncbi.nlm.nih.gov)获得大豆北方茎溃疡病菌基因组序列,选择大豆北方茎溃疡病菌的特异性保守基因作为目标检测基因,并进行多序列比对,从中选出一段保守序列,根据序列委托生工生物工程(上海)股份有限公司进行合成DNA质粒,质粒大小298 bp;为了方便进行灵敏度测定,将由生工生物工程(上海)股份有限公司合成的大豆北方茎溃疡病菌DNA质粒转化至大肠杆菌中,37 ℃培养8 h,采用商品化的质粒提取试剂盒进行大豆茎溃疡病菌DNA质粒提取,经浓度测定后将其浓度稀释至1010μL-1备用。
1.3 特异性引物、探针的设计
根据RAA技术引物和探针设计原则,通过筛选和评价,设计的荧光探针修饰在探针中间,荧光报告基团修饰在离5′端碱基数32 bp的位置上,淬灭基团修饰在离3′端碱基数15 bp的位置上,荧光报告基团与淬灭基团之间间隔2个碱基位置,其中1个碱基用于修饰四氢呋喃残基。
1.4 主要设备和试剂
RAA基础荧光通用反应试剂(含重组酶等冻干粉);反应缓冲液(450 mmol Tris-HCl Buffer,260 mmol MgAc,10%m/VPEG 10 000)由江苏奇天基因科技有限公司提供;探针与引物混合物(探针0.02 mmol,引物0.05 mmol);核酸提取试剂盒为QIAGEN DNeasy Plant Mini kit;RAA-F1620荧光检测仪(奇天基因)。
1.5 DNA的提取
供试菌株在PDA上培养后,刮取菌丝,液氮研磨后取0.1~0.2 g。大豆用莱驰MM400球磨仪充分粉碎,取0.1~0.2 g,用核酸试剂盒提取DNA。
1.6 特异性验证
取8个反应管,吸取27 μL反应缓冲液,加入2 μL探针与引物的混合物,充分混匀;将混匀后的缓冲液加入到RAA基础荧光通用反应试剂管中,使冻干粉充分溶解并混匀;在8个配制好的管中分别依次加入1 μL阴性质控品、大豆北方茎溃疡病菌样本、大豆南方茎溃疡病菌样本、大豆拟茎点种腐病菌、大豆镰刀菌、大豆茎荚枯腐病菌、大豆紫斑病菌、大豆炭疽病菌DNA各1 μL为模板,每个反应管进行充分混匀,每个反应管总体积为50 μL;将混匀的反应管放入RAA-F1620荧光检测仪中,在39 ℃反应20 min。
1.7 灵敏度检测
将5 μL 1010mL-1大豆茎溃疡病菌DNA质粒制成10倍梯度的工作标准品1~6,浓度分别为:1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102mL-1;吸取376 μL反应缓冲液,加入16 μL探针与引物的混合物,充分混匀;吸取混匀后的缓冲液49 μL试剂分别加入到7个RAA基础荧光通用反应试剂管中,使冻干粉充分溶解并混匀;在7个配制好的管中分别加入1 μL阴性质控品、标准工作品1~6,每个反应管进行充分混匀,每个反应管总体积为50 μL;将混匀的反应管放入RAA-F1620荧光检测仪中,在39 ℃反应20 min。
1.8 大豆样品的检测
取8个反应管,分别按如下操作,吸取27 μL反应缓冲液,加入2 μL探针与引物的混合物,充分混匀;将混匀后的缓冲液49 μL试剂加入到RAA基础荧光通用反应试剂管中,使冻干粉充分溶解并混匀;在8个配制好的管中分别加入1 μL阴性质控品、经过实时荧光PCR检测的2份DPC阳性的2份美国大豆、2份阿根廷大豆、2份DPC阴性的巴西大豆的DNA,各1 μL为模板,每个反应管进行充分混匀,每个反应管总体积为50 μL;将混匀的反应管放入RAA-F1620荧光检测仪中,在39 ℃反应20 min。
2 结果与分析
2.1 引物和探针
上游引物序列5′-CATCGAGAAGTTCGAGAAG GAAGGTTAGTG-3′;
下游引物序列5′-GCGACGGCAGGTGTGGTAA GAGTGGTGGCGGAAATG-3′;
探针序列及修饰方法为5′-CAGCTGTCTGCGTG CGGCCATTTGCGCCGCA/i6FAMdT//C THF//iBHQdT CACACCTGGAGGCG-3′。
其中,FAM为荧光报告基团,BHQ为荧光淬灭基团,THF为四氢呋喃残基,修饰方法为FAM:6-Carboxyfluorescein;THF:tetrahydrofuran;BHQ:black hole quencher;phosphate:3′ phosphate to block elongation。
2.2 特异性检测
用表1中的菌株对设计的引物和探针进行特异性检测。结果显示,只有大豆北方茎溃疡病菌样本DNA明显有扩增,其他样本及阴性质控品均没有扩增,均为阴性(图1)。结果表明,本方法特异性好,可以区分大豆北方茎溃疡病菌的近似种及大豆上常见的病害。
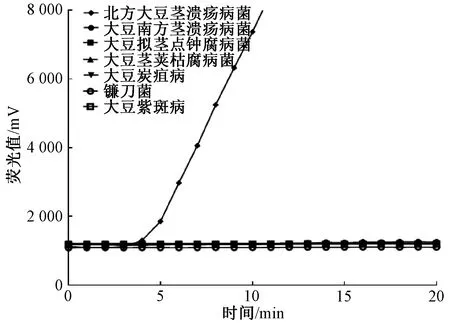
图1 特异性的检测结果
2.3 灵敏度检测
将大豆茎溃疡病菌DNA质粒制成10倍梯度的工作标准品1~6,用于实时荧光RAA检测,最快2 min就有明显扩增,10 min内所有标准工作品均有扩增(图2)。根据当荧光增加量为荧光起始量的30%为阳性的判定标准,结果表明,该检测方法的检测灵敏度达到1.0×103mL-1。
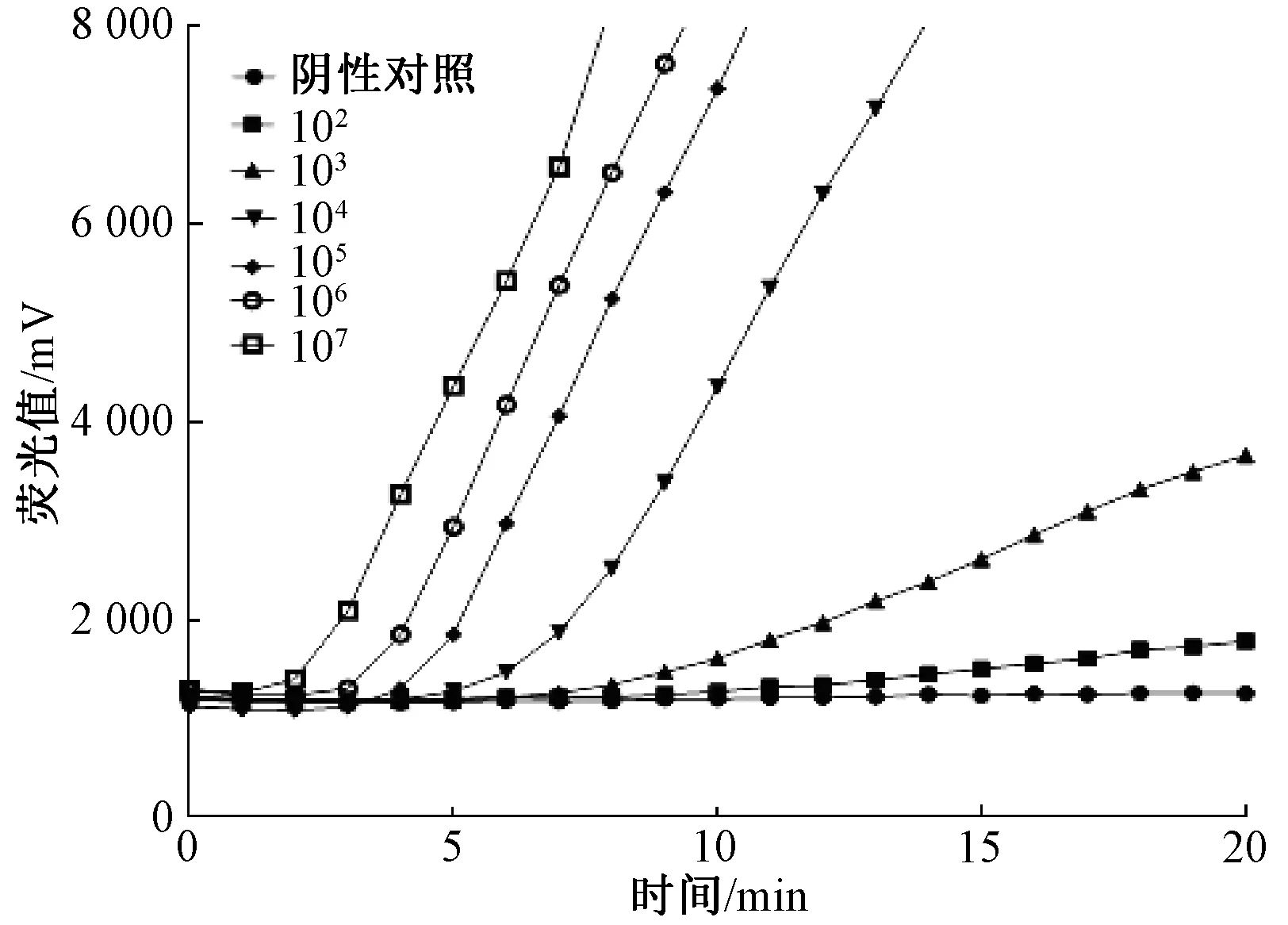
图2 灵敏度的检测结果
2.4 大豆样品的检测
实际样品检测结果表明,阳性对照和美国、阿根廷大豆可见阳性扩增曲线,巴西大豆和阴性对照无扩增信号,说明该方法不但可以用来鉴定大豆北方茎溃疡病菌菌株,同时也可以用于检测进出境大豆产品中是否携带的大豆北方茎溃疡病菌,且灵敏度和精确度和实时荧光PCR相当(图3)。
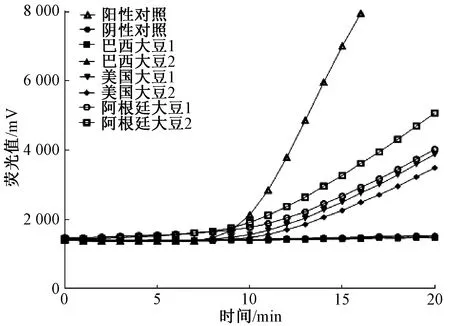
图3 大豆样品的检测结果
3 讨论
大豆(Glycinemax)是我国重要的油料作物和粮食作物,也是世界上食用油和植物蛋白的主要来源,在我国国民经济中占有重要地位。目前我国大豆产量居世界第4位,但仍然不能满足国内植物油及饲料蛋白加工的需要。随着我国进口大豆的数量逐年递增,各种危害大豆生产的病害传入的风险也逐渐增大。
大豆北方茎溃疡病菌于1950年在美国爱荷华州首次发现,严重危害世界大豆主产区的大豆生产,可以通过种子和混在大豆中的病残体远距离传播[5]。北方茎溃疡菌的种子侵染率可达10%~20%,因此,随大豆传入的可能性极高;深圳、宁波、浙江等口岸曾多次从美国、阿根廷进口的贸易大豆中截获到大豆北方茎溃疡病菌[6]。为了保护我国的大豆产业的健康发展,我国将大豆茎溃疡病菌列入进境检疫性有害生物名录,用检疫方法严防其传入。
目前,检测大豆北方茎溃疡病的方法主要有分离培养法、PCR法、LAMP法等[7-8]。传统方法如分离培养技术耗时较长,操作繁琐;采用PCR技术,虽然结果精确度高,需昂贵仪器,装备精良的实验室和专业的操作人员。LAMP法不需要昂贵的PCR仪,等温灵敏、特异性强、操作简单且易于观察,但是LAMP技术要求多对引物,且对靶基因的要求较高,假阳性高,不利于在基层实验室推广使用。本研究首次建立了大豆北方茎溃疡病菌的RAA检测方法,克服了以上技术的缺点,并通过样品的验证表明,该方法方便快捷、灵敏度高、特异性强,能够检测到1.0×103mL-1的DNA样本,整个检测过程为5~20 min,能够满足进出境大豆及大豆产品快速通关的要求。
