下调miR-141-3p对晚期NSCLC细胞侵袭转移和化疗敏感性影响及其机制
2021-07-08王亚飞张振军宋长亮张磊
王亚飞 张振军 宋长亮 张磊
[摘要]目的 研究miR-141-3p介导Yes相关蛋白1(YAP1)基因表达对晚期非小细胞肺癌(NSCLC)细胞侵袭转移和化疗敏感性的影响及其作用机制。方法 收集50例晚期NSCLC及癌旁组织标本,采用定量逆转录聚合酶链反应(qRT-PCR)检测组织中miR-141-3p和YAP1表达量。选择NSCLC细胞株,设计miR-141-3p inhibitor和siRNA-YAP1,将细胞分为Blank组、miR-141-3p mimic组、miR-141-3p inhibitor组、YAP1 vector组、siRNA-YAP1组和miR-141-3p mimic+siRNA-YAP1组。取对数生长期的细胞接种于96孔培养板,加10 mg/L顺铂置37 ℃、体积分数0.05 CO2条件下培养;观察细胞迁移、侵袭、耐药性的变化,并检测miR-141-3p、YAP1、TGF-β信号通路相关蛋白TGF-β和Smad2表达。结果 与癌旁组织相比,晚期NSCLC中miR-141-3p和YAP1呈高表达(t=23.19、17.32,P均<0.05)。过表达miR-141-3p或YAP1能够降低TGF-β和Smad2表達,促进癌细胞侵袭迁移,降低顺铂处理后细胞存活率(Tukeys检验,P均<0.05);而沉默miR-141-3p或YAP1能够提高TGF-β和Smad2表达,抑制癌细胞转移侵袭,提高顺铂处理后细胞存活率(Tukeys检验,P均<0.05;F=82.670~181.000,P均<0.05)。结论 miR-141-3p下调可能通过抑制YAP1基因表达激活TGF-β信号通路,进而调控晚期NSCLC细胞侵袭转移和化疗敏感性。
[关键词]癌,非小细胞肺;微RNAs;RNA干扰;TGF-β信号通路;肿瘤侵润;肿瘤转移;辐射耐受性;抗药性,肿瘤
[中图分类号]R730.26;R342.2
[文献标志码]A
[文章编号]2096-5532(2021)02-0228-06
[ABSTRACT]Objective To investigate the effect of the gene expression of Yes-associated protein 1 (YAP1) mediated by miR-141-3p on the invasion, migration, and chemosensitivity of advanced non-small cell lung cancer (NSCLC) cells. MethodsAdvanced NSCLC and adjacent tissue samples were collected from 50 patients, and quantitative reverse transcription-polymerase chain reaction was used to measure the expression of miR-141-3p and YAP1. NSCLC cell line was selected, and miR-141-3p inhibitor and siRNA-YAP1 were designed. The cells were divided into blank group, miR-141-3p mimic group, miR-141-3p inhibitor group, YAP1 vector group, siRNA-YAP1 group, and miR-141-3p mimic+siRNA-YAP1 group. The cells in the logarithmic growth phase were inoculated on a 96-well plate and cultured with 10 mg/L cisplatin at 37 ℃ and a volume fraction of CO2 of 0.05; the changes in cell migration, invasion, and drug resistance were observed, and the expression of miR-141-3p, YAP1, and proteins related to the TGF-β signaling pathway (TGF-β and Smad2) was measured. Results Compared with the adjacent tissue, the advanced NSCLC tissue showed high expression of miR-141-3p and YAP1 (t=23.19,17.32;P<0.05). Overexpression of miR-141-3p or YAP1 reduced the expression of TGF-β and Smad2, promoted the invasion and migration of cancer cells, and reduced cell viability after cisplatin treatment (Tukeys test, P<0.05), while silencing of miR-141-3p or YAP1 increased the expression of TGF-β and Smad2, inhibited the migration and invasion of cancer cells, and increased cell viability after cisplatin treatment (Tukeys test, P<0.05;F=82.670-181.000,P<0.05). Conclusion Downregulation of miR-141-3p may regulate the invasion, migration, and chemosensitivity of advanced NSCLC cells by inhibiting the expression of the YAP1 gene and activating the TGF-β signaling pathway.
[KEY WORDS]carcinoma, non-small-cell lung; microRNAs; RNA interference; TGF-β signaling pathway; neoplasm invasiveness; neoplasm metastasis; radiation tolerance; drug resistance, neoplasm
肺癌病死率位居恶性肿瘤的首位,多数病人确诊时已是晚期失去手术机会,其预后极差,多归因于目前缺乏有效的早期诊断途径[1-4]。晚期非小细胞肺癌(NSCLC)病人多采用以化疗为主的治疗方案[5-6]。值得注意的是肿瘤治疗效果与病人个体化特征密切相关,即便同一种治疗方案应用于有着相似临床诊断、临床分期及药物种类和剂量的不同患癌个体,亦可能产生不同反应。化疗敏感性已成为衡量化疗效果的主要指标[4],而耐药性在治疗过程中很常见。微小RNA(microRNA)是一类非编码RNA,可通过调节特定基因的表达,参与肿瘤发展进程[7]。近年来的研究表明,microRNA在肺癌的發展、诊疗、放化疗敏感性等方面均发挥着重要作用[8-9]。例如,miR-141已被证实可作为NSCLC潜在的诊断标志物[10-11];miR-141-3p在对化疗有效的NSCLC病人中呈低表达[12]。但目前关于miR-141-3p是否参与晚期NSCLC治疗过程中化疗敏感性机制的研究未见报道。本研究以体外实验方式,采用细胞转染探究miR-141-3p在NSCLC细胞系的表达,并探讨其对晚期NSCLC化疗敏感性的影响及其作用机制,为逆转肺癌化疗耐药性提供临床依据。
1 材料与方法
1.1 实验材料
1.1.1 试剂和仪器 NSCLC细胞株A549(中国科学院肿瘤研究所);顺铂(北京沃凯生物科技有限公司);miR-141-3p模拟物(miR-141-3p mimic)、miR-141-3p抑制物(miR-141-3p inhibitor)、Yes相关蛋白1载体(YAP1 vector)、YAP1沉默表达(siRNA-YAP1)质粒和PCR引物(上海吉玛公司);Matrigel胶(上海玉博生物科技有限公司);倒置显微镜(Leica公司,德国);CCK8试剂(上海翊圣生物科技有限公司);Trizol试剂(北京百奥森泰生物技术有限公司);两步法实时定量逆转录聚合酶链反应(qRT-PCR)试剂盒(上海联迈生物工程有限公司);Western blot抗体(Abcam,UK);ECL发光液(上海七海复泰生物科技有限公司);双荧光素酶报告基因检测试剂盒(翌圣生物科技(上海)有限公司)。
1.1.2 研究对象 2016年6月—2018年6月,选择邯郸市中心医院不能手术的50例晚期NSCLC病人作为研究对象,术前均未接受放化疗及免疫治疗。其中男34例,女16例,年龄为22~71岁,平均年龄(54.12±6.67)岁。所有病例均经CT引导下经皮肺穿刺或支气管镜下黏膜活检,并经病理证实为晚期NSCLC。同时,以24例手术切除的肺癌病人的癌旁正常肺组织(距病灶5 cm)为对照组。
1.2 实验方法
1.2.1 细胞培养与分组处理 收集NSCLC细胞株A549置于Kaighns F-12K培养基(补加有体积分数0.10胎牛血清(FBS)和青霉素/链霉素/真菌素),接种于24孔板,每孔500 μL,置于37 ℃、含体积分数0.05 CO2、100%湿度培养箱中孵育。根据细胞生长情况,每隔2~3 d传代1次。将细胞分为6组:Blank组(A组,不做任何处理),miR-141-3p mimic组(B组,转染miR-141-3p过表达质粒),miR-141-3p inhibitor组(C组,转染miR-141-3p inhibitor质粒),YAP1 vector组(D组,转染YAP1过表达质粒),siRNA-YAP1组(E组,转染siRNA-YAP1质粒),miR-141-3p mimic+siRNA-YAP1组(F组,共转染miR-141-3p inhibitor质粒和YAP1过表达质粒)。均采用Lipofectamine Transfection Reagent 2000(Invitrogen)介导细胞转染。
1.2.2 qRT-PCR检测 转染48 h后,收集各组细胞,Trizol法提取细胞总RNA,并测定浓度和纯度(组织检测步骤同细胞检测)。按照qRT-PCR试剂盒说明书操作,置于PCR扩增仪,将样品RNA反转为cDNA,并进行qRT-PCR扩增。将基因上下游引物稀释,加入PCR扩增体系,灭菌ddH2O补足至20 μL。目的基因以GADPH为内参照,使用实时PCR检测系统平台进行检测。取Ct值,采用相对定量法计算,用2-△△Ct表示各目的基因相对表达量。每个实验均重复3次,取其均值。
1.2.3 双荧光素酶报告检测 使用生物学预测网站进行miR-141-3p和YAP1的结合位点分析。克隆扩增YAP1的3UTR区到pmirGLO双荧光素酶报告基因载体上,并命名为pWt-YAP1。同时构建pMut-YAP1载体,mimic-NC组与miR-141-3p mimic组分别与荧光素酶报告载体共转染NSCLC细胞株A549,采用双荧光素酶报告基因检测试剂盒检测荧光强度。
1.2.4 Transwell实验 在各组转染48 h后细胞板内,每孔上室加200 μL细胞悬液,下室加800 μL含有体积分数0.20 FBS的条件培养基。37 ℃培养箱孵育20~24 h。取出Transwell板,1 g/L甲紫溶液染色。晾干后用倒置显微镜随机计数5个视野的细胞,并取平均值。实验重复3次。
1.2.5 划痕实验 用Marker笔在6孔板背后均匀画横线(间距0.5~1.0 cm),横穿过孔。每孔至少穿过5条线。加入各组转染48 h后的细胞,过夜培养,待细胞均匀铺满容器底面。次日用枪头沿直尺划痕。用PBS洗细胞3次,去除划下的细胞,加入无血清培养基。放入37 ℃、体积分数0.05 CO2培养箱培养。取样拍照。
1.2.6 CCK8检测 使用体积分数0.10 FBS培养基配制成不同浓度的顺铂溶液,4 ℃储存备用。取对数生长期的细胞接种于96孔培养板,置37 ℃、体积分数0.05 CO2条件下培养,取10 mg/L顺铂,加入96孔板中,设3个复孔。设置空白对照。48 h后,每孔加新配制的CCK8试剂10 μL,继续孵育4 h,终止培养,小心吸去培养液。在酶联免疫检测仪上测定各孔450 nm波长处吸光度(A)。细胞存活率=实验组A值/对照组A值×100%。
1.2.7 Western blot检测 收集转染培养48 h后的各组细胞,以PBS洗涤后重悬。离心取上清,加入RIPA裂解液,轻摇重悬后,冰上孵育30 min,4 ℃、12 000 r/min离心10 min,取上清液,即为细胞总蛋白。应用碧云天BCA蛋白定量试剂盒测定蛋白质浓度。取20 μg细胞总蛋白用100 g/L的SDS-PAGE凝胶电泳分离蛋白质,随后湿法转膜,使用50 g/L的脱脂奶粉封闭1.5 h。按照抗体说明书稀释相应抗体于一抗稀释液中。实验所用的一抗如下:一抗兔抗人YAP1、一抗兔抗人TGF-β、一抗兔抗人Smad2及一抗兔抗人GAPDH多克隆抗体。加入相应HRP标记的二抗羊抗兔IgG抗体,在室温下反应2 h,ECL发光液显色,并曝光成像。采用Quanity One软件进行蛋白条带灰度分析。
1.3 统计学分析
采用SPSS 21.0统计软件分析数据,计量资料数据以x2±s表示,两组均数比较采用t检验,多组均数比较采用单因素方差分析,组间两两比较采用Tukeys检验。以P<0.05为差异有显著性。
2 结 果
2.1 晚期NSCLC组织miR-141-3p和YAP1表达
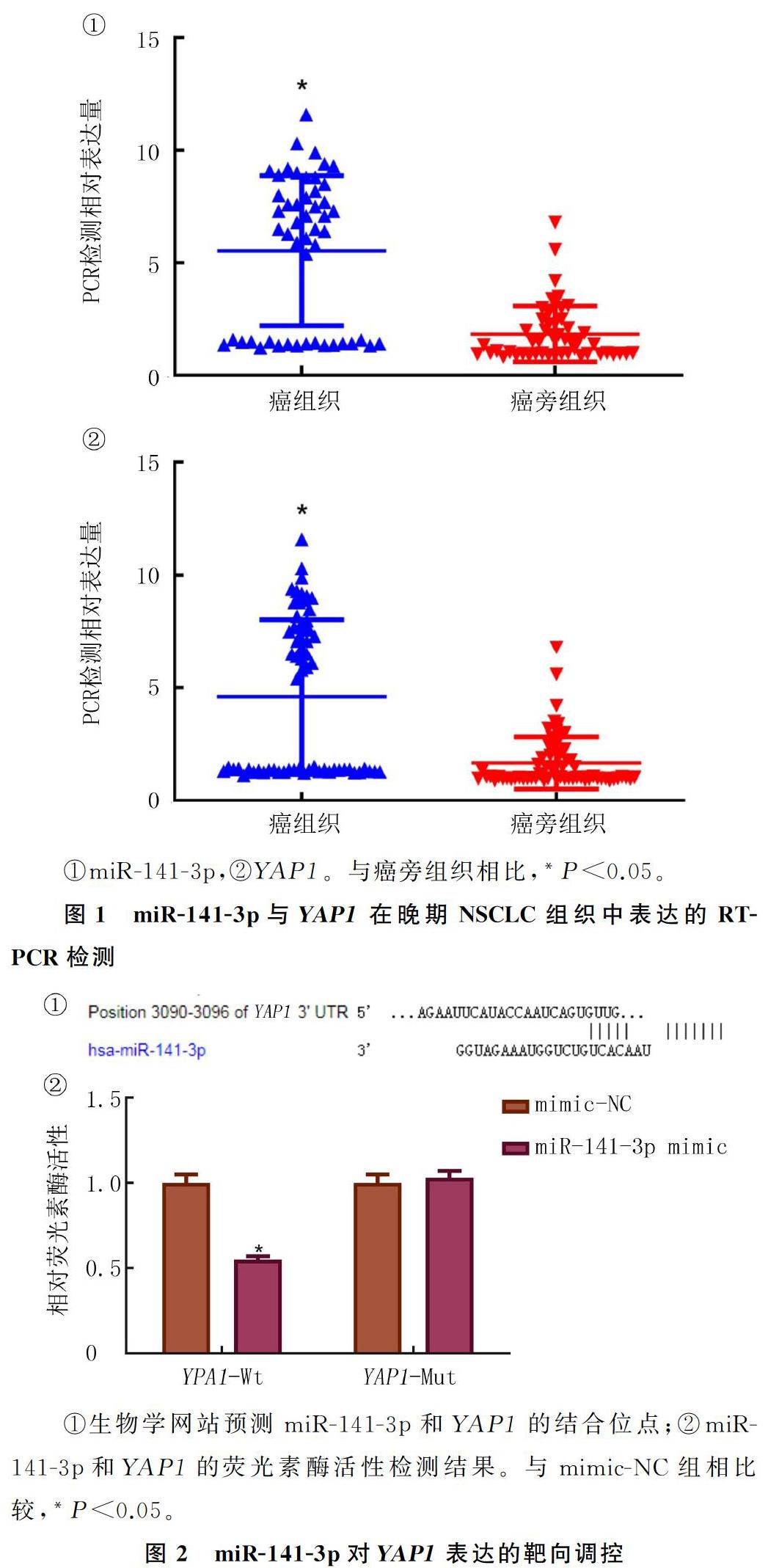
通过对50例晚期NSCLC组织及24例癌旁组织的qRT-PCR检测结果显示,与癌旁组织比较,癌组织中miR-141-3p和YAP1表达均显著升高,差异均有统计学意义(t=23.19、17.32,P均<0.05)。见图1。
2.2 miR-141-3p对YAP1基因表达的调控
为研究miR-141-3p在NSCLC细胞中的靶向关系,通过生物学网站对其进行分析,结果显示,miR-141-3p和YAP1存在结合位点。双荧光素酶报告基因预测结果显示,与mimic-NC组相比较,YAP1野生型3UTR的荧光素酶活性能被miR-141-3p抑制(t=7.643,P<0.05),而对YAP1突变型3UTR的荧光素酶活性没有影响(P>0.05)。说明miR-141-3p能特异性结合YAP1的3UTR区并在转录后水平下调FANCM基因表达。见图2。
差异有显著意义(F=116.8,P<0.05)。与Blank组相比,miR-141-3p mimic组YAP1基因表达上升(Tukeys检验,P<0.05),miR-141-3p inhibitor组YAP1基因表达下降(Tukeys检验,P<0.05)。说明miR-141-3p表达能够调控YAP1表达。见图3。
2.4 miR-141-3p对晚期NSCLC细胞的增殖、迁移和耐药性的影响
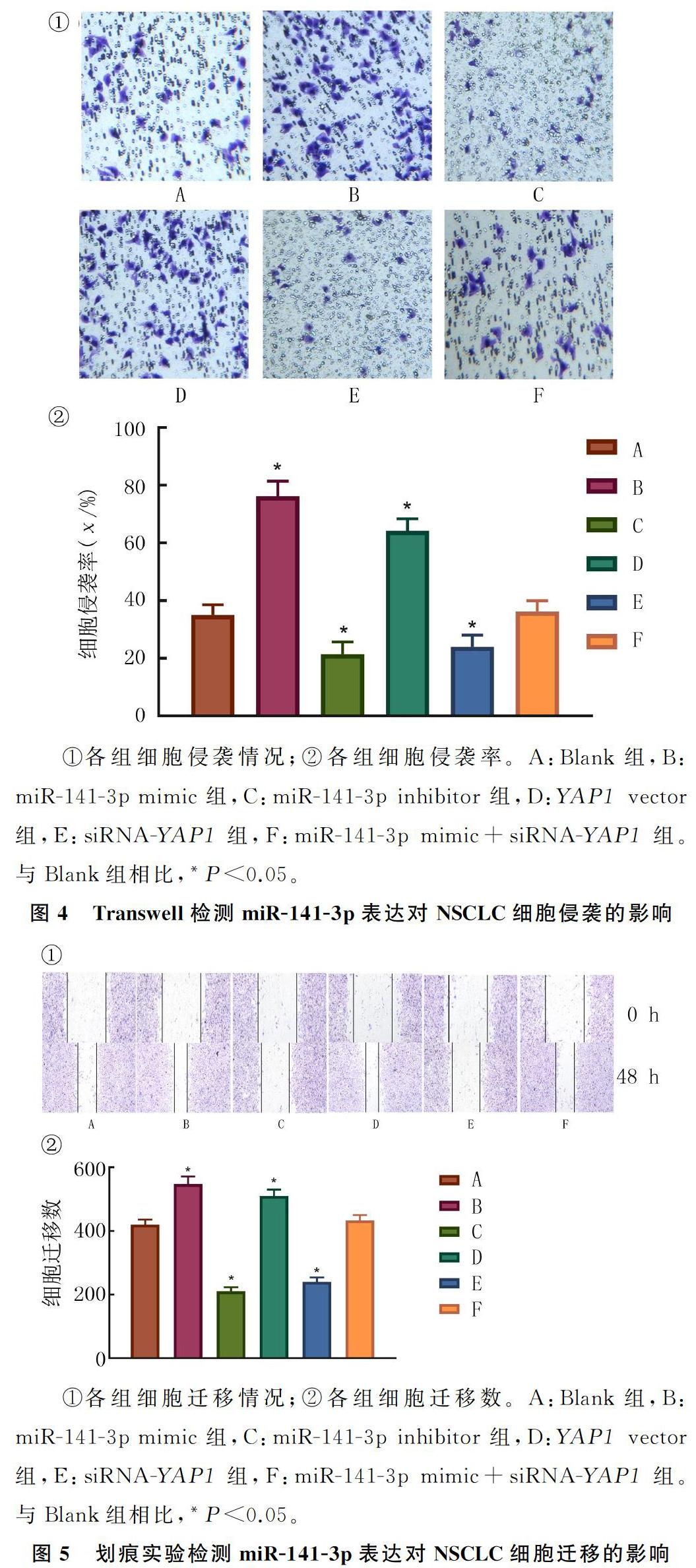
结果显示,各组NSCLC細胞的增殖、迁移和耐药性比较,差异有显著意义(F=82.670~181.000,P均<0.05)。与Blank组相比,miR-141-3p mimic组和YAP1 vector组癌细胞侵袭、迁移能力明显增强,顺铂处理后细胞存活率明显增加,差异有显著意义(Tukeys检验,P均<0.05);而miR-141-3p inhibitor组和siRNA-YAP1组癌细胞侵袭、迁移能力明显减弱,顺铂处理后细胞存活率明显降低,差异有显著性(Tukeys检验,P均<0.05)。Blank组和miR-141-3p mimic+siRNA-YAP1组各指标无显著差异(P>0.05)。说明miR-141-3p inhibitor+pcDNA-YAP1组逆转了这一趋势。见图4、5。
2.5 miR-141-3p对TGF-β信号通路相关蛋白影响
Western blot检测结果显示,各组TGF-β信号通路相关蛋白表达比较,差异有统计学意义(F=159.800、125.3000,P均<0.05)。与Blank组相比,miR-141-3p mimic组和YAP1 vector组TGF-β和Smad2表达水平明显下降,而miR-141-3p inhibitor组和siRNA-YAP1组TGF-β表达水平明显提高,差异有显著性(Tukeys检验,P均<0.05)。Blank组和miR-141-3p mimic+siRNA-YAP1组各项指标差异无显著性(均P>0.05)。见图6。
3 讨 论
microRNA已被证实在人类肿瘤的抗放化疗机制中发挥重要作用。例如,LIU等[13]在其研究中利用microRNA分子谱分析法筛选与LASS2相关的microRNA,以为鉴别化疗耐药和化疗敏感性提供依据,其结果发现miR-93抑制剂可增强si-LASS2转染肿瘤细胞的化学敏感性。LANG等[14]报道,采用miR-24靶向沉默S100A8基因可提高子宫内膜癌细胞对紫杉醇的化疗敏感性。刘娜等[15]在其研究中利用慢病毒表达载体转染卵巢癌细胞株,构建miR-200a表达上调模型,并结合MTT实验、PCR和免疫印迹检测发现miR-200a可能通过调控耐药相关ABC家族基因如ABCB3、ABCC1、ABCC2、ABCC3和ABCG2的表达,增加卵巢癌细胞对紫杉醇的敏感性。肖悦等[16]通过构建稳定表达miR-18a的白血病细胞转染模型,发现miR-18a能够通过靶定ATM调节白血病细胞HL-60对VP-16和VCR化疗敏感性。鉴于microRNA能在基因编码水平上反映肿瘤的耐药性机制[17-19],那么通过构建特定表达干预的细胞转染模型,可有助于探究特定microRNA与肿瘤耐药性的关联及其作用机制。
在本研究前期,我们通过生物信息学方法筛选出晚期NSCLC过表达基因miR-141-3p,且在线生物学预测软件报道miR-141-3p调控YAP1,YAP1在晚期NSCLC亦高表达,因此推测miR-141-3p通过调控YAP1影响晚期NSCLC。本研究首先通过qRT-PCR验证组织中miR-141-3p和YAP1的表达。结果显示,与癌旁组织相比,晚期NSCLC中miR-141-3p和YAP1呈高表达。进而,我们通过细胞转染分为不同干预组别,探讨了miR-141-3p对YAP1的调控关系,结果显示,过表达miR-141-3p能够促进YAP1基因和蛋白的表达,沉默miR-141-3p能够抑制YAP1基因和蛋白的表达,说明miR-141-3p的表达能够调控YAP1的表达。进一步研究结果表明,通过转染miR-141-3p mimic或YAP1vector,相比Blank组,过表达miR-141-3p或YAP1能够抑制TGF-β和Smad2表达,促进癌细胞侵袭迁移,增加细胞对顺铂耐药性。而通过miR-141-3pinhibitor或si-YAP1转染处理,则显示沉默miR-141-3p或YAP1能够提高TGF-β和Smad2表达,抑制癌细胞转移侵袭,降低细胞对顺铂耐药性。与此同时,Blank组和miR-141-3p mimic+siRNA-YAP1组各项指标无显著差异,提示后者逆转了这种趋势。这说明miR-141-3p能够通过YAP1促进晚期NSCLC细胞的增殖、迁移和耐药。
基于以上实验探究,我们推测,miR-141-3p下调可能通过抑制YAP1基因表达,激活TGF-β信号通路,进而调控晚期NSCLC细胞侵袭转移和化疗敏感性。值得注意的是,TGF-β家族是一类功能复杂的细胞因子,可广泛参与各种病理生理过程,介导肿瘤细胞的分化与增殖[20-22]。TGF-β信号通路相关蛋白如Smad2,亦参与人类肿瘤进程,与乳癌、肺癌等发生发展相关[23-24]。TGF-β信号通路及其相关蛋白组成肿瘤抑制通路,介导肿瘤细胞生长,并且可激活一系列信号通路如MAPK、ERK等信号通路[25-26]。本研究中,miR-141-3p下调及YAP1基因表达抑制促进了TGF-β和Smad2表达的提升,进而激活TGF-β信号通路,对于降低顺铂耐药性具有重要作用。既往研究已报道TGF-β信号通路与化疗耐药有关,并可通过调控TGF-β信号通路抑制肿瘤耐药[27]。孙彩霞等[28]报道,转染miR-141模拟物可降低卵巢癌细胞株SKOV-3和ES-2细胞对卡铂的敏感性,提示检测miR-141表达水平在预测卵巢癌对卡铂敏感性、评估病人预后及其合理指导综合治疗等方面的临床意义。
综上所述,本文结果显示,miR-141-3p下调可能通过抑制YAP1基因表达,激活TGF-β信号通路,进而调控晚期NSCLC细胞侵袭转移和化疗敏感性。本研究可为人类探讨NSCLC耐药机制提供新途径,microRNA与NSCLC耐药间的相关性将为逆转其耐药性提供一种全新的思路和策略。然而,本研究仅在细胞实验中初步探究miR-141-3p对NSCLC影响的作用机制,是否存在其他潜在靶点及其作用机制均未可知,其将为今后研究的主要方向,进而为NSCLC的诊治提供分子生物学依据。
[参考文献]
[1]JAMAL-HANJANI M, WILSON G A, MCGRANAHAN N, et al. Tracking the evolution of non-small-cell lung cancer[J]. The New England Journal of Medicine, 2017,376(22):2109-2121.
[2]HANNA N, JOHNSON D, TEMIN S, et al. Systemic thera-py for stage Ⅳ non-small-cell lung cancer: American society of clinical oncology clinical practice guideline update summary[J]. Journal of Oncology Practice, 2017,13(12):832-837.
[3]KATGI N, UNLU M, CIMEN P, et al. Pseudomesotheliomatous primary squamous cell lung carcinoma: the first case reported in Turkey and a review of the literature[J]. Open Medicine, 2018,13(1):324-328.
[4]HUA X, ZHU X. Research advances of Ang-2 in non-small cell Lung cancer[J]. Chinese Journal of Lung Cancer, 2018,21(11):868-874.
[5]SORENSEN S F, ZHOU W, DOLLED-FILHART M, et al. PD-L1 expression and survival among patients with advanced non-small cell lung cancer treated with chemotherapy[J]. Translational Oncology, 2016,9(1):64-69.
[6]張英,王学谦,刘浩,等. 参一胶囊联合化疗改善晚期非小细胞肺癌患者预后的多中心大样本随机临床研究[J]. 中华肿瘤杂志, 2018,40(4):295-299.
[7]AKAZAWA Y, HIGASHIYAMA M, NISHINO K, et al. Impact of in vitro chemosensitivity test-guided platinum-based adjuvant chemotherapy on the surgical outcomes of patients with p-stage ⅢA non-small cell lung cancer that underwent complete resection[J]. Molecular and Clinical Oncology, 2017,7(3):327-335.
[8]YE Y, ZHUANG J H, WANG G Y, et al. microRNA-605 promotes cell proliferation, migration and invasion in non-small cell lung cancer by directly targeting LATS2[J]. Experimental and Therapeutic Medicine, 2017,14(1):867-873.
[9]ZHANG Y X, WANG Y J, WANG J G. MicroRNA-584 inhibits cell proliferation and invasion in non-small cell lung cancer by directly targeting MTDH[J]. Experimental and Therapeutic Medicine, 2017. doi:10.3892/etm.2017.5624.
[10]FU W F, CHEN W B, DAI L, et al. Inhibition of miR-141 reverses cisplatin resistance in non-small cell lung cancer cells via upregulation of programmed cell death protein 4[J]. European Review for Medical and Pharmacological Sciences, 2016,20(12):2565-2572.
[11]RUPAIMOOLE R, SLACK F J. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases[J]. Nature Reviews. Drug Discovery, 2017,16(3):203-222.
[12]李丽华,寿涛,李伟,等. 微阵列芯片分析MicoRNA表達与非小细胞肺癌化疗敏感性的相关性研究[J]. 昆明理工大学学报(自然科学版), 2016,41(5):79-84
[13]WANG J S, LIU J Y, WANG H F, et al. Repression of the miR-93-enhanced sensitivity of bladder carcinoma to chemotherapy involves the regulation of LASS2[J]. OncoTargets and Therapy, 2016:1813.
[14]LANG B, SHANG C, MENG L R. Targeted silencing of S100A8 gene by miR-24 to increase chemotherapy sensitivity of endometrial carcinoma cells to paclitaxel[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2016,22:1953-1958.
[15]刘娜,曾洁,张小媚,等. miR-200a参与调控卵巢癌化疗敏感性的作用及其机制[J]. 中华医学杂志, 2014,94(27):2148-2151.
[16]肖悦,胡蓉. MiR-18a通过靶定ATM调节白血病细胞HL-60对VP-16和VCR化疗敏感性[J]. 中国实验血液学杂志, 2015,23(4):999-1004.
[17]BAYRAKTAR R, VAN ROOSBROECK K. miR-155 in can-cer drug resistance and as target for miRNA-based therapeutics[J]. Cancer and Metastasis Reviews, 2018,37(1):33-44.
[18]BERMAN M, MATTHEOLABAKIS G, SURESH M, et al. Reversing epigenetic mechanisms of drug resistance in solid tumors using targeted microRNA delivery[J]. Expert Opinion on Drug Delivery, 2016,13(7):987-998.
[19]SUN W, MA Y P, CHEN P, et al. MicroRNA-10a silencing reverses cisplatin resistance in the A549/cisplatin human lung cancer cell line via the transforming growth factor-β/Smad2/STAT3/STAT5 pathway[J]. Molecular Medicine Reports, 2015,11(5):3854-3859.
[20]SEOANE J, GOMIS R R. TGF-β family signaling in tumor suppression and cancer progression[J]. Cold Spring Harbor Perspectives in Biology, 2017,9(12): a022277.
[21]温云花,吴学明,史春,等. 保妇康栓治疗宫颈柱状上皮异位疗效及对子宫颈组织ICMI-1mRNA、TGF-β1m RNA及炎性细胞因子水平的影响[J]. 中国药师, 2017,20(8):1400-1402.
[22]艾麦提·牙森,金鑫,陈梓昕,等. TGF-β1信号介导的肝星状细胞促进胚胎肝前体细胞向胆管细胞方向分化[J]. 第三军医大学学报, 2018,40(9):746-752.
[23]SHI J Y, MA L J, ZHANG J W, et al. FOXP3 is a HCC suppressor gene and acts through regulating the TGF-β/Smad2/3 signaling pathway[J]. BMC Cancer, 2017,17(1):648.
[24]CHAE D K, BAN E, YOO Y S, et al. MIR-27a regulates the TGF-β signaling pathway by targeting SMAD2 and SMAD4 in lung cancer[J]. Molecular Carcinogenesis, 2017,56(8):1992-1998.
[25]SUN X W, XIE Z A, MA Y, et al. TGF-β inhibits osteogenesis by upregulating the expression of ubiquitin ligase SMURF1 via MAPK-ERK signaling[J]. Journal of Cellular Physiology, 2018,233(1):596-606.
[26]徐萬田,陈韵,林楠,等. TGF-β1调控ERK/MAPK信号通路对人牙髓细胞增殖和分化能力的影响研究[J]. 中国美容医学, 2018,27(4):94-97.
[27]何晴莹,张学彦. TGF-β信号通路与肿瘤耐药相关性研究进展[J]. 现代肿瘤医学, 2018,26(1):127-131.
[28]孙彩霞,宋藏珠,徐庆,等. 卵巢癌组织和细胞株中miR-141表达水平与卡铂耐药性的关系[J]. 实用癌症杂志, 2014,29(11):1364-1368.
(本文编辑 于国艺)
