大型发酵酱油酿造过程中风味物质的动态变化分析
2021-07-08刘晓艳叶月华白卫东黄汉聪何一龙
刘晓艳,叶月华,钱 敏,2,白卫东,*,黄汉聪,杨 红,何一龙
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.广州市广式传统食品加工与安全控制重点实验室,广东 广州 510225;3.现代农业工程创新研究院,广东 广州 510225;4.广州市如丰果子调味食品有限公司,广东 广州 510300)
酱油是我国经久不衰的传统调味品,流传历史长达两千余年,至今在人们日常饮食中仍占据着无可取代的地位。它的精髓源自于其独一无二的风味,即香味和滋味等方面,主要是由一系列微生物在酿造过程中共同作用所形成复杂的物质组分。由于风味成分含量会随着酱醪发酵过程中原料和微生物菌群的变化以及某些成分间的相互反应而有所改变,酱油的品质与发酵时间息息相关[1]。其中颇具代表性的是高盐稀态酱油,耐盐微生物能够充分发挥作用,产生大量醇类、酯类和有机酸等风味物质,因此其醇厚的口感和浓郁的酯香深受大众青睐,但不足之处是酿造周期长和成本高[2]。现代工艺为了确保大产量和缩短发酵周期从而通过机械化生产高盐稀态酱油,这势必会成为中国酱油行业未来发展的趋势[3]。
酱油独特的酿造工艺和具有特殊的风味,使其风味成分的研究一直以来备受学术界的广泛关注。迄今,国内外学者主要采用直接溶剂萃取法、同时萃取蒸馏法和固相微萃取法等萃取方法结合高效液相色谱、气相色谱和气相色谱-质谱等方法对酱油挥发性成分进行分离和鉴定[4]。其中最常使用的是基于分析速度快、灵敏度高和可同时进行分离和鉴定等特点的气相色谱-质谱法,例如高献礼[5]利用固相微萃取结气相色谱-质谱联用技术对高盐稀态酱油发酵过程中的香气物质进行分析,共鉴定出74 种物质,其中最突出的香气化合物有乙酸和3-甲基丁酸;李杨等[6]则采用顶空固相微萃取结合气相色谱-质谱法测定出当地酱油发酵过程中挥发性香气组分共计31 种。Wei Quanzeng等[7]也是使用顶空固相微萃取结合气相色谱-质谱法动态追踪酱油不同发酵阶段挥发性物质的变化,结果鉴定出119 种挥发性化合物。
然而当前针对酱油酿造过程风味成分变化规律的文献相对较少,且对大型发酵酱油滋味层面物质的分离和鉴定尚未深入研究,目前有关酱油挥发性成分的研究报道也多集中于气相色谱-质谱方法[8-9]。相比传统质谱分析,高分辨率的飞行时间质谱则存在更多优势,比如灵敏度和采集速率更高,可在极短时间内快速完成同等测量工作,选择性更突出,操作更简便,定性范围更广,尤其是分析组分复杂的样品等方面[10-11]。因此,为了更好地指导高档酱油的生产以及提高我国酱油的国际竞争力,本实验率先采用气相色谱-飞行时间质谱(gas chromatography-time-of-flight mass spectrometry,GC-TOF-MS)技术对高盐稀态酱油在机械化酿造过程中风味物质的动态变化进行更全面有效的分析,并获得酱油在酿造过程中的重要风味组分,以期为今后该领域的相关科研工作者和酱油生产企业提供更充足的理论依据及数据支持。
1 材料与方法
1.1 材料与试剂
取自广州市如丰果子调味食品有限公司酱油发酵车间同一批次不同发酵时间的酱油样品,分别是酿造第1、11、21、32、52、62天的酱醪样品,发酵周期为62 d。
甲醇(67-56-1,色谱纯) 美国CNW Technologies公司;吡啶(110-86-1,色谱纯) 美国Adamas公司;甲氧铵盐(593-56-6,分析纯) 美国TCI公司;L-2-氯苯丙氨酸(103616-89-3,纯度≥98%)上海恒柏生物科技公司;硅烷化试剂(1%三甲基氯硅烷,V/V) 美国REGIS Technologies公司;饱和脂肪酸甲酯 美国Dr.Ehrenstorfer公司。
1.2 仪器与设备
7890A气相色谱仪、DB-5MS色谱柱(30 m×250 μm,0.25 μm) 美国Agilent公司;PEGASUS HT质谱仪 德国Leco公司;Heraeus Fresco17离心机 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 物质提取
取样本100 μL于1.5 mL EP管中,加入400 μL甲醇提取液,再加入10 μLL-2-氯苯丙氨酸,涡旋30s;超声10 min(冰水浴);将样本4 ℃、12 000 r/min离心15 min;小心移取50 μL上清液于1.5 mL EP管中;在真空浓缩器中干燥提取物;向干燥后的代谢物加入80 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于吡啶,20 mg/mL),轻轻混匀后,放入烘箱中80 ℃孵育30 min;向每个样品中加入100 μL硅烷化试剂(含有1%三甲基氯硅烷,V/V),将混合物70 ℃孵育1.5 h;冷却至室温,向混合的样本中加入5 μL饱和脂肪酸甲酯(溶于氯仿);随机顺序上机检测。
1.3.2 GC-TOF-MS测定
GC条件:进样量1 μL;采用不分流模式;隔垫吹扫流速3 mL/min;载气He;DB-5MS色谱柱(30 m×250 μm,0.25 μm);柱流速1 mL/min;升温程序:50 ℃保持1 min,以10 ℃/min升温到310 ℃,保持8 min。
TOF-MS条件:进样口温度280 ℃;传输线温度280 ℃;离子源温度250 ℃;电子能量-70 eV;质量扫描范围m/z50~500,扫描速率12.5 spectra/s,溶剂延迟时间6.17 min。
1.4 数据处理及作图
使用ChromaTOF软件(V4.3x,LECO)对质谱数据进行峰提取、基线矫正、解卷积、峰积分、峰对齐等分析[10]。物质定性使用LECO-Fiehn Rtx5数据库,包括质谱匹配及保留时间指数匹配。采用Excel 2010作图,TBtools 1.04绘制热图,SPSS 22.0对实验数据进行主成分分析(principal component analysis,PCA),结果为3 次重复实验的平均值。
2 结果与分析
2.1 酱油酿造过程中风味化合物的鉴定
如图1所示,本次实验中共检出523 个峰。通过相似度检索,从酱油样品中共鉴定出了210 种成分。根据化学结构的差异,可将它们分为12 类,分别为氨基酸及其衍生物、有机酸、糖类及其衍生物、醇类、胺类、酚类、酮类、酯类、醛类、烃类、盐类及其他。其中氨基酸及其衍生物有49 种,有机酸有47 种,糖类及其衍生物有30 种,醇类有19 种,胺类有18 种,酯类有9 种,酮类有4 种,醛类有3 种,烃类有3 种,酚类有1 种,盐类2 种,其他25 种。以下把含量甚微且种类少的挥发性化合物归为其他类物质,由此得到氨基酸及其衍生物、有机酸、糖类及其衍生物、醇类、胺类和其他类共7 大类物质。
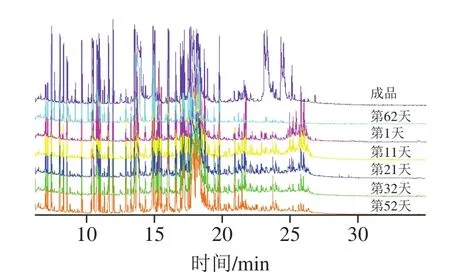
图1 不同时期酱油样品的GC-TOF-MS总离子流图Fig.1 GC-TOF-MS total ion current chromatograms of soy sauce mesh samples at different fermentation times
整个酿造周期不同酿造时间点的6 份酱醪样品中种类最多的为氨基酸及其衍生物(31.235%~71.830%)和有机酸(12.839%~22.345%),其次是胺类(1.348%~3.340%)和其他类化合物(2.502%~3.880%),而糖类及其衍生物(1.720%~39.289%)和酯类(0.123%~0.480%)在酿造后期变化最大。醇类化合物在这一酿造阶段中变化不太明显。
2.2 酱油酿造过程中风味物质的组成
由图2可知,在发酵初期,检测出的风味物质的种类有175 种;第11~32天,风味化合物的种类变化有所上升,最高有198 种;第32~52天时,其风味化合物的种类稍有下降,有189 种,此时各风味物质的总相对含量持平,变化不大;但到第62天化合物种类急剧下降至54 种。酱油酿造过程中风味物质的种类前中期呈现上升趋势,末期持续下降。说明在酱油酿造期间,其主要风味物质的形成是在酿造前中期产生的。发酵末期风味化合物种类的减少,可能是这个阶段又有酵母菌参与赋香发酵,在增加风味成分的同时难免会抑制某些化合物之间的反应,从而导致成品中化合物的种类有所减少[12-14]。
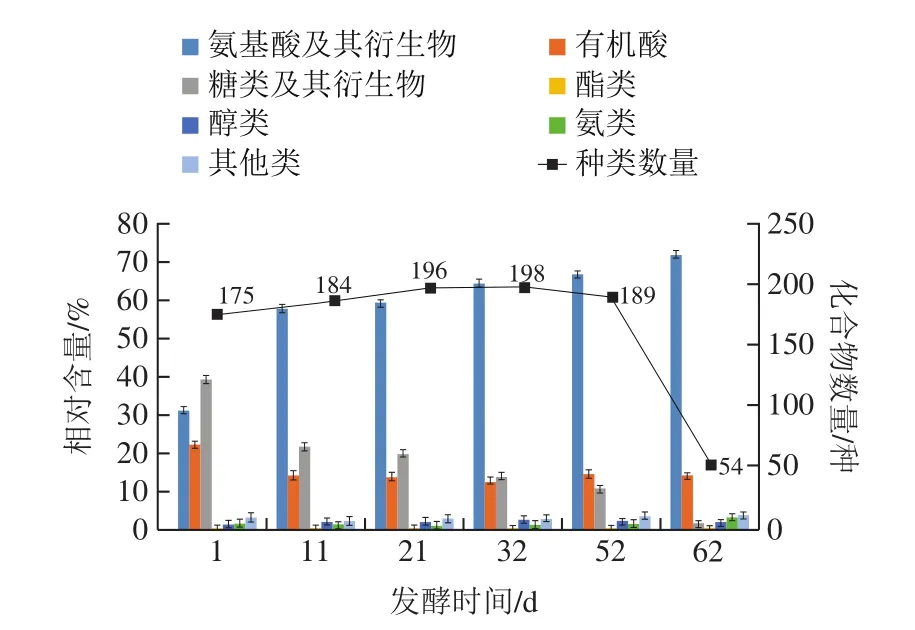
图2 酱油不同酿造时间风味物质的相对含量及化合物数量Fig.2 Changes in relative contents and types of flavor substances in soy sauce mesh with fermentation time
酿造过程中,氨基酸及其衍生物在前11 d呈现快速增加的趋势,之后增加趋势变缓。由于酱醪中的主力菌种是米曲霉,发酵前期米曲霉产生的大量蛋白酶分解原料蛋白,使氨基酸及其衍生物快速累积;第11天后曲霉的生长基本停止,但酱醪中的酶仍发挥作用[15],因此氨基酸及其衍生物相对含量增长变缓。整个发酵过程中丙氨酸和亮氨酸含量增加明显,它们对酱油的鲜味产生重要的影响,鲜味是酱油中最突出的味道[16]。
有机酸和糖类及其衍生物的相对含量则呈现下降趋势。酱油中有机酸主要由乳酸菌发酵、酵母菌发酵、脂肪酸降解和氨基酸降解后氧化还原产生,酱油酿造过程中由于乳酸和L-苹果酸的相对含量明显降低而造成有机酸总相对含量下降,很可能是后期乳酸菌和酵母由于竞争营养素和产生的特殊代谢产物互相抑制生长从而降低了有机酸的含量[17]。糖类及其衍生物是发酵过程中微生物进行生命活动的底物和能量来源,而微生物的生命活动始终贯穿整个酱油酿造过程,所以酱油中糖类及其衍生物整体相对含量不断减少[18]。酱油发酵过程中糖类及其衍生物含量大幅度下降主要源于果糖、核糖、龙胆二糖等化合物含量的降低。
醇类物质可以为酱油带来醇的酒香气味和一种怡人的花草香气[19]。酿造过程中醇类化合物的相对含量呈现先升高后降低的变化趋势,其中含量变化较大的为肌醇。酿造第1天醇类化合物的相对含量为1.664%,到第32天增加到2.728%,这时的醇类物质主要来源于酵母乙醇发酵和氨基酸的代谢,后又下降至2.000%,可能是因为醇类物质会与有机酸反应生成重要的酯类物质。
酿造过程中的胺类物质和酯类物质含量在全部风味成分中占比不大,其他风味成分在发酵过程中也不断累积,因此它们的相对含量维持在一定范围内。胺类物质主要是由微生物的氨基酸脱羧酶对游离氨基酸脱酸反应产生的,气味刺激,容易造成酱油酿造初期时带来的恶臭味[20]。
酿造过程中其他类化合物的相对含量呈现出增加的趋势,其他类化合物虽然含量很低,但因为所包含的酮类、醛类、酚类等物质种类多从而丰富了酱油的风味层面。
2.3 酱油酿造过程中风味物质的热图分析及PCA
2.3.1 酱油酿造过程中风味物质的热图分析
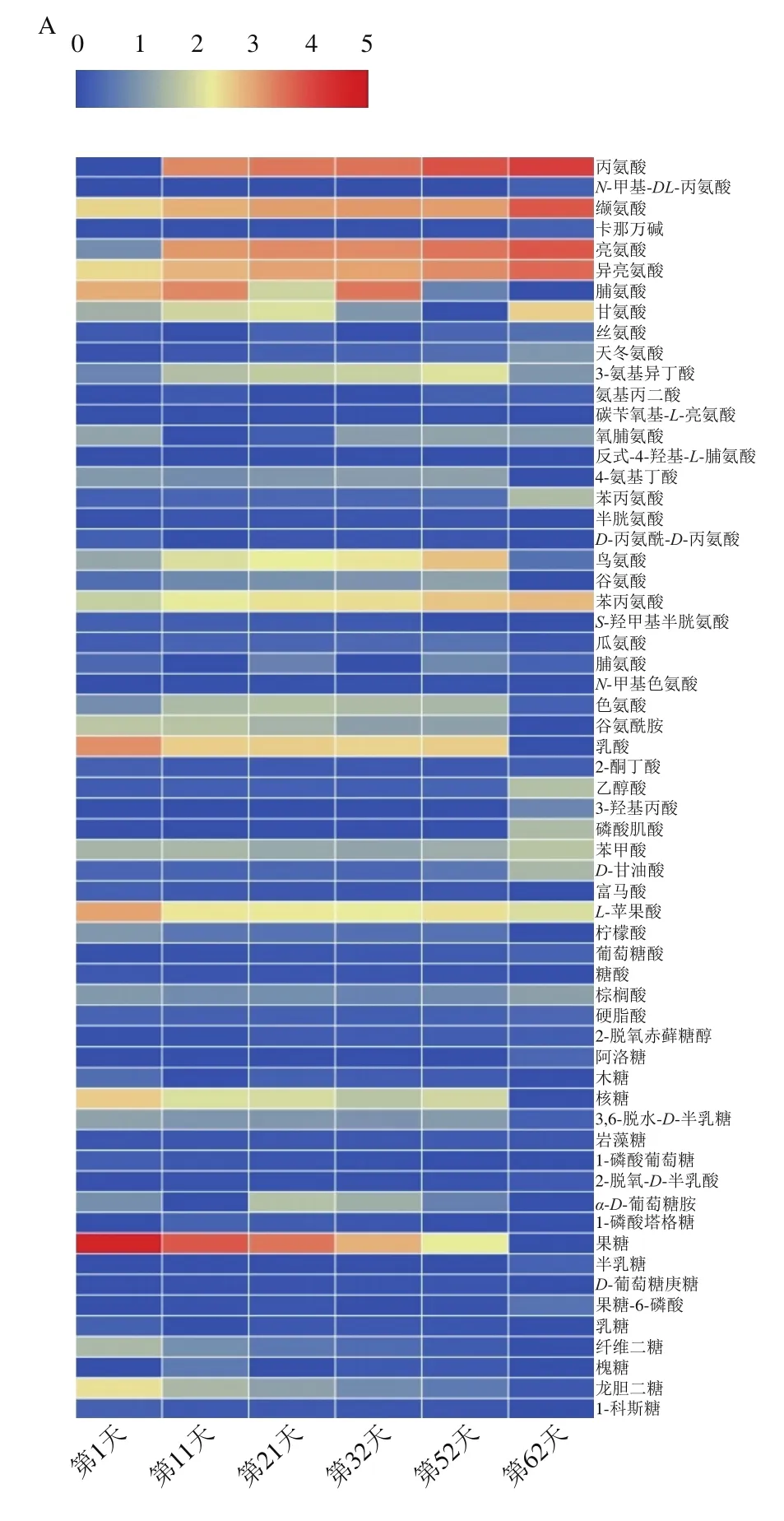
氨基酸及其衍生物、有机酸和糖类及其衍生物等多种风味物质是评判酱油滋味的重要质量指标,酯类、醇类、胺类和一些其他物质如醛类、吡啶类等挥发性风味物质尽管含量甚微,但种类繁多,因此是构成酱油风味的重要物质来源。为了进一步研究酿造过程中风味物质的变化,选取在酿造过程中检测到的含量变化较为突出的136 种风味物质并对其含量变化进行热图分析,可以直观地表现出这6 个时期组分的差异,红色越深代表含量越高,蓝色越深则代表含量越低,结果如图3所示。

图3 酱油酿造过程中风味物质含量变化的热图Fig.3 Heatmap showing changes in the contents of flavor components in soy sauce mesh during the brewing process
从图3A可以看出,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甘氨酸、脯氨酸、乳酸、L-苹果酸、3-氨基异丁酸、鸟氨酸、核糖和果糖这13 种化合物在酿造过程中含量的变化是比较明显的,说明这13 种化合物对酱油的风味有着至关重要的影响。丙氨酸、缬氨酸、亮氨酸、异亮氨酸和苯丙氨酸在整个酿造过程中的含量不断增加,甘氨酸的含量在酿造前期有所增加,中期开始减少,但在末期时增加到最大值。丙氨酸和甘氨酸能够为酱油提供甜味和鲜味[21],能增强酱油的调味效果,还能改善酱油中有机酸的酸味,使酱油风味变得柔和,起到味感缓冲作用;而缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸呈苦味,微量的苦味能给酱油增添醇厚感,赋予酱油独特的风味[22-23]。脯氨酸、乳酸、L-苹果酸、核糖和果糖的含量则在整个酿造过程中呈现下降的状态,但L-苹果酸相对含量最高,L-苹果酸酸度比柠檬酸大,酸味大却柔和,具有持久性[24];核糖和果糖等糖类及其衍生物主要由淀粉酶解生成,是酱油甜味的主要来源,能对酱油滋味有一定的缓冲作用,还能与氨基酸等一同起风味协调作用[25]。而3-氨基异丁酸和鸟氨酸在酿造前期含量不断增加,到酿造后期开始持续减少。其他氨基酸及其衍生物、有机酸和糖类及其衍生物等含量在酿造过程中增加和减少的趋势与这13 种化合物相比则较为缓慢。
从图3B可以看出,酯类、醇类、胺类等物质中,2-羟基吡啶、1,5-脱水葡萄糖醇、肌醇、乙醇胺和尿嘧啶这5 种化合物在酿造过程中含量的变化比较明显,其中,2-羟基吡啶在酿造前期含量先减少,随着酿造时间的延长,到酿造后期又逐渐增加。1,5-脱水葡萄糖醇在酿造前期变化大,但在酿造后期含量大幅减少。肌醇、乙醇胺和尿嘧啶在整个酿造过程中含量不断增加,增加的速度与其他化合物相比较为迅速。醇类和酯类物质明显能赋予酱油浓郁的醇香和酯香[26],还可抑制发酵必然产生的胺类化合物所带来的刺激感和苦味,因此挥发性物质的作用不可小觑[27-29]。
2.3.2 不同酿造时期酱油风味物质的PCA
对不同酿造时间高盐稀态酱油的风味物质相对含量值标准化后,利用PCA方法对其原始数据进行降维处理[30-32],从氨基酸及其衍生物、有机酸、糖类及其衍生物、酯类、醇类、胺类和其他物质共7 大类物质中提取出2 个PC(特征值>1),如表1所示。PC1贡献率为51.52%,PC2贡献率为39.34%,所提取的2 个PC总贡献率达到90.86%,能充分客观地反映酱油酿造过程中风味物质的变化趋势。

表1 PCA的特征值及其贡献率Table 1Eigenvalues of first two principal components and their contribution rates
如图4A所示,在PC1轴上,氨基酸及其衍生物、醇类及酯类物质呈正相关,而糖类及其衍生物呈负相关,氨基酸及其衍生物及糖类物质是酱油中鲜味及甜味的主要来源,说明PC1反映了酱油主要特征风味化合物在酿造过程的影响;PC2轴显示,有机酸、胺类、酯类及其他类物质的相关性系数较大,因此可用PC2解释这4 类物质,主要反映酱油中起修饰性的酸味及香味化合物在酿造过程的影响。
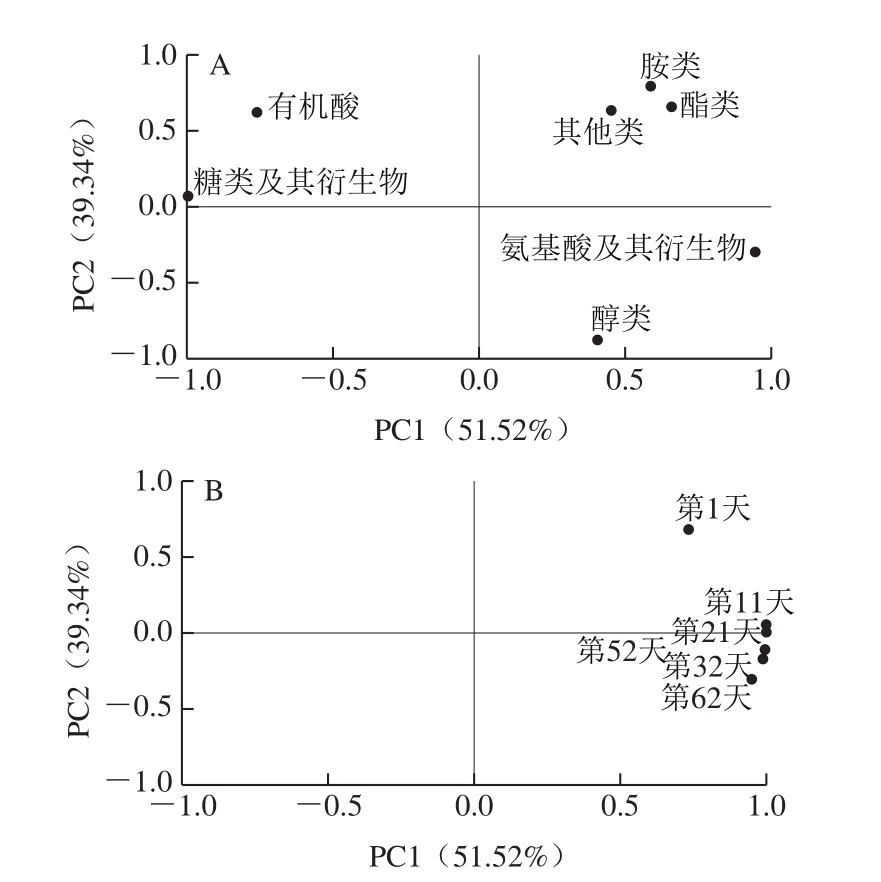
图4 酱油样品的载荷图(A)和得分图(B)Fig.4 PCA loading (A) and score (B) plots for soy sauce mesh samples at different fermentation times
从图4B可以看出,所有样品在横轴上的投影较远,说明发酵过程对于酱油的鲜甜味有较强相关性。对于同一酿造阶段的样品在PC1上投影距离大于在PC2的投影距离,说明PC1对同一酿造阶段的样品有更好的解释能力,发酵过程对氨基酸及其衍生物和糖类及其衍生物的影响较大。
而在PC2轴上,第1天的样品与其他酿造时间的样品距离较远,说明第1天的样品与其他样品的差异性较大。除第21天的样品,酿造前期的样品都分布在PC2轴上方,而酿造后期的样品都分布在PC2轴下方,说明PC2能较好地区分前酵和后酵期间的风味组分,有机酸、胺类、酯类和其他类物质对不同酿造阶段的样品解释能力较大。
3 结 论
大型发酵高盐稀态酱油在机械化生产过程中可对酿造过程的温度等环境条件进行人工控制,能够确保酱油产量和品质的同一性。本实验对大型发酵酱油酿造过程进行跟踪取样,采用GC-TOF-MS技术对高盐稀态酱油酿造过程中风味物质的动态变化进行监测,利用PCA法对不同酿造时间酱醪样品的风味物质进行分析。
氨基酸及其衍生物是酱油中含量最多的风味化合物;不同酿造时间段酱醪样品中的化合物种类不断减少,其相对含量变化也较明显。发酵前11 d,氨基酸及其衍生物的相对含量迅速增加,而糖类及其衍生物、有机酸的相对含量快速减少;之后,氨基酸及其衍生物、糖类及其衍生物、有机酸的变化趋势变缓。醇类、酯类、胺类物质和其他类物质的相对含量在发酵过程中变化不大。热图分析表明,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甘氨酸、脯氨酸、乳酸、L-苹果酸、3-氨基异丁酸、鸟氨酸、核糖、果糖、2-羟基吡啶、1,5-脱水葡萄糖醇、肌醇、乙醇胺和尿嘧啶在酿造过程中含量的变化始终比较明显,说明这18 种化合物对酱油风味有至关重要的影响。从不同酿造时间酱醪样品的风味物质中提取的2 个PC的累计贡献率达到90.86%,结果显示所有样品与PC1呈较好的相关性,表明发酵过程对贡献酱油鲜甜味的氨基酸及其衍生物和糖类及其衍生物影响较大。第1天样品与PC2呈较好的相关性,表明第1天样品对贡献修饰风味的有机酸、胺类、酯类其他类物质影响也较为显著。
