产4-乙基愈创木酚酵母的鉴定及其在酱油中的应用
2021-07-08邹谋勇何理琴孙启星朱新贵
邹谋勇,何理琴,孙启星,朱新贵
(1.李锦记(新会)食品有限公司,广东 江门 529100;2.华南农业大学食品学院,广东 广州 510642)
酱油是以大豆、面粉等为主要原料,经微生物发酵而成的一种典型的传统调味食品,它具有香气浓郁、滋味丰富的特点,在人们日常生活中不可或缺。随着生活水平的提高,人们对调味品的口感、香气等方面提出了更高的要求[1]。在酱油风味研究方面,主要有风味成分构成[2-4]和风味物质形成机理[5-7]两个重要研究方向。目前已鉴定得到超过300 种酱油的挥发性香气成分[8-9],这些挥发性香气成分相互作用,成为酱油重要特征香气成分的来源。
高沸点特征香气成分是酱油在烹饪过程持续留香的物质基础。目前从酱油中发现的高沸点香气成分有:吡嗪类化合物、呋喃酮、4-乙基愈创木酚(4-ethylguaiacol,4-EG)、4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)、苯乙醇等。在这些高沸点特征香气成分中,4-EG呈烟熏及辛香味[9-10],属酱香型香料,其作为酱油关键风味成分,具有缓和咸味作用,这在世界酿造行业得到公认[11-12]。Yokotsuka等[13]首次在酱油中发现4-EG,将其作为酱油风味成分的指标。而假丝酵母在酱油发酵后期会产生4-EG等酚类成分,赋予酱油独特风味[14]。Yasuhiko等[15]研究表明,在酱油和味噌中分离出7 株耐盐酵母,能代谢合成4-EG或4-VG;微生物转化合成4-EG途径主要是以阿魏酸为前体,通过阿魏酸脱羧酶和4-VG还原酶合成4-EG。在已发现的微生物中,部分毕赤酵母属、汉逊德巴利酵母、枯草芽孢杆菌、木糖葡萄球菌、假丝酵母等只是将阿魏酸转化为4-VG;假丝酵母、酒香酵母等可将4-VG还原为4-EG,只有少部分假丝酵母菌株可利用阿魏酸直接合成4-EG[15-17]。
近年来,利用不同菌株混合培养或通过在发酵过程中添加菌株纯培养物强化食品发酵已成为改造传统食品发酵业研究热点[18]。杨希飞[19]在酱油发酵过程中添加嗜盐四联球菌,结果显著提高了酱油中酯类物质的种类和含量,改善了酱油的风味品质。Wah等[20]将季也蒙毕赤酵母和鲁氏酵母接种到酱油酿造初期,能促进酱油挥发性风味物质的形成。Akolkar等[21]通过将Halobacteriumsp.菌悬液接种到鱼露发酵醪中,能明显改善鱼露风味,同时提高其营养价值。张良等[22]通过微生物强化接种,将酵母菌剂和嗜盐四联球菌菌剂添加到发酵后期的郫县豆瓣酱中进行联合发酵,提高了后发酵阶段郫县豆瓣酱4-EG的含量,改善了郫县豆瓣风味品质。上述研究表明,生物强化技术是提升酿造调味品风味品质的重要技术手段之一。因此,分离筛选能直接将阿魏酸代谢合成4-EG的微生物,并通过生物强化技术应用于酱油工业化生产,以提高酱油中4-EG的含量,这对于酱油类产品品质提升有重要意义。然而在4-EG菌株筛选鉴定,及其合成代谢调控方面研究文献较少,在实际生产中的应用更是鲜有报道。
基于此,本研究从酱油发酵醪中分离筛选得到1 株产4-EG的酵母A10-2,采用生理生化测试和分子生物学方法对其鉴定,然后探究其在不同盐度培养基中的生长情况。通过底物添加实验,研究4-EG代谢合成途径。采用A10-2开发高4-EG含量的半成品,并应用于酱油调配,分析其对产品风味的影响。
1 材料与方法
1.1 材料与试剂
酱油发酵醪 李锦记(新会)食品有限公司。
麦芽汁培养基:13%麦芽汁培养基;酵母膏胨葡萄糖琼脂(yeast extract peptone dextrose,YPD)培养基:1%酵母浸粉,2%葡萄糖,2%胰蛋白胨,15% NaCl;酱醪发酵液培养基:取发酵2 周酱油发酵醪,10 层纱布过滤,上清液为酱醪发酵培养基;发酵培养基:10%巴氏杀菌酱油,0.5%酵母浸粉,2%葡萄糖,0.5%胰蛋白胨,15% NaCl。
麦芽汁培养基、技术琼脂 广东环凯微生物科技有限公司;生理生化实验试剂 生工生物工程(上海)股份有限公司;麦芽浸粉、胰蛋白胨 北京路桥技术股份有限公司;阿魏酸、4-EG(99%) 上海阿拉丁生化科技股份有限公司;其他生化试剂均为分析纯 广州化学试剂厂。
1.2 仪器与设备
Blue Star紫外-可见分光光度计 北京莱伯泰科仪器股份有限公司;7820A-5977B气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)仪美国安捷伦科技有限公司;固相微萃取手柄、50/30 μm DVB/CAR/PDMS萃取头 美国色谱科公司。
1.3 方法
1.3.1 产香酵母分离
取不同发酵阶段的酱油发酵醪,用0.85%生理盐水稀释一定梯度后涂布含有麦芽汁培养基的平板上,30 ℃静置培养96 h,挑取单菌落进行进一步划线分离纯化。挑取纯化后的菌株接种于YPD培养基,30 ℃、200 r/min振荡培养41 h,得到种子液,将种子培养液按1%分别接种到酱油发酵液培养基;然后30 ℃、100 r/min振荡培养13 d,进行香气鉴评,将呈酱香发酵液对应的菌株命名为A10-2。
1.3.2 产香酵母A10-2挥发性风味成分分析
对A10-2发酵液顶空固相微萃取并进行GC-MS分析。取2 mL样品于4 mL样品瓶中,将萃取头插入到样品瓶的顶空部分,40 ℃保温萃取时间30 min。萃取结束后,立即进样,解吸时间为2 min。色谱条件:色谱柱为DB-WA×U2毛细管柱(30 m×0.32 mm,0.25 μm);升温程序:起始温度40 ℃,保持5 min,以2 ℃/min升温至150 ℃,再以5 ℃/min升温至240 ℃,保留10 min;进样口温度250 ℃;载气为He(99.999%)。质谱条件:电离能70 eV,检测电压1 510 V;离子源温度230 ℃,四极杆温度150 ℃;扫描速率2.00 scans/s,质量扫描范围m/z20~350。GC-MS得到挥发性风味物质总离子流图,手动积分计算与数据库标准物质相似度80%以上风味物质的峰面积,风味物质峰面积与总峰面积的比值为该物质的相对含量。
4-EG定量分析:取5 mL培养液,加入30 mL乙醚,萃取3 次;收集上层萃取液真空浓缩,并溶于无水乙醇,根据浓度合理稀释并用GC-MS进行定量分析。具体如下:气相色谱载气为氦气,流速1.0 mL/min,进样量1.0 μL,分流比10∶1;升温程序:40 ℃保留1 min;以10 ℃/min升温到210 ℃,保留0 min;再以10 ℃/min升温到250 ℃,保留3 min。质谱条件:采用电子电离方式,电离能70 eV,检测器电压1 597 V,扫描范围m/z30~200,扫描速率2.00 scans/s;进样口和离子源温度分别为250 ℃和230 ℃。采用单离子扫描模式,以m/z91、122、137和152.0四个离子为定量离子进行分析。4-EG标准曲线制作:取色谱纯4-EG梯度稀释到质量浓度10、20、70、100 mg/L,采用上述色谱和质谱条件检测不同质量浓度4-EG的定量离子峰面积,线性回归得到标准曲线方程为:y=1.171×105x+1.125×105(R2=0.995 4),其中y为响应值,x为4-EG含量。以标准曲线计算样品中4-EG含量。
1.3.3 生理生化实验
参照文献[23]对A10-2进行生理生化实验。
1.3.4 A10-2菌株分子鉴定
自菌株A10-2基因组聚合酶链式反应(polymerase chain reaction,PCR)扩增rDNA-ITS序列。30 μL PCR体系:20 ng DNA模板(菌株A10-2基因组),25 pmol通用引物(ITS1:5’-TCCGTAGGTGAACCTGCGG-3’;ITS4:5’-TCCTCCGCTTATTGATATGC-3’),100 μmol/L dNTP,1 mmol/L MgCl2和2.5 U HiFi DNA聚合酶,PCR产物由华大基因测序。通过BLAST(http∶//blast.ncbi.nlm.nih.gov/)数据库进行ITS rDNA同源序列检索与分析。
1.3.5W.versatilisA10-2耐盐实验
挑取A10-2单菌落接种于YPD培养基,30 ℃、200 r/min振荡培养41 h ,得到A10-2种子液。取200 mL种子培养液4 000 r/min离心10 min,菌体沉淀采用0.85%生理盐水洗涤2 遍,再用0.85%生理盐水重悬,并定容到200 mL。将种子液按照5%接种量分别接种含0%、5%、10%、14%、18% NaCl的麦芽汁培养基,按照一定的时间间隔取培养液在600 nm波长处测定OD值。
1.3.6W.versatilisA10-2菌株在不同底物培养基中代谢产生的挥发性风味物质分析
挑取A10-2单菌落接种于YPD培养基,30 ℃、200 r/min振荡培养41 h,得到种子液,将种子培养液按1%分别接种到以下发酵培养基:第1组发酵培养基添加50 mg/L阿魏酸,第2组发酵培养基添加30 mg/L 4-VG。然后30 ℃、100 r/min振荡培养11 d,将呈酱香发酵液进行GC-MS分析。
1.3.7W.versatilisA10-2在酱油发酵中的应用
A10-2种子液制备方法同1.3.5节,将种子液按照2%接种到巴氏杀菌酱油发酵液,对照组加入2% YPD培养基。30 ℃、100 r/min振荡培养一定的时间,取发酵液进行理化指标测定,同时检测发酵液中4-EG质量浓度。
1.3.8 感官评价
取巴氏杀菌酱油发酵液,添加50 mg/L阿魏酸,接种A10-2发酵12 d,取发酵液过滤,并进行巴氏杀菌(70 ℃,30 min);巴氏杀菌后的发酵液冷却后按照10%添加到成品酱油中,从李锦记(新会)食品有限公司技术部、质检部和品控部随机选取8 位受到系统培训的的品评员进行盲评。口感方面分别从咸味、鲜味、苦味、甜味、酸味、厚味、综合口感、偏爱程度8 个维度对样品进行评分;香气方面分别从酸味、豆香、麦芽香、焦香、醇香、综合香气、酱香、偏爱程度8 个维度对样品进行评分。评分方法为:每个维度满分为10 分,感官强度大则得分高;每位品评员对每组样品盲评3 次,时间间隔30 min,计算平均分,各维度得分为8 位品评员的评分算术平均数。
1.4 数据分析
GC-MS总离子流图为GC-MS数据处理软件导出;耐盐性分析结果采用OriginPro 8.5进行绘图,感官评价结果采用Microsoft Office Excel绘制雷达图。
2 结果与分析
2.1 产香酵母A10-2挥发性风味成分的鉴定
采用顶空固相微萃取-GC-MS对添加A10-2种子液连续发酵13 d的酱油发酵液进行挥发性物质分析,结果如图1所示。实验组挥发性成分中含有多种醇类物质,包括乙醇、异丁醇、异戊醇、苯乙醇、β-乙基苯乙醇等,其中苯乙醇含量较高;对照组检出了乙醇和异戊醇,实验组检出峰面积相对较大,说明A10-2具有进一步合成乙醇、异戊醇的能力(表1)。同时,实验组在51.863 min检出了4-EG,说明A10-2具有利用酱油本底前体物质合成4-EG的能力。研究发现Candida guilliermondii和C.fermentati可以利用阿魏酸合成4-VG,并进一步还原为4-EG;该过程涉及的两个关键酶分别为阿魏酸脱羧酶和4-VG还原酶[15]。
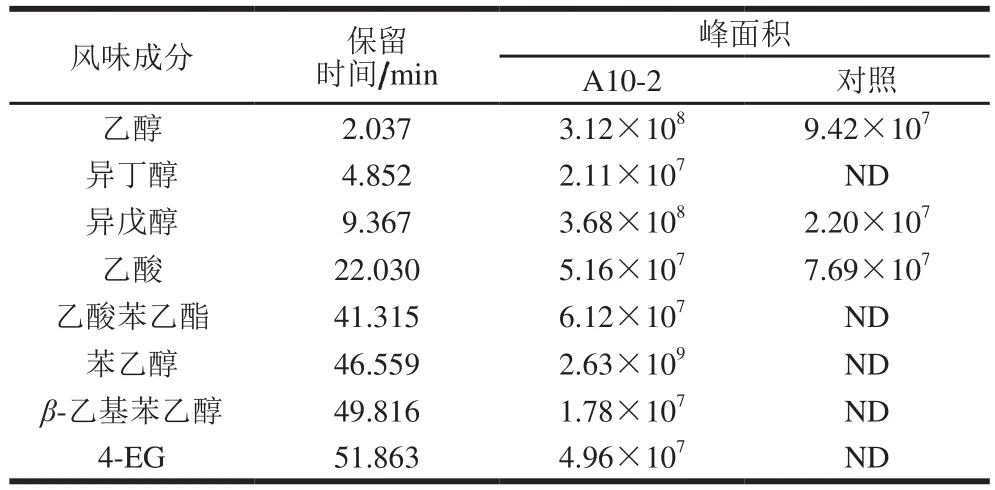
表1 产香酵母A10-2挥发性风味成分相对定量分析Table 1Relative quantitative analysis of volatile flavor compounds from A10-2
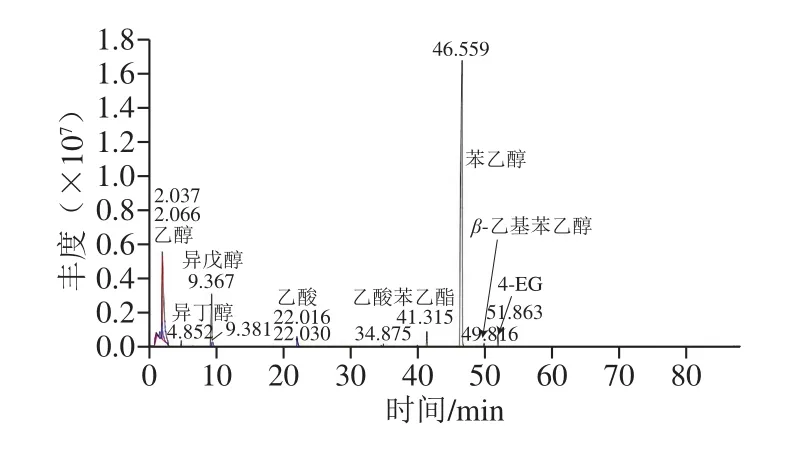
图1 GC-MS对产香酵母A10-2挥发性风味成分分析Fig.1 Analysis of flavor components from A10-2 by GC-MS
2.2 产香酵母A10-2形态特征
如图2a所示,产香酵母A10-2在麦芽汁平板上菌落淡黄色,奶油状,菌落边缘整齐暗淡无光泽。显微镜观察发现,A10-2均为球状或椭球状,菌体直径为1~5 μm,可见出芽生殖(图2b)。根据A10-2菌落形态和菌体显微镜观察初步推测其为酵母类微生物。
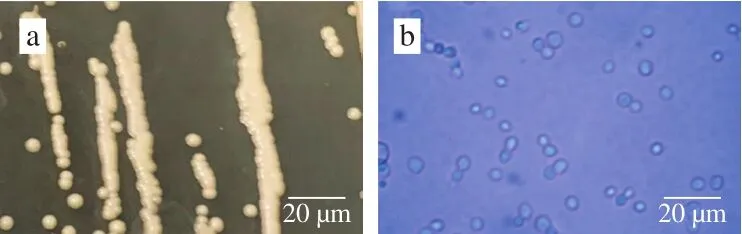
图2 产香酵母A10-2菌落形态(a)与菌体形态(b)Fig.2 Colonial morphology (a) and thallus morphology (b) of A10-2
2.3 产香酵母A10-2生理生化鉴定
如表2所示,A10-2发酵葡萄糖能力较强,发酵半乳糖能力较弱,不能发酵木糖、阿拉伯糖、麦芽糖等糖类物质;除海藻糖、乳糖、赤藓糖外,能同化已测试的全部糖类,不能利用淀粉,可以同化甘露醇、乙醇和甘油。此外,A10-2可以同化硝酸钠,在37 ℃温度下能较好生长,在高盐(18% NaCl)环境中也能增殖,在无维生素培养中能缓慢生长,而脲酶、50%葡萄糖、1%乙酸测试均为阴性。采用文献[23]方法进行生理生化特征比对,初步鉴定A10-2为Wickerhamiella属微生物。
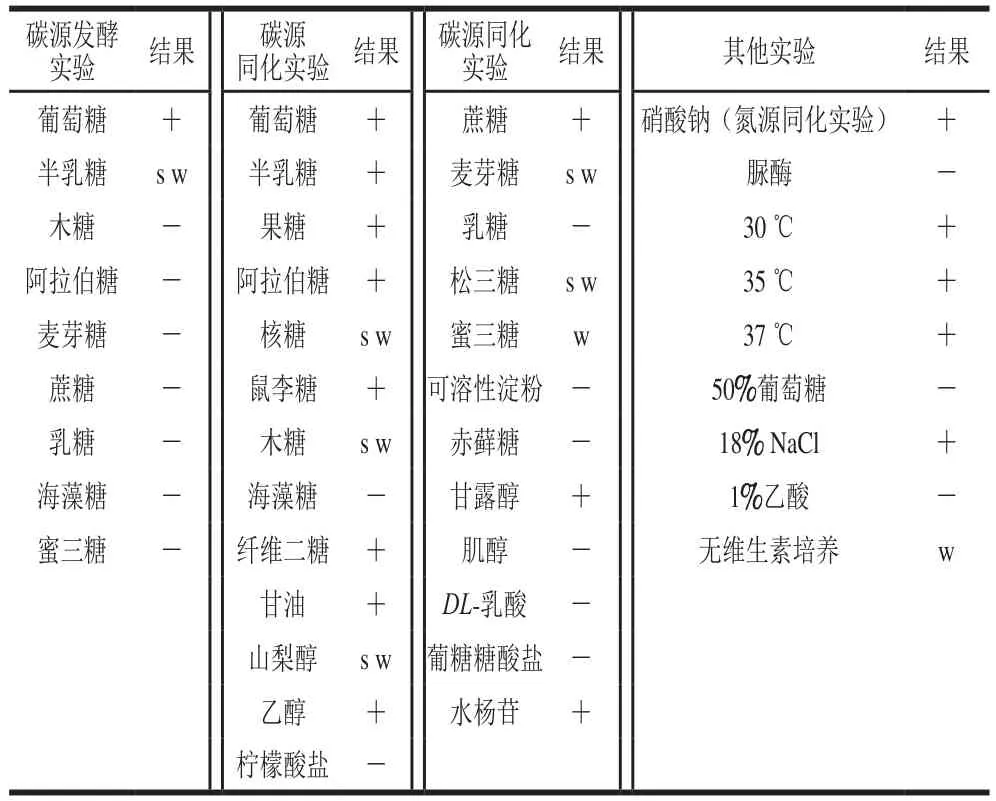
表2 产香酵母A10-2生理生化测试结果Table 2Physiological and biochemical identification of A10-2
2.4 产香酵母A10-2分子生物学鉴定
为进一步鉴定A10-2的分类学地位,对其ITS rDNA序列进行克隆,PCR扩增产物琼脂糖凝胶电泳结果见图3,显示其片段长度约450 bp。DNA测序结果表明PCR扩增到的ITS rDNA序列长度为434 bp。该序列提交GenBank并进行BLAST分析,结果显示A10-2与Wickerhamiella versatilis相似性为100%。综合形态学观察、生理生化测试和分子生物学鉴定,初步确定A10-2为W.versatilis。Clara等[24]通过分类学研究将Brettanomyces versatilis转为W.versatilis,Brettanomyces属微生物是葡萄酒发酵中重要的微生物,具有代谢酚类物质的能力,对葡萄酒风味的形成有重要贡献[25]。因此推测W.versatilis在酱油酚类化合物代谢中发挥重要作用。
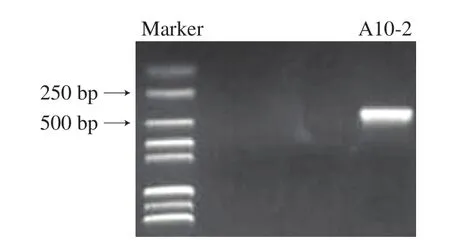
图3 琼脂糖凝胶电泳检测A10-2 ITS rDNA序列PCR产物Fig.3 Agarose gel electrophoresis of PCR products of ITS rDNA sequence from A10-2
2.5 W.versatilis A10-2耐盐性分析
如图4所示,NaCl质量分数对A10-2生长曲线影响显著,当NaCl质量分数为5%时,最适宜A10-2生长,NaCl质量分数为18%时,生长延迟期明显延长,延迟期达到30 h。说明A10-2具有一定的耐盐性,可以在高盐(18% NaCl)环境中生长,但细胞增殖速率受到一定程度的抑制。
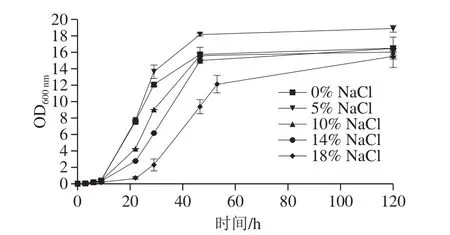
图4 A10-2在不同质量分数NaCl麦芽汁培养基中生长曲线分析Fig.4 Growth curves of W.versatilis A10-2 in media with various NaCl concentrations
2.6 W.versatilis A10-2菌株4-EG合成代谢途径分析
已有文献表明,酵母类微生物可以利用阿魏酸作为前体物质代谢合成4-EG,主要中间代谢产物为4-VG[15]。因此,本研究将阿魏酸、4-VG作为底物分别添加发酵培养基,接种W.versatilisA10-2进行发酵,以分析菌株的4-EG合成代谢途径,结果如图5所示。添加阿魏酸或者4-VG后,发酵液中均检出了大量的4-EG;其中阿魏酸组同时检出了4-VG(图5a),4-VG组检出的4-VG相对峰面积较对照组下降了89.4%(图5b,表3)。表明W.versatilisA10-2主要以阿魏酸为底物,在阿魏酸脱羧酶的作用下脱去羧基得到中间产物4-VG,进一步通过4-VG还原酶催化得到4-EG。已有研究表明C.versatilis具有将阿魏酸代谢成为4-VG和4-EG的能力,其代谢能力受到发酵条件的影响;在酱油中C.versatilis代谢阿魏酸合成4-VG和4-EG的得率约为20%[26]。在细菌研究中发现Bacillus pumilusS-1具有快速将阿魏酸代谢成为4-VG的能力[27]。但是关于Wickerhamiella代谢酚类化合物的研究鲜有报道。
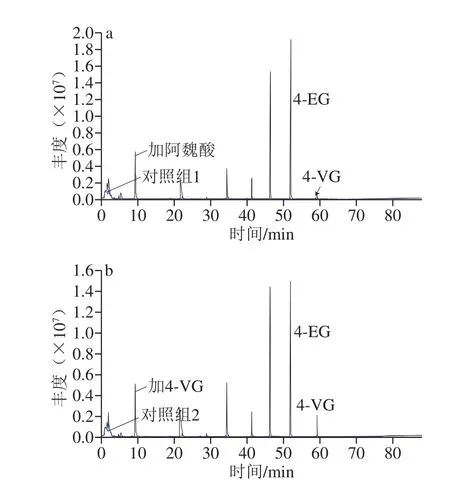
图5 W.versatilisA10-2菌株代谢4-EG合成前体物质的能力分析Fig.5 Analysis of the ability of W.versatilis A10-2 to metabolize precursor substances of 4-EG

表3 W.versatilis A10-2代谢合成4-EG和4-VG相对含量Table 3Relative quantitative analysis of 4-EG and 4-VG from W.versatilis A10-2
2.7 W.versatilis A10-2在酱油中的应用
添加W.versatilisA10-2种子培养液到酱油发酵液中,其理化指标测定结果如表4所示,实验组氨基酸态氮与对照组(未接种A10-2)相近,总酸较对照组有一定幅度提升,而还原糖、pH值有一定幅度降低,推测主要原因是还原糖被W.versatilisA10-2代谢利用,并产生了一定量的酸性物质。上述结果表明,W.versatilisA10-2应用于酱油发酵液,对氨基酸态氮影响不显著,可轻微提高总酸含量,并降低还原糖含量。
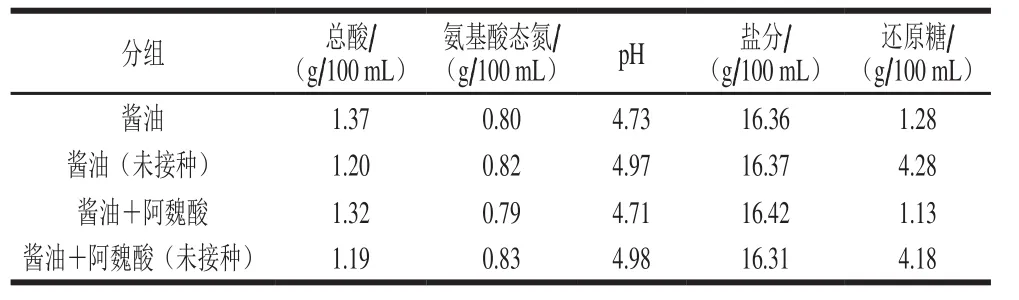
表4 W.versatilis A10-2添加对酱油发酵液理化指标的影响Table 4Effect of W.versatilis A10-2 on physicochemical indexes of soy sauce mash
为了验证W.versatilisA10-2在酱油发酵液中4-EG的代谢能力,采用GC-MS对上述发酵液进行了4-EG定量分析,结果如表5所示。发酵12 d,4-EG质量浓度为0.63 mg/mL,添加阿魏酸后4-EG含量质量浓度进一步提高为12.05 mg/mL(表5),对照组(未接种A10-2)未检出4-EG。这一结果证实W.versatilisA10-2可在酱油发酵液中合成4-EG,添加阿魏酸可以显著提高4-EG含量,因此认为其具有优化提高酱油发酵液4-EG含量的应用潜力。研究发现微生物代谢是酱油风味物质的形成重要因素,建立酱油微生物组学、代谢组学和风味物质谱的联系是未来酱油风味研究的重要方向[28]。在酱油耐盐酵母的应用中,Sluis等[29]发现固定化Zygosaccharomyces rouxii、C.versatilis细胞对于加快酱油风味物质的积累有重要意义。同时,Tetragenococcus halophilus和C.versatilis共同培养与酱油风味物质的形成高度相关,并发现T.halophilus对酱油鲜味物质的形成有重要贡献[30]。因此,耐盐酵母在酱油发酵中的应用对于提升酱油风味品质有非常重要的意义[31]。如图6所示,香气鉴评表明,将添加W.versatilisA10-2得到的高4-EG含量酱油发酵液调配到成品酱油中,香气方面,可以一定程度上提升成品酱油酱香、醇香和焦香;口感方面,可一定程度缓和咸味,同时能够提升鉴评人员的偏好程度。说明其在酱油风味和口感改善的方面有较大的应用前景,对于迎合消费者需求具有重要意义。

表5 W.versatilis A10-2添加对酱油发酵液中4-EG含量的影响Table 5Effect of W.versatilis A10-2 on content of 4-EG in soy sauce mash
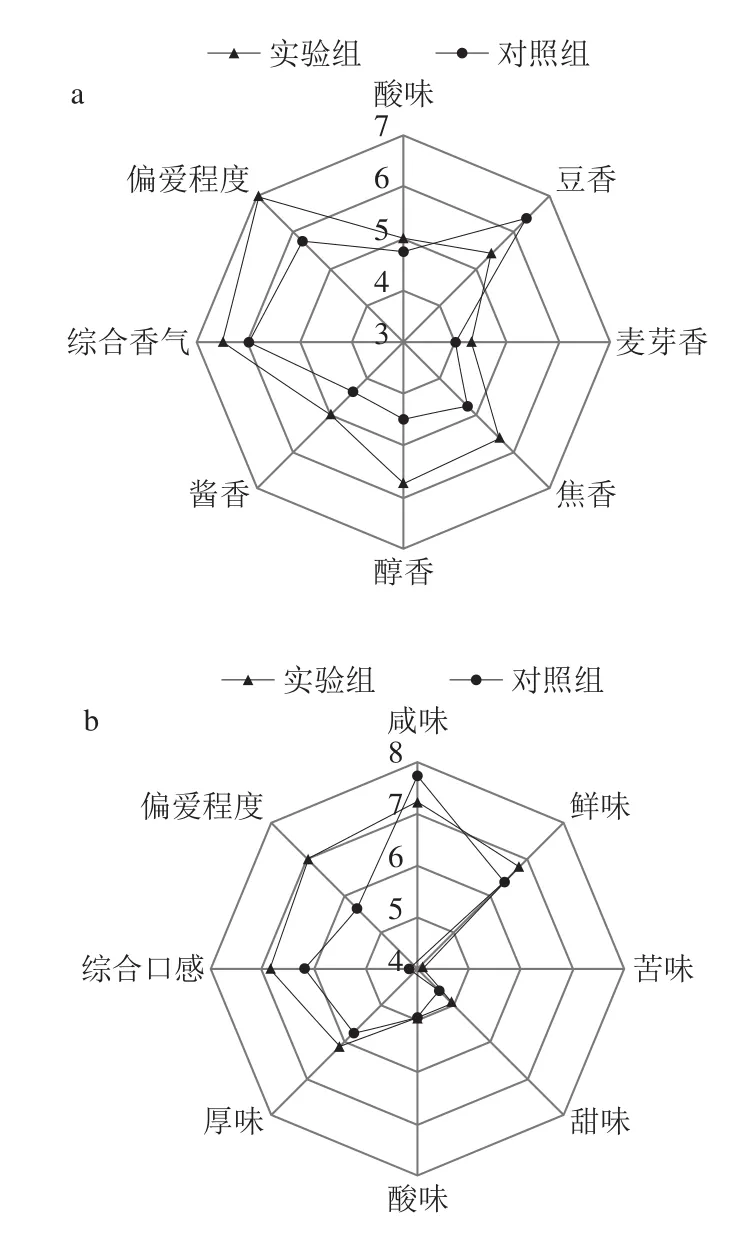
图6 W.versatilis A10-2高4-EG含量酱油发酵液对酱油香气(a)和滋味(b)的影响Fig.6 Effect of high 4-EG concentration in fermentation broth of W.versatilis A10-2 on aroma (a) and taste (b) of soy sauce
3 结 论
EG是酱油中关键风味物质,也是典型酱香味的特征风味物质之一,一定浓度的4-EG对酱油的风味起到至关重要的作用。本研究从酱油发酵醪中分离得到1 株产4-EG的酵母菌株A10-2。采用微生物常规鉴定手段和分子生物学方法研究A10-2的种属关系,初步鉴定其为W.versatilis。W.versatilisA10-2可以耐受18% NaCl,能利用阿魏酸合成4-VG,并可将4-VG还原为4-EG。在酱油发酵液中添加阿魏酸时,W.versatilisA10-2可以将4-EG质量浓度提高到对照组的19.1 倍。在成品酱油中添加高4-EG含量酱油发酵液,可显著改善酱油酱香和醇香。上述结果显示出W.versatilisA10-2在提升酱油4-EG含量、改善酱油香气方面的巨大潜力。在大罐酱油发酵风味普遍偏弱的情况下,生物强化4-EG含量对于提升酱油品质有重要意义;因此,调控W.versatilisA10-2在酱油发酵醪中的生长和代谢,稳定实现酱油风味改良是下一步的研究重点。
