EGCG对大豆蛋白结构的调控机理
2021-07-08赵思明江连洲王冬梅隋晓楠周麟依范志军
赵思明,江连洲,王冬梅,隋晓楠,周麟依,*,范志军,,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江省北大荒绿色健康食品有限责任公司,黑龙江 佳木斯 154000)
大豆分离蛋白(soy protein isolate,SPI)是一种常用的食品添加剂,其优良的功能性可被应用到食品中满足人们的需求。在食品加工中大豆蛋白具有的天然功能性质不足以满足食品工业对其功能性的需求,因此,通过对大豆蛋白分子结构的改良,从而使理化性能得到改变,进而达到对蛋白质功能性质加强或改善的目的[1]。近些年,国内外有很多学者对蛋白质的热聚集行为进行研究,主要集中在中性条件下的热处理,且处理温度低于100 ℃。在中性条件下,蛋白质受热而改变结构和功能会受到热处理温度、蛋白质浓度及离子强度的影响[2]。王喜波等[3]研究加热、超声、高压均质、微波4 种改性方法对SPI乳化性的影响,结果表明:SPI在121 ℃下,热处理10 min后的柔性和乳化活性最高,同时高压均质对SPI的乳化性影响大、柔性影响小。当乳清蛋白溶液被加热时,会发生几种反应,如聚合或共价和非共价(静电和疏水)反应,由于这些相互作用,乳清蛋白变性,巯基暴露,暴露的游离巯基和二硫键之间的反应导致聚集[4]。在80 ℃以下对大豆球蛋白进行热处理时,随着处理温度升高,大豆蛋白的聚集率显著增加且聚集体的尺寸迅速增加[5]。在热处理温度为75~85 ℃时,豌豆11S球蛋白的亚基发生了解离和重组同时产生无规则的聚集体[6]。
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是儿茶素中抗氧化性最强的一种多酚组分,是一种非酶抗氧化剂,其比VE的抗氧化活性高20 倍,在抗癌、抗炎及预防心脑血管疾病等方面表现出来的优良药理活性均与其超强的抗氧化活性有关,具有优良的生物活性[7-8]。多酚作为天然的小分子活性物质对大豆蛋白的结构具有调控作用,二者之间可以形成重要的复合体系,进而改变蛋白质的结构及功能性。多酚与蛋白质的相互作用方式主要分为共价与非共价形式,包括二硫键、氢键、离子键、疏水键、共价键等[9]。Adrar等[10]发现多酚和蛋白质之间主要是非共价疏水相互作用,可通过氢键稳定。Chen Gang等[11]利用高压处理分析蛋白质与多酚之间的结合机理,发现二者之间的结合是通过疏水作用力驱动的。Haslam等[12]发现多酚与蛋白之间主要是非共价作用,这些非共价作用大都是由多点疏水相互作用与氢键结合进行。在多酚与蛋白质的互作过程中,当二者的结合位点数大体相等的情况下,才能最大情况的进行络合,形成最多的络合物,所以需要二者的浓度比适中[13]。Rohn等[14]对牛血清白蛋白与槲皮素结合作用进行研究,发现二者之间物质的量比为2∶1时结合最多。綦菁华等[15]研究表明蛋白质-多酚聚合物的浊度随着蛋白质或多酚浓度的增大而增大,当浊度增大到某一峰值后开始下降。
热处理环节在喷雾干燥、复性等生产加工过程中必不可少,而不可避免地会对大豆蛋白的结构及功能性质造成影响。EGCG作为茶多酚提取物儿茶素中的最主要活性成分,具有很强的抗氧化性及抗癌等功效,却鲜有出现EGCG单体对大豆蛋白结构调控机理的探究。本实验通过对不同浓度EGCG-SPI复合物进行热处理,以及温度对EGCG-大豆蛋白复合体结构的影响,拓宽大豆蛋白食品的应用范围,为生产功能型EGCG-大豆蛋白复合产品提供理论依据,同时对复合物的开展与实施具有一定的现实意义与应用价值。
1 材料与方法
1.1 材料与试剂
大豆(东农46号) 黑龙江省农科院;EGCG(分析纯) 西安首禾生物科技有限公司;盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠(分析纯) 北京新光化工试剂厂;其他化学试剂均为分析纯。
1.2 仪器与设备
GL-20G-II高速冷冻离心机 上海卢湘仪离心机仪器公司;FD5-3型冷冻干燥机 美国SIM公司;PHSJ-4A型实验室pH计 中国上海雷磁公司;MSE70电子分析天平(0.000 1 g) 北京赛多利斯仪器系统有限公司;F-4500荧光分光光度计 日本Hitachi公司;TU-1800紫外-可见分光光度计 郑州飞旭光谱仪器有限责任公司;Raman Station 400拉曼光谱仪 美国PerkinElmer公司。
1.3 方法
1.3.1 SPI的制备
参考Meinlschmidt等[16]的方法。将新鲜的大豆用粉碎机粉碎成粉过60 目筛,将大豆粉与正己烷按照1∶3(g/mL)的料液比进行充分混合并在室温下搅拌2 h,然后进行3 次脱脂,将得到的大豆粉与去离子水按照1∶10(g/mL)比例混合。用2 mol/L NaOH溶液将混合液pH值调节至8.5后,在室温下搅拌2 h,然后对混合液9 000×g离心20 min得到上清液,用2 mol/L HCl溶液将其pH值调节至4.5。将调节过pH值的上清液静置2 h后6 000×g离心20 min,进而除去上清液得到蛋白沉淀。最后将蛋白沉淀溶于去离子水中得到蛋白质溶液,用2 mol/L NaOH溶液将其pH值调节至7.0。将蛋白溶液在-40 ℃条件下进行24 h的预冻处理,后放入冷冻干燥机中进行干燥后得到粉末状的SPI。
1.3.2 SPI-EGCG复合体系制备
用0.01 mol/L磷酸盐缓冲液(pH 7.4)溶解SPI粉末制成溶液,质量浓度为1 mg/mL,使用磁力搅拌器搅拌30 min,保证SPI的充分溶解。按0、0.05、0.1、0.15 mg/mL的质量浓度将EGCG分别溶于SPI溶液中并在室温下磁力搅拌2 h,使SPI与EGCG充分混合互作,制成SPI-EGCG复合体系。按照同样的方法制备出SPI-EGCG复合体系在85 ℃下水浴加热15 min后立即进行冰浴冷却至室温。
1.3.3 SPI与EGCG结合机理分析
制备质量浓度为0.2 mg/mL的SPI溶液,取10 mL SPI溶液置于若干试管中,按照0、0.05、0.1、0.15 mg/mL将EGCG分别溶于蛋白溶液中,利用涡旋振荡器对SPI-EGCG溶解进行振荡混匀后,分别在25、33、41 ℃的恒温水浴锅中进行水浴保温5 min。利用荧光分光光度计连续扫描测定样品测定荧光强度,荧光测定使用四面透光比色皿,选择激发波长280 nm,扫描波长为300~500 nm,激发狭缝为5 nm,同样发射狭缝宽也为5 nm,重复扫描3 次求平均值。
1.3.4 SPI-EGCG复合体系结合度的测定
根据Rodríguez等[17]的方法稍作修改,对SPI-EGCG复合体系中SPI与EGCG结合度进行测定。首先制备EGCG的标准曲线,然后将不同质量浓度的EGCG与SPI复合体系分别经截留3 kDa的透析袋在4 ℃条件下进行避光透析12 h,然后使用高效液相色谱测定透析液中EGCG在波长520 nm处的吸光度并计算其含量。复合体系中SPI与EGCG的结合度按式(1)计算:
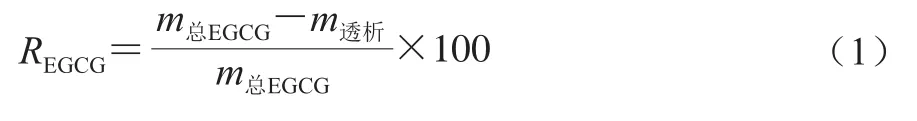
式中:REGCG为复合体系中EGCG与SPI结合率/%;m总EGCG为EGCG总质量/mg;m透析为透析液中未结合的游离EGCG质量/mg。
1.3.5 SPI-EGCG复合体系的红外光谱测定
将SPI-EGCG复合体系进行冷冻干燥得到冻干粉末,将一定质量的溴化钾与1 mg的冻干粉末进行充分混合后压片。在25 ℃条件下,采用红外光谱仪对压片谱带进行扫描,将分辨率设为4 cm-1,扫描范围为4 000~400 cm-1,扫描次数为64。采用Peakfit Version软件将样品峰进行拟合,使相似率达到99.9%,通过蛋白质二级结构波谱条带指认表对二级结构中各组分的相对含量进行确定[18]。
1.3.6 SPI-EGCG复合体系的拉曼光谱测定
利用拉曼光谱仪选择条件为激发光波长785 nm,激光功率80 mW,扫描波数谱段范围400~2 000 cm-1,每次扫描的时间为60 s,积分10 次,4 次扫描进行累加。采用ACD Labs V12软件对SPI-EGCG复合体系的拉曼谱图进行基线校正、谱峰归属查找。
1.3.7 SPI-EGCG复合体系荧光光谱测定
使用F-4500荧光分光光度计对SPI-EGCG复合体系的荧光光谱进行测定。将热处理前后的SPI-EGCG复合体系进行适当稀释。设置荧光光谱的测定条件:激发波长290 nm,扫描波长300~500 nm,激发狭缝与发射狭缝宽均为5 nm。
1.3.8 SPI-EGCG复合体系紫外-可见光谱测定
采用磷酸盐缓冲液(0.01 mol/L,pH 7.4)对热处理前后的样品进行稀释,使样品中SPI质量浓度为0.5 mg/mL,取200 μL稀释后的样品溶液置于96 孔板中,用紫外分光光度计对稀释后样品的吸收光谱进行测定,扫描波长为260~350 nm。
1.4 数据统计
2 结果与分析
2.1 EGCG与SPI结合机理
SPI是一种荧光物质,这是由于其结构中含有色氨酸(Trp)、酪氨酸(Tyr)及苯丙氨酸(Phe)等发色基团[19]。溶液中的溶质与荧光物质的相互作用的现象叫作荧光猝灭作用[19]。荧光猝灭作用机制有2 种,分别是动态猝灭和静态猝灭。通过Stern-Volmer方程(2)的计算可以判断出物质之间的猝灭类型[20]:
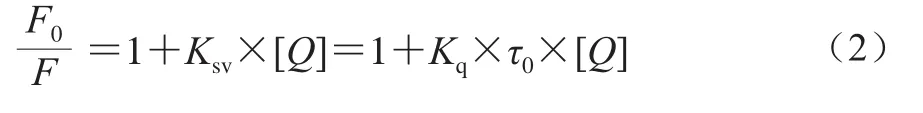
式中:F0为加入猝灭剂前SPI溶液的荧光强度;F为加入猝灭剂(EGCG)后SPI溶液的荧光强度;[Q]为EGCG浓度/(mol/L);Kq为双分子猝灭速率常数/(L/(mol•s));Ksv为动态猝灭常数/(L/mol);τ0为猝灭剂(EGCG)不存在时荧光体的寿命,生物大分子的平均寿命约为10-8s[21]。
根据Stern-Volmer方程作图,以[Q]为自变量,F0/F为因变量,得到EGCG对SPI的内源光猝灭曲线图,由直线的斜率可以计算SPI-EGCG复合体系的动态猝灭常数及双分子猝灭速率常数(图1A),结果见表1。如果Stern-Volmer曲线斜率随着温度的升高而增,即猝灭常数增大,EGCG对SPI的猝灭方式为动态猝灭,反之则为静态猝灭。由图1A可以看出,SPI的Stern-Volmer曲线斜率随着温度的升高而减小,说明EGCG对SPI的猝灭方式为静态猝灭。正常条件下猝灭剂对于生物大分子的最大猝灭常数为2×1010L/(mol•s)[22],由图1B可知,EGCG对SPI的荧光猝灭速率数量级均为1012,高于2×1010L/(mol•s),此结果进一步说明EGCG对SPI猝灭方式为静态猝灭。
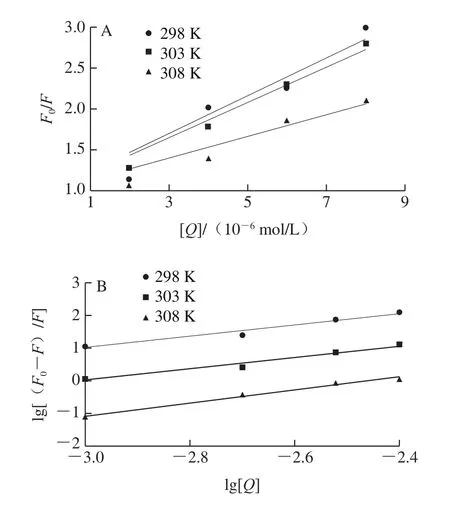
图1 不同温度条件下EGCG猝灭SPI的Stern-Volmer(A)和双对数图(B)Fig.1 Stern-Volmer (A) and double logarithmic plots of EGCG quenching SPI under different temperature conditions
通过式(3)可以求得静态猝灭过程中EGCG与SPI之间的结合位点数n:

式中:Ks为表观结合常数;n为结合位点数。
按式(3)计算,以lg[(F0-F)/F]对lg[Q]作双对数曲线图,根据图1中的曲线斜率和截距可以得到EGCG与SPI间的表观结合常数Ks和结合位点数n,结果见表1。从表1可以看出,EGCG与SPI间的表观结合常数Ks数量级为104,这说明EGCG与SPI间存在着较强的互作关系,发生了紧密的结合,结合位点数平均大于1,也就是说明二者形成了结合位点数为1的复合物。

表1 SPI-EGCG复合体系的荧光猝灭常数、结合位点数及表观结合常数Table 1Fluorescence quenching constant, number of binding sites and apparent binding constant of SPI-EGCG complexes
蛋白与小分子物质之间主要通过疏水相互作用、静电作用、氢键及范德华力4 种作用相结合[23]。通过Van’t Hoff方程(式(4)~(6))的计算,可以求得3 个热力学参数值,分别为焓变ΔH、熵变ΔS和Gibbs自由能变ΔG。蛋白质与小分子之间的作用力可以通过ΔH与ΔS的正负判断。通常情况下,如果温度相差不大,ΔH可视作常数[24]。
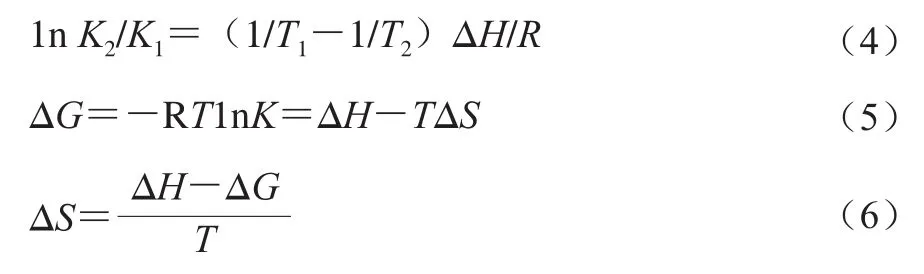
式中:K为结合常数;T为温度/K;R为气体常数,取值为0.008 314 kJ/(mol·K)。
物质之间的作用力类型可以通过热力学参数的正负和大小判断:当ΔS>0时,可能为疏水及静电作用力;当ΔS<0时,可能为氢键和范德华力;当ΔH>0且ΔS>0时,即为典型疏水作用力;ΔH<0且ΔS<0时,为氢键和范德华力;ΔH≈0或很小且ΔS>0时,为静电作用力;ΔH<0时,静电作用为主要作用力[25]。
由表2可知,EGCG与SPI复合体系ΔG值均小于0,这说明EGCG与SPI之间属于一个自由能降低的自发过程,∆H>0与∆S>0表明EGCG与SPI之间的作用力类型为疏水作用力。
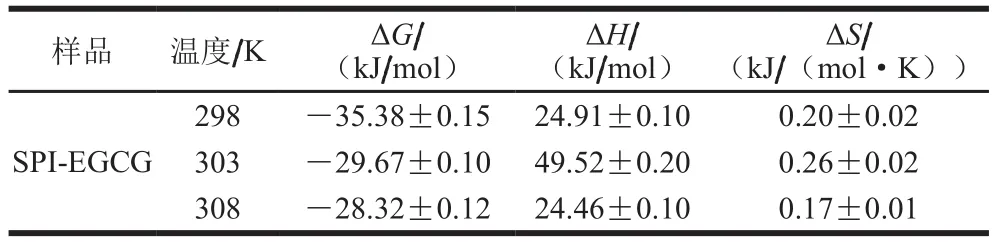
表2 热力学参数值Table 2Thermodynamic parameters
2.2 SPI-EGCG复合体系结合度分析
SPI与EGCG复合后通过透析可以得到没有与SPI发生相互作用的游离EGCG,通过对游离EGCG含量测定,计算SPI与EGCG的结合率。由图2可知,室温下SPI与EGCG的复合物(pH 7.4、2 h、EGCG质量浓度为0、0.05、0.1、0.15 mg/mL)的结合率分别为(63.74±0.50)%、(69.58±0.55)%、(75.86±0.60)%,说明SPI与EGCG的结合率随EGCG质量浓度的增大而升高。复合体系热处理后结合率增加,且随着EGCG质量浓度的增大而升高。这是由于热处理使SPI的空间结构展开,更多的疏水基团暴露出来,使SPI与更多EGCG通过疏水相互作用结合,提高结合率。该趋势与Rodríguez等[17]研究乳清蛋白与多酚相互作用的结果吻合。
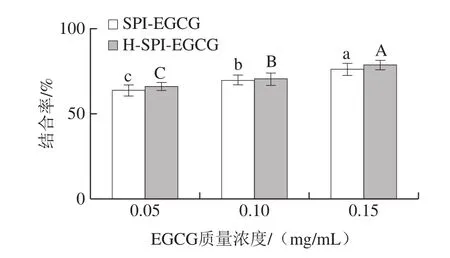
图2 EGCG与SPI结合度Fig.2 Analysis of the binding degree between EGCG and SPI
2.3 SPI-EGCG复合体系的红外光谱分析
傅里叶变换红外光谱与拉曼光谱是2 种探究蛋白二级结构技术,二者之间具有互补性(图3)。对复合体系中SPI的酰胺I带做二阶导数,通过计算得到复合体系SPI二级结构的定量信息。
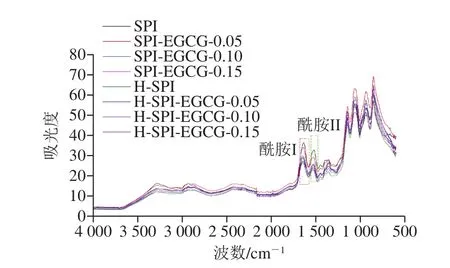
图3 热处理前后EGCG-SPI复合体系的傅里叶变换红外光谱图Fig.3 Fourier transform infrared spectra of EGCG-SPI complexes before and after heat treatment
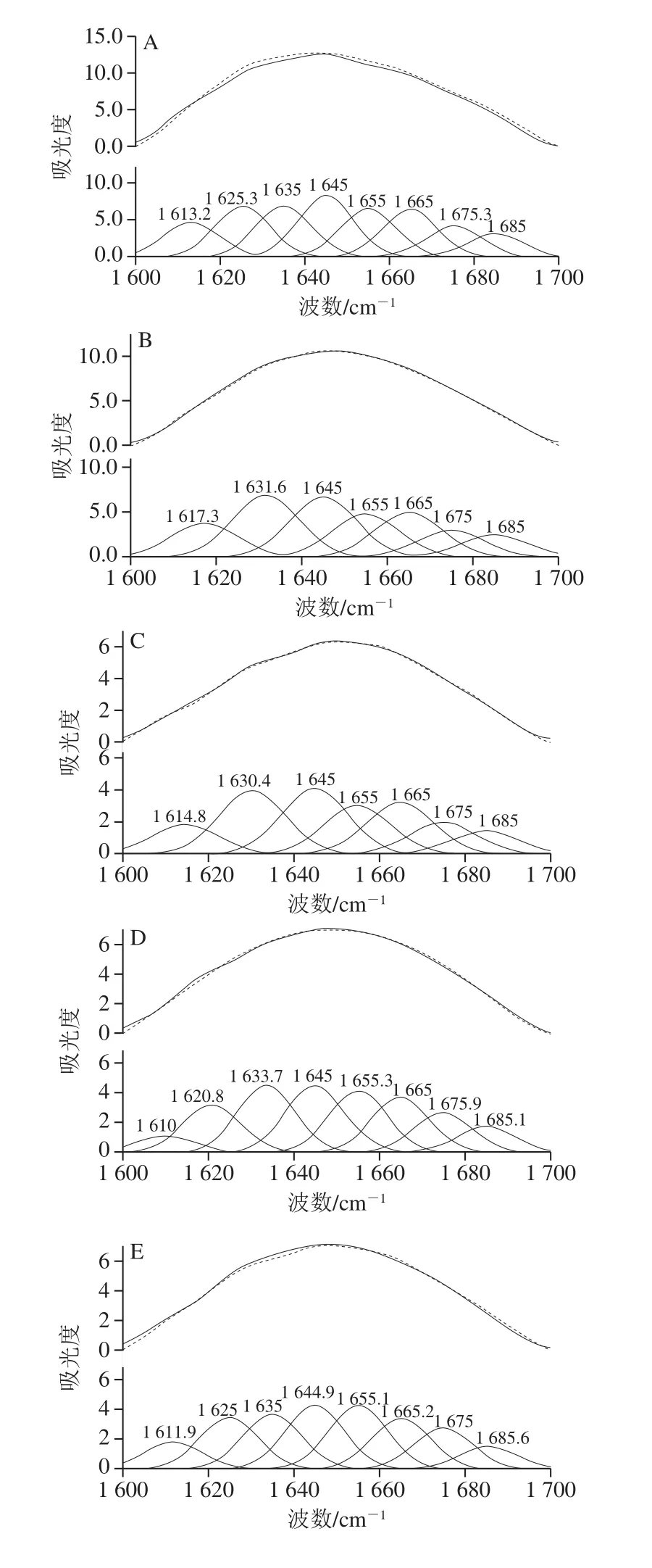
由图4、表3可知,SPI-EGCG复合体系的酰胺I带的吸收峰强度低于纯SPI,同时复合物中SPI的酰胺I带从纯SPI的1 635.48 cm-1红移至1 645.82 cm-1左右。SPI-EGCG复合物中SPI的酰胺I带在1 600~1 700 cm-1处发生了峰位的改变,说明EGCG与SPI的复合会使SPI的二级结构产生不同程度的改变[26]。室温下,随EGCG质量浓度的增大,β-折叠相对含量随之减小,α-螺旋相对含量随之增大。Kanakis等[27]认为多酚对蛋白结构的影响主要是由于α-螺旋、β-折叠、β-转角、无规卷曲4 种结构含量之间转换导致的。EGCG的加入使SPI结构中的β-折叠结构向α-螺旋结构转换,增加蛋白质结构的稳定性。复合体系热处理后,β-折叠相对含量较热处理前降低,而α-螺旋相对含量增加,β-转角与无规卷曲的相对含量变化较小,这与李杨等[28]的研究结果一致。EGCG与SPI复合时,主要作用于β-折叠中的氢键,从而使β-折叠结构的含量降低,进而转换成在稳定性高的α-螺旋结构。
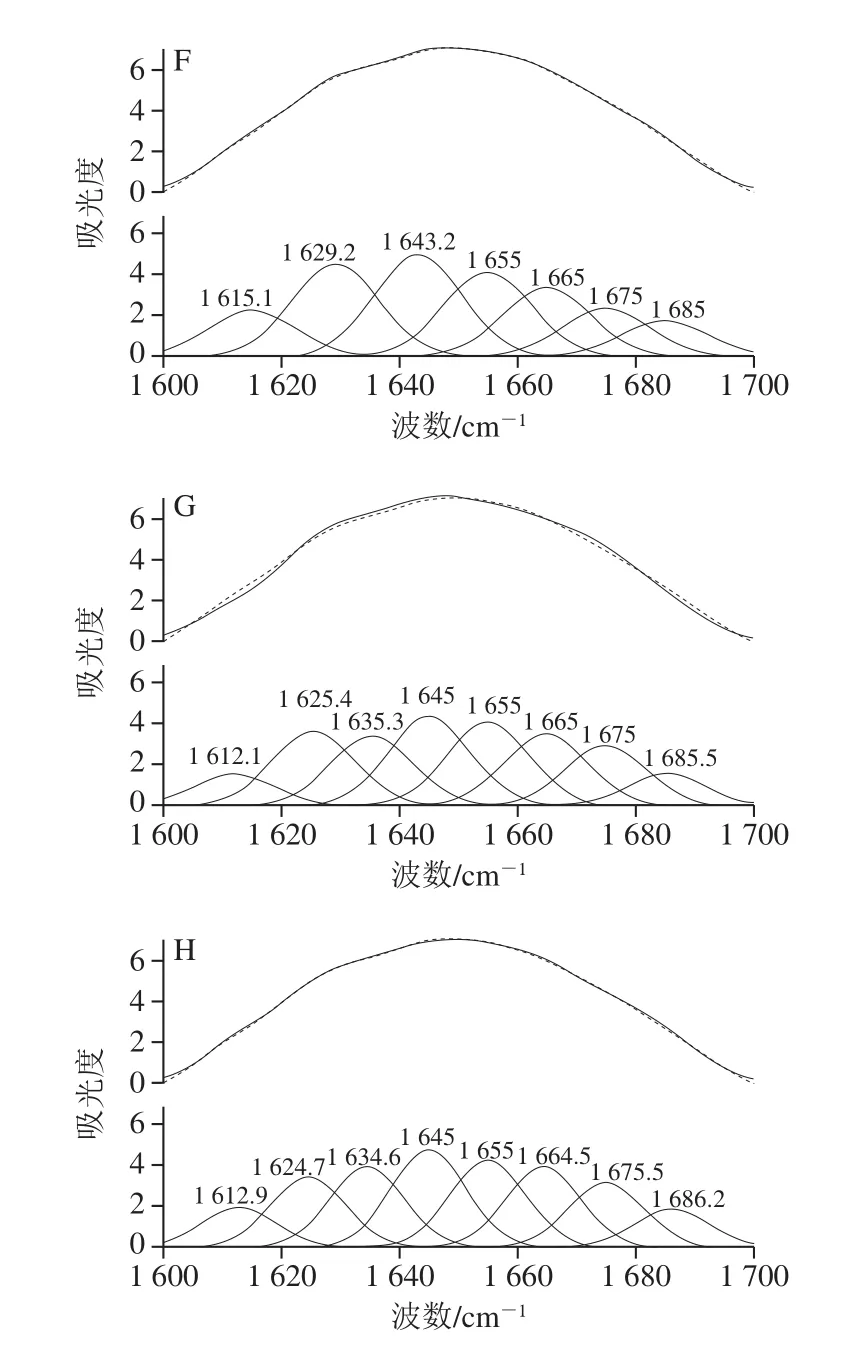
图4 SPI红外酰胺I带的拟合图谱Fig.4 Fitting curves of infrared amide I band in SPI
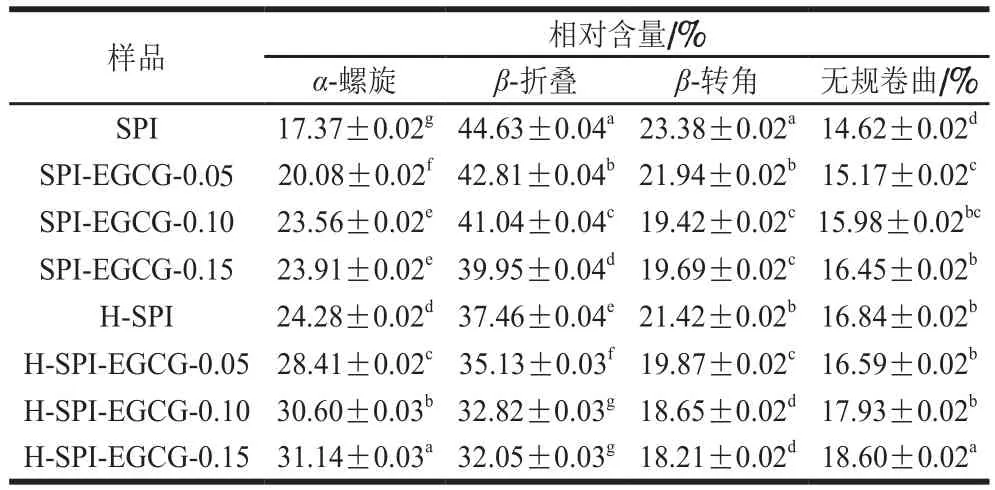
表3 热处理前后SPI-EGCG复合体系中SPI的二级结构含量Table 3Secondary structure content of SPI in SPI-EGCG complexes before and after heat treatment
2.4 SPI-EGCG复合体系的拉曼光谱分析
2.4.1 SPI主链结构特征拉曼光谱分析
SPI的构象主要由酰胺I带的拉曼特征峰确定,本实验中运用Raman Spectral Analysis Package Version 2.1软件对SPI的拉曼图谱二级结构进行定量计算。
蛋白质的主链结构常用酰胺I带及酰胺III表征,如图5所示,1 660~1 670 cm-1处的谱带表明SPI二级结构中主要的组分为α-螺旋和无规卷曲结构。
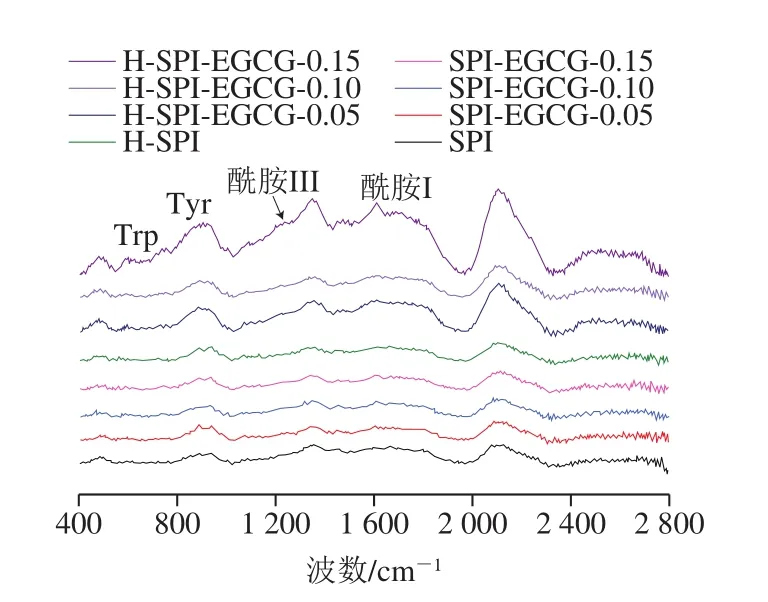
图5 热处理前后SPI-EGCG复合体系拉曼光谱图Fig.5 Raman spectra of SPI-EGCG complexes before andafter heat treatment
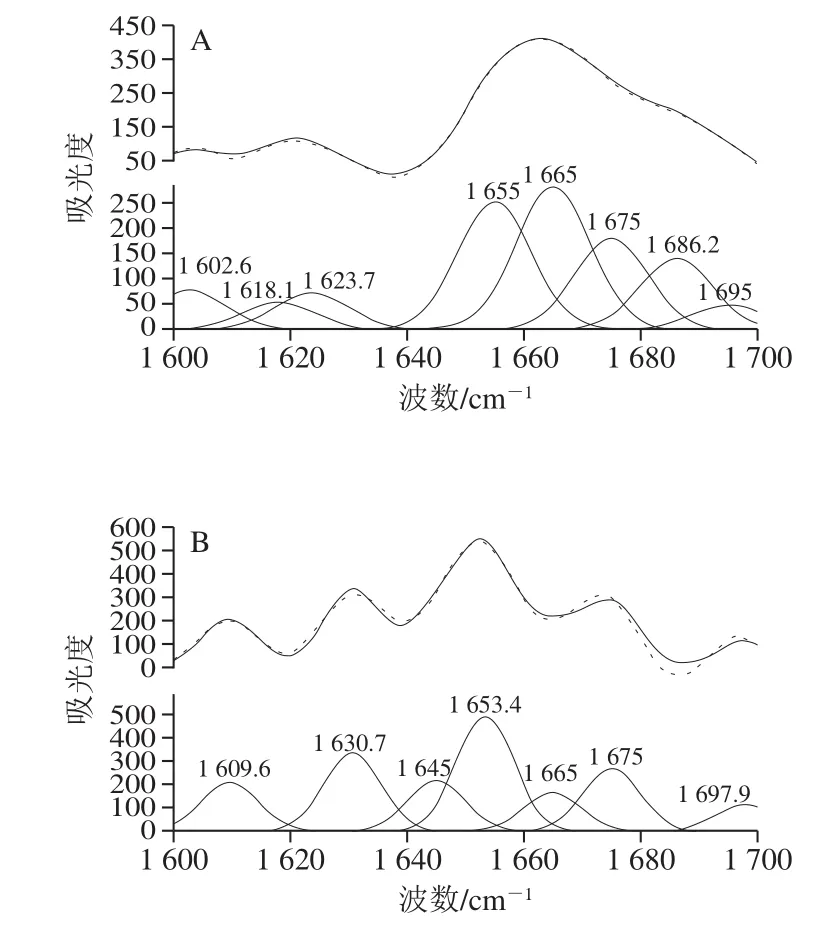
由图6、表4可知,不同质量浓度的EGCG与SPI相互作用后,SPI的二级结构均发生了改变。室温下,随着EGCG质量浓度的增大,SPI结构中β-折叠与β-转角相对含量的随之减小,α-螺旋与无规卷曲的相对含量随之增大,但β-折叠与无规卷曲相对含量的变化较小。说明更多的β-折叠转化成了较稳定的α-螺旋结构。这与红外光谱所得结论一致。而Bhattacharjee等[29]的研究表明β-乳球蛋白在90 ℃热处理后大量的二级结构保持完整。从表4比较得知,热处理对于SPI-EGCG复合物中SPI的二级结构改变显著,β-折叠相对含量大幅度降低,同时α-螺旋相对含量大幅升高。这可能是由于β-折叠中用于稳定结构的C=O与H栖合成的氢键被EGCG破坏,所以β-折叠相对含量降低。通过对拉曼光谱的分析,发现所得结论与红外光谱分析结果基本一致,EGCG的添加改变SPI的二级结构,结构的变化主要体现在β-折叠向α-螺旋的转变。
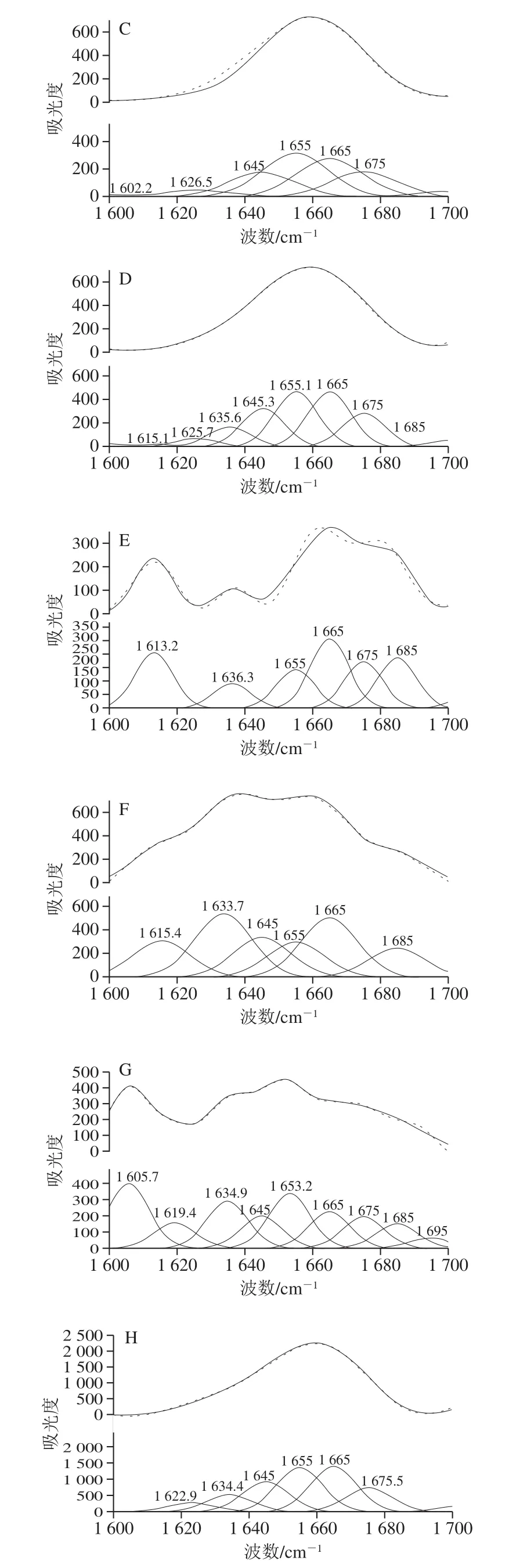
图6 SPI拉曼酰胺I带的拟合图谱Fig.6 Fitting curves of Raman amide I band in soybean protein
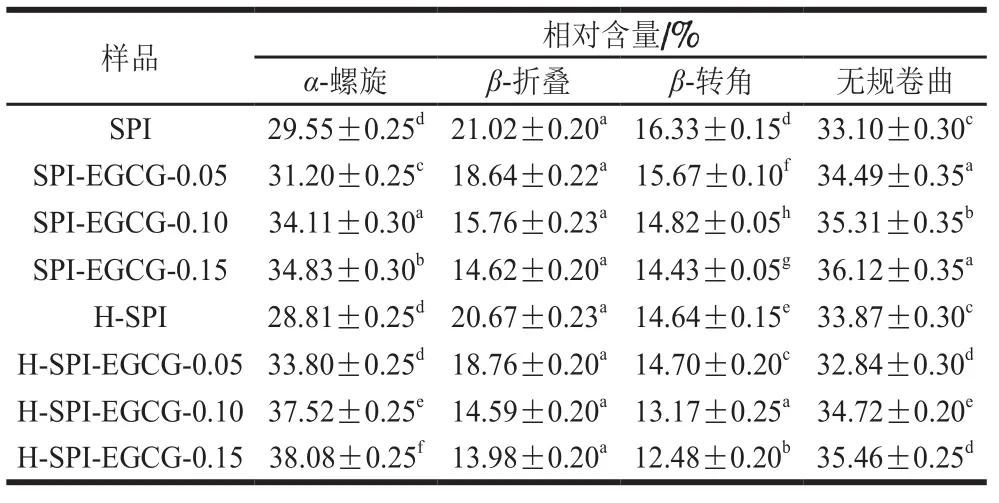
表4 拉曼光谱测定热处理前后SPI-EGCG复合体系中SPI的二级结构含量Table 4Secondary structure content of SPI in SPI-EGCG complexes before and after heat treatment determined by Raman spectroscopy
2.4.2 SPI侧链结构特征拉曼光谱分析
色氨酸在拉曼谱图上表现出的拉曼谱用于表示蛋白质微环境极性变化规律。Lichan等[30]的研究表明色氨酸残基从原本“包埋式”转变为“暴露式”会导致在760 cm-1附近区域的拉曼峰强降低。如表5所示,随着EGCG质量浓度的增加,色氨酸谱带强度的降低,表明EGCG使色氨酸残基向“暴露式”方向转变,导致EGCG与更多疏水性残基发生疏水相互作用而结合。复合体系热处理后,拉曼图谱中色氨酸谱带强度的降低,说明蛋白质受热后更多的色氨酸暴露出来。已有研究表明:蛋白质的结构受热会发生改变,使色氨酸残基的暴露出来,所以色氨酸谱带强度在拉曼谱图中呈先降低的趋势[31]。
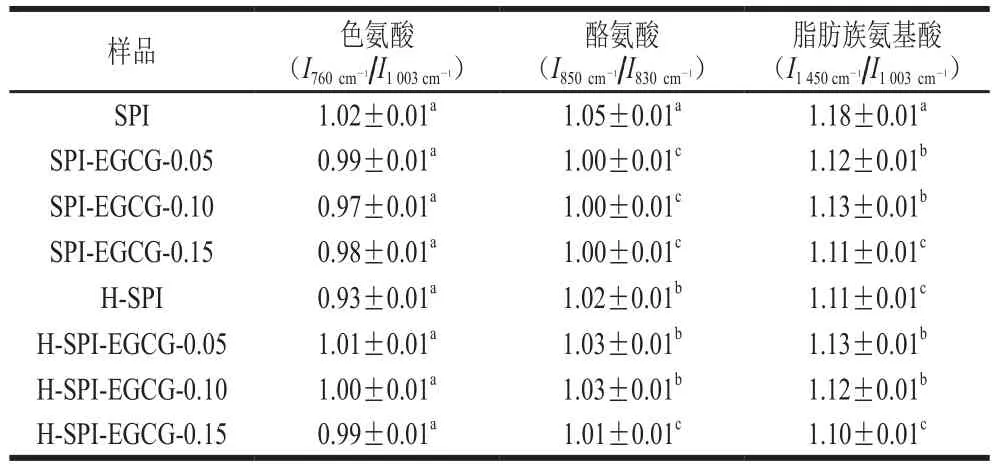
表5 热处理前后EGCG-SPI复合体系中SPI的侧链基团谱带强度Table 5Side chain group intensity of SPI in EGCG-SPI complexes before and after heat treatment
850 cm-1与 830 cm-1两条谱线是酪氨酸残基苯环的呼吸振动和面外弯曲倍频之间的费米共振[32],通过对比2 条谱线的强度,可以推测出酪氨酸是氢键的供体或是受体。当850 cm-1的光谱强度比830 cm-1附近高时,酪氨酸残基趋向于暴露;另一方面,当850 cm-1强度小于830 cm-1时,这说明酪氨酸包埋在蛋白质网状结构中[33]。通过比较可知,SPI与EGCG的复合,以及热处理对于SPI的处理,都使酪氨酸残基趋向于“暴露态”,同时SPI与EGCG的复合导致酪氨酸拉曼归属峰强度降低,这也在一定程度上说明SPI与EGCG的互作位点是蛋白质的疏水侧链基团。
脂肪族氨基酸的拉曼归属谱线为1 450 cm-1,Mcclements等[34]发现脂肪族氨基酸暴露会导致其拉曼归属峰强度降低。本实验结果发现,热处理与EGCG的添加均会导致大豆蛋白在1 450 cm-1处的拉曼归属峰显著降低,说明脂肪族氨基酸向“暴露态”方向转变,这与大豆蛋白结构的转变有关。
2.4.3 SPI二硫键构型的拉曼光谱分析
维持蛋白质三级结构的主要作用力是二硫键,其特征谱带的范围为500~550 cm-1。二硫键在不同振动模式下反映出的拉曼位移有所不同,如500~510 cm-1处为gauche-gauche-gauche模式,515~525 cm-1为gauchegauche-trans模式,535~545 cm-1为trans-gauche-trans模式[35]。结合表6可以看出,SPI二硫键的主要构型为g-g-g模式。随着EGCG的加入,大豆蛋白二硫键构型发生显著变化,由g-g-g模式转化为g-g-t和t-g-t模式。而热处理后大豆蛋白的二硫键构型主要向t-g-t振动模式转换。这主要因为t-g-t代表分子间的二硫键的振动模式,热处理加强了分子间的交互作用,而EGCG的加入导致分子内的振动模式g-g-g增加,分子内二硫键含量增多,分子间的二硫键减少,说明EGCG与SPI形成稳定的复合物。
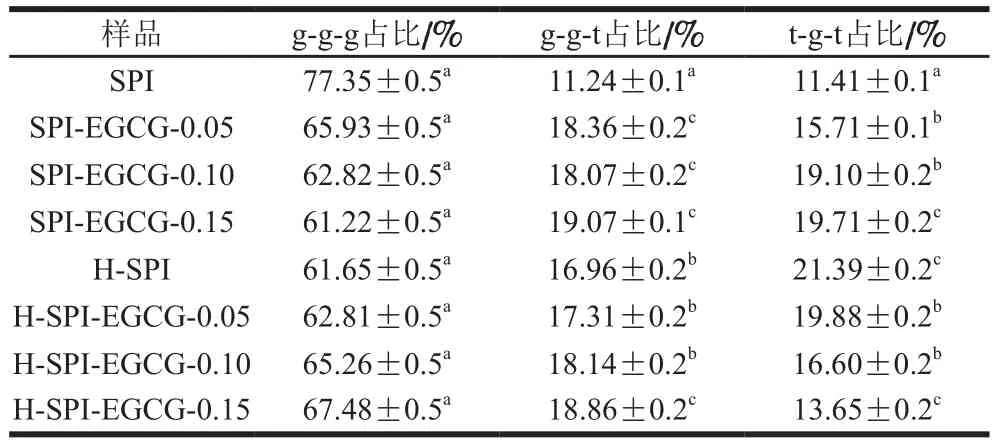
表6 热处理前后EGCG-SPI复合体系中S PI的二硫键构型Table 6Disulfide bond configuration composition of SPI in EGCG-SPI complexes before and after heat treatment
2.5 SPI-EGCG复合体系荧光光谱分析
由图7可知,室温下EGCG与SPI的相互作用对SPI的荧光有猝灭作用,并且猝灭效果随着EGCG质量浓度的增大而增强。同时SPI的最大荧光发射波长发生了一定的红移,从纯蛋白的335 nm红移到355 nm,这说明EGCG与SPI发生相互作用,从而使SPI的结构发生了改变,使色氨酸与酪氨酸所处环境由疏水变成了亲水,进而使肽链的结构变得舒展[36-37]。复合体系经热处理后,SPI的最大荧光强度较未处理下的SPI增加,同时最大发射波长发生了轻微的红移,表明热处理使更多的色氨酸暴露出来同时所处环境转移到了更亲水或极性微环境中,这是由于SPI在热处理下空间结构发生了改变[38-39]。同时EGCG对SPI的猝灭作用大于热处理前,且SPI的最大荧光发射波长发生了一定的红移。这是由于热处理使SPI发生了变性结构展开,使更多的色氨酸残基被EGCG猝灭[40]。热处理前后不同浓度EGCG对SPI结构的调控具有相同的效果,且热处理后效果更明显,说明热处理及多酚浓度是影响小分子对蛋白结构调控的2 个主要因素。
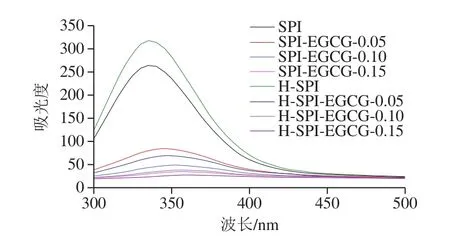
图7 热处理前后EGCG-SPI复合体系的荧光光谱分析图Fig.7 Fluorescence spectra of EGCG-SPI complexes before and after heat treatment
2.6 SPI-EGCG复合体系紫外-可见光谱分析
由图8可知,室温下随着EGCG质量浓度的增加,复合体系的紫外-可见光吸收光谱的最大吸收峰发生了不同程度的红移,说明EGCG与SPI的相互作用导致SPI的空间构象发生了改变。薛春霞等[20]的研究表明多酚类物质进入蛋白质分子的疏水氨基酸残基中并通过疏水相互作用结合在一起形成了疏水腔,从而导致吸收峰红移动现象的发生。复合体系热处理后,SPI的紫外吸收峰发生红移,同时不同质量浓度EGCG均导致复合体系的吸收峰发生了红移,且红移程度高于室温下的样品。这是由于加热使蛋白的疏水基团暴露出来同时使具有紫外吸收能力的酪氨酸残基暴露至SPI分子表面,所以SPI的吸收峰发生了红移,这与Natasa等[41]的结果一致。
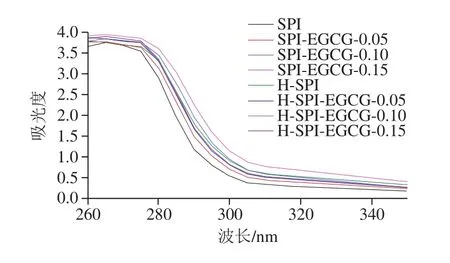
图8 热处理前后EGCG-SPI复合体系的紫外光谱图Fig.8 Ultraviolet spectra of EGCG-SPI complexes before and after heat treatment
3 结 论
以实验室自制的SPI与EGCG作为研究的原料,制备SPI-EGCG复合体系,二者的猝灭方式为静态猝灭,且作用力为疏水相互作用。通过红外光谱和拉曼光谱的分析,EGCG对SPI的调控使SPI二级结构产生不同程度的改变。热处理前后,SPI二级结构均出现随EGCG质量浓度的增大β-折叠相对含量随之减小,α-螺旋相对含量与随之增大的现象。并且拉曼光谱侧链显示EGCG与SPI的疏水侧链基团通过疏水相互作用结合,且热处理使二者之间的相互作用增强。荧光光谱和紫外-可见光光谱表明:热处理前后EGCG对SPI结构的调控均对SPI的荧光有猝灭作用,且热处理后的猝灭效果更强。
