辛烯基琥珀酸脱支淀粉-不同构型风味物质包合物的制备及结构表征
2021-07-08胡中山曾小兰宋诗清姚凌云徐志民
冯 涛,胡中山,曾小兰,张 钰*,宋诗清,姚凌云,孙 敏,徐志民
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.上海应用技术大学技术转移中心,上海 200235;3.路易斯安那州立大学营养与食品科学学院,美国 路易斯安那 巴吞鲁日 LA 70803)
食品风味物质种类繁多,含量少、稳定性差,难溶于水,分子结构具有高度特异性。风味物质根据结构一般可分为3 种,包括线性风味物质、环状风味物质和立体状风味物质。在实际生产过程中,经常会因风味物质的不稳定而降低了芳香化合物的强度或产生异味成分等导致食品整体风味的改变[1]。为有效地解决这些问题,可将风味物质以分子包合提高食品的可口性和风味稳定性[2-5]。
脱支淀粉(debranched starch,DBS)是一种经过酶促改性的低聚合度的亲水性线性多糖[6]。DBS被广泛认为是一种潜在的载有活性成分[7]、药物[8]的包埋壁材[9]和α-淀粉酶抑制剂[10]以及水凝胶增强材料[11-12]。但是DBS对风味物质的包埋率不高。为了提高淀粉基类壁材的包埋能力,需对淀粉进行改性。由蜡质玉米原淀粉通过普鲁兰酶水解生成DBS[13],再与食品级的辛烯基琥珀酸(octenyl succinic acid,OSA)发生酯化反应,得到能与一系列具有疏水性基团的化合物形成络合物OSADBS[14]。利用OSA-DBS内部疏水外部亲水的特性包埋难溶于水的不同构型的风味物质。Chang Ranran等[15]研制出一种新型的用于装载和运输活性成分的OSA-DBS,在食品和生物医药行业具有潜在的应用价值。Cheuk等[16]利用OSA-DBS包埋辅酶Q10以提高其生物活性并实现靶向释放。Kreuter[17]和Singh等[18]利用OSA-DBS包埋药物,很大程度上增加了其生物利用率。将蜡质玉米原淀粉通过采用普鲁兰酶水解多糖中的α-1,6-糖苷键之后得到DBS,此法高效、环保且简单[19]。
为了探究OSA-DBS包埋不同构型的风味物质的包合性质,本实验先利用OSA将DBS改性,制备成具有双亲性的壁材,后对食品工业领域常用的3 类不同构型的风味物质进行包埋,以期为OSA-DBS包埋其他风味物质提供一定参考依据,扩大OSA-DBS在食品中的应用。
1 材料与方法
1.1 材料与试剂
蜡质玉米淀粉 宜瑞安中国有限公司。
辛烯基琥珀酸酐(分析纯) 东京化成工业株式会社;普鲁兰酶(1 000 ASPU/g,分析纯) 上海源叶生物科技有限公司;正己醛、正庚醛、正辛醛、γ-己内酯、γ-庚内酯、γ-辛内酯、2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪、氢氧化钠、磷酸二氢钠(均为分析纯) 上海阿拉丁试剂有限公司;一水合柠檬酸、磷酸氢二钠、磷酸二氢钾、盐酸、无水乙醇(均为分析纯) 国药集团(上海)试剂有限公司。
1.2 仪器与设备
FD-2冷冻干燥机 上海比朗仪器制造有限公司;Q5000 IR热重分析仪 美国沃特斯公司;VERTEX70傅里叶变换红外光谱仪 德国Bruker公司;Zetasizer Nano ZS激光粒度分布仪 马尔文仪器(中国)有限公司;S-3400N扫描电子显微镜 日本高新那珂事业所;6890气相色谱仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 OSA-DBS的制备
利用蜡质玉米淀粉通过普鲁兰酶水解成DBS,后与辛烯基琥珀酸酐发生酯化反应生成OSA-DBS,其中部分实验操作参考Sun Qingjie[20]和Liu Zhiqiang[21]等方法。
1.3.1.1 DBS的制备
采用分析天平准确称取60 g烘干的蜡质玉米淀粉,边溶解边搅拌加入到预先制备好的400 mL Na2HPO4-一水合柠檬酸缓冲溶液中,持续搅拌并加热至98 ℃,保持40 min使淀粉糊化并呈现出透明的状态,随后降温至50 ℃后缓慢滴加0.9 g酶活力为1 000 U/g的普鲁兰酶,保持反应状态8 h后,快速离心(1 000 r/min、2 min),去除底部沉淀(未被完全水解的淀粉和杂质),收集上清液,然后水浴加热至90 ℃高温灭酶活30 min以终止反应,将溶液倒平板,先预冷冻再冷冻干燥得DBS粉末。
1.3.1.2 OSA-DBS的制备
取DBS 10 g溶解在200 mL蒸馏水中,加入搅拌子于120 ℃的油浴锅中加热40 min澄清透明后转移至56 ℃的水浴锅中,用5% NaOH溶液调节pH 8.0~9.0,将2.5 g OSA提前分散在2~5 mL无水乙醇中,然后在1.5 h内缓慢滴加到DBS溶液中。由于酯化反应时刻都在发生,所以需要每隔2~5 min滴加适量的NaOH溶液以保证反应在最佳pH值环境范围内进行。反应时间7 h,之后利用5% HCl溶液调节pH 6.5以终止反应。再加入DBS溶液3~5 倍体积的无水乙醇(>99.7%)溶液先醇沉,后水洗,再冷冻干燥得OSA-DBS粉末。
1.3.1.3 OSA-DBS微米粒子的制备
部分参考Payyappilly等[22]的关于制备辛烯基琥珀酸淀粉酯微米颗粒的实验。配制浓度为0.1 mol/L的KH2PO4溶液和Na2HPO4溶液,后称取20 g OSA-DBS粉末溶解在2 L缓冲溶液中,配制成质量浓度为10 mg/mL的复合物溶液,于35 ℃的水浴锅中缓慢搅拌7 h,反应结束后加入3~5 倍体积的无水乙醇醇沉,经水洗、冷冻干燥得微米粒子。
1.3.2 OSA-DBS-不同构型风味物质包合物和混合物的制备
准确称取10 mg三类不同构型的风味物质(线性:正己醛、正庚醛、正辛醛;环状:γ-己内酯、γ-庚内酯、γ-辛内酯;立体状:2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪),分别分散在2 mL无水乙醇中,配制成5 mg/mL的风味物质乙醇溶液。称取OSA-DBS 1 g,分散在蒸馏水中,配制成10 mg/mL的OSA-DBS溶液,将风味物质向OSA-DBS溶液中缓慢滴加后,置于30 ℃的恒温水浴锅中,搅拌7 h,后倒平板冷冻干燥72 h,得到不同构型风味物质包合物。其中,OSA-DBS-不同构型风味物质混合物的制备除搅拌时间为0.5 h,其他操作过程与包合物的制备相同。
1.3.3 包埋率和载药量的测定
1.3.3.1 包埋率的测定
采用气相色谱法测定。氢火焰检测器,HP-INNOWAX色谱柱(60 m×0.32 mm,0.25 μm);载气为高纯氮,载气流速2 mL/min;进样口和检测器温度分别为160、200 ℃,分流比设定为30∶1。升温程序:90 ℃保持1 min后以10 ℃/min的速率升温至110 ℃并保持5 min,再以20 ℃/min升温至130 ℃并维持15 min,最后以20 ℃/min升温至160 ℃并维持5 min;进样量为5 μL。
1.3.3.2 标准曲线方程的建立
分别称量1 g不同构型风味物质包合物溶解于200 mL的无水乙醇中以制备母液,搅拌使其均匀分散,转入容量瓶中定容,得到1 000 μg/mL的风味物质包合物无水乙醇溶液。分散均匀后用移液枪吸取1 mL母液于10 mL容量瓶中无水乙醇定容,依次取其母液配制不同质量浓度梯度的不同构型风味物质无水乙醇溶液,即50、20、10、5、1 μg/mL的风味物质标准溶液。每次吸取5 μL,质量浓度为横坐标、峰面积为纵坐标绘制风味物质标准曲线。
1.3.3.3 包合物中游离的风味物质总量
称量0.01 g OSA-DBS-风味物质包合物配制成1 mg/mL的包合物无水乙醇溶液。超声10 min后静置,后取上清液测定其风味物质的峰面积,计算对应包合物中游离的风味物质含量。
1.3.3.4 包合物中风味物质总量
称量0.01 g不同风味物质包合物微米颗粒配制成1 mg/mL的溶液。搅拌后高速离心(15 000 r/min、20 min)使包合物微米颗粒完全破坏,此时,包合物中风味物质完全释放。离心取上清液,测定出微胶囊的风味物质峰面积,通过计算得到微胶囊风味物质总量。
1.3.3.5 包埋率和载药量计算

1.3.4 OSA-DBS-不同构型风味物质包合物的表征
1.3.4.1 不同构型风味物质包合物平均粒径、多分散系数(polydispersity indices,PDI)和Zeta电位的测定
通过Zetasizer Nano ZS型激光粒度分布仪进行测定。测定前,先将样品配制成均匀分散的体系,所有样品需过0.45 μm的微孔滤膜,以便除去掉大颗粒的聚集体。将样品溶液于室温条件下测定纳米乳液的Zeta电位。样品设置测定3 次取其平均值[13]。
1.3.4.2 傅里叶变换红外光谱测定
测定波数范围为4 000~500 cm-1,分辨率为2 cm-1,检测器为DLATGS。
1.3.4.3 热重分析
以高温质量损失反映风味物质包埋效果。每次装样之前用乙醇将样品盘灼烧5 s以除去盘中的杂质,然后放进仪器进行矫正之后,再称取3~5 mg的样品于坩埚中,置于热重分析仪系统。设置程序氮气流量20 mL/min,升温速率10 ℃/min,样品升温范围30~500 ℃。
1.3.4.4 扫描电子显微镜观察
向0.1 mg样品中加入10 mL超纯水,超声处理10 min均与分散后,取烧杯中间处的1 滴样品于贴有导电胶的样品台上,将样品进行喷金处理,然后在电流3 mA、加速电压15 kV条件下调节到最适宜的倍数观察微观形貌。
1.4 统计分析
2 结果与分析
2.1 包合物包埋参数及粒径的测定结果
由表1可知,OSA-DBS作为壁材包埋不同构型的风味物质的包埋率和载药量均很高,其中立体状风味物质最高,并且OSA-DBS-2,3,5,6-四甲基吡嗪的包埋率78.50%和载药量21.41%在所有包合物中均达到最大。在同一构型中,风味物质包合物的包埋率和载药量随着碳原子数呈现上升趋势;在不同构型中,风味物质包合物的包埋率和载药量大小关系为:立体状风味物质>环状风味物质>线性风味物质。Brisson等[23]发现正己醛被包埋进了一个每圈有6 个脱水葡萄糖单元螺旋。Bail等[24]研究证明2,5-二甲基吡嗪和OSA-DBS包合晶型特征属于V8型。Conde-Petit等[25]在食品模型中研究淀粉包埋风味物质的结构特性时发现,立体状构型的风味物质容易被包埋进淀粉的螺旋结构中。
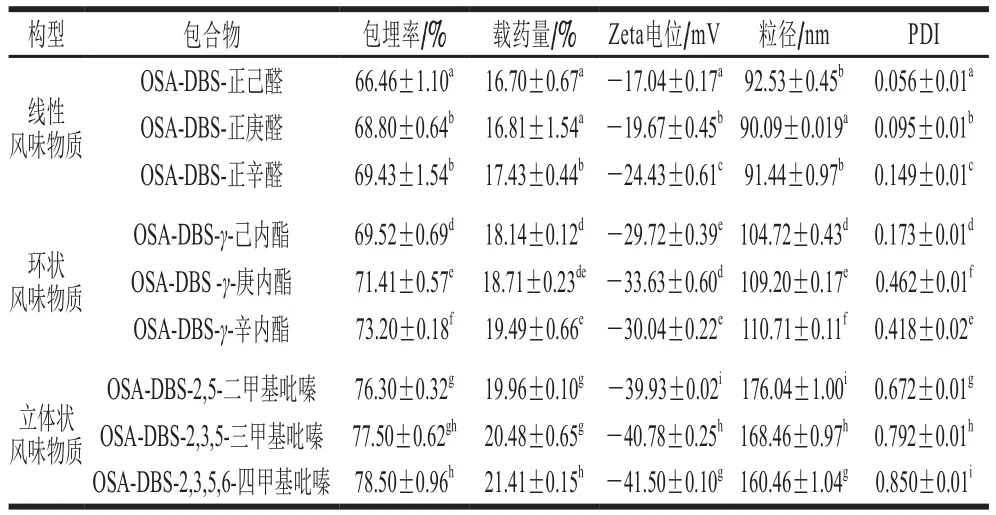
表1 风味物质包合物的包埋率和载药量Table 1Encapsulation rates and drug-loading amounts of inclusion complexes
Zeta电位是反映不同构型风味物质稳定性的重要指标,通常螺旋体系附近由于抗衡离子的屏蔽作用使得离子浓度降低,进而Zeta电位值偏低。一般情况下,30<|Zeta电位|≤40时,包埋体系表现出较好的稳定性;20<|Zeta电位|≤30时,包埋体系稳定性一般;0≤|Zeta电位|≤20时,包埋体系稳定性较差。由此可知,同一构型中,低分子质量(C6)的风味物质稳定性低于高分子质量(C8);不同构型中,立体状风味物质包合物Zeta电位最稳定,不同构型风味物质包合物稳定性从高到低顺序为立体>环状>线性。
纳米粒度仪测得不同构型粒径关系:立体风味物质>环状风味物质>线性风味物质,其中线性风味物质包合物最低为90.09 nm,最高为92.53 nm;环状风味物质包合物最低为104.72 nm,最高为110.71 nm;立体风味物质包合物最低为160.46 nm,最高为176.04 nm。结合Zeta电位发现,风味物质包合物粒径越大,包合体系稳定性相对越高。PDI表示粒径的均一性,其值越小表示包合物小球粒子大小分布集中,均一性越好。表中线性风味物质包合物PDI值偏低,其最低为0.056,说明线性包合物粒径范围窄且分布均一。立体状风味物质包合物偏高,其最高为0.85,表明粒径分布范围宽,大颗粒突出。造成这种现象的原因可能是与包合物所形成的空间结构有关,即线性包合物的空间结构比较小,而且相互之间的差异较小,而立体状包合物的空间结构大,相互之间的差异较大。综上,立体状风味物质包合物的包埋率和载药量更高,且包合物体系更加稳定,更适合利用OSADBS包埋并在实际中应用。
2.2 傅里叶红外光谱分析
由图1a可知,3 种线性醛类风味物质光谱中,3 390 cm-1和2 934 cm-1的峰值分别是O—H和C—H的伸缩振动。1 020 cm-1和1 160 cm-1两处是由C—O引起,1 180 cm-1处的风味物质C—O—C的伸缩振动峰[26]。在风味物质混合物中,这几处的特征吸收峰依然存在,红外吸收光谱表现出风味物质和壁材的叠加。除位于1 180 cm-1处的C—O—C伸缩振动峰外,大多数风味物质的吸收峰都被覆盖。除了位于1 020 cm-1的C—O伸缩外,3 种线性风味物质的红外光谱基本相同。在风味物质包合物中,3 种线性风味物质的特征峰消失,以此说明3 种线性风味物质都被包埋进OSA-DBS螺旋结构中,风味物质的特征峰才出现了屏蔽,说明包合物的形成的红外光谱基本相同,除了位于1 020 cm-1的C—O伸缩。Cheng Weiwei等[27]利用淀粉包埋磷脂酰胆碱的包埋实验中也得出了同样的结论。
在图1b中,风味物质分别在1 795 cm-1和1 360 cm-1处由于C=O和C—O—C而出现伸缩振动峰,同时在3 010 cm-1和2 950 cm-1处有O—H和C—H引起的伸缩振动峰,且相对于线性结构的风味物质,由于环状风味物质含有—COOR导致风味物质红外图谱出现了一定的蓝移。同样,在环状风味物质混合物中,由于壁材对风味物质的覆盖作用导致风味物质的吸收峰发生了很大程度上的减弱。包合物中风味物质的特征峰消失,可知风味物质成功包埋进了螺旋构型中。
图1c立体状风味物质红外图谱中,风味物质包埋物在3 009 cm-1和2 980 cm-1处有C—H引起的伸缩振动峰,且在1 508 cm-1处出现吡嗪环的吸收振动峰。在风味物质混合物中,这3 处的特征吸收峰依然存在,说明混合物的红外图谱是壁材和风味物质的简单叠加,在风味物质包合物中,风味物质的特征峰消失,表明风味物质被包埋进了OSA-DBS螺旋结构中。
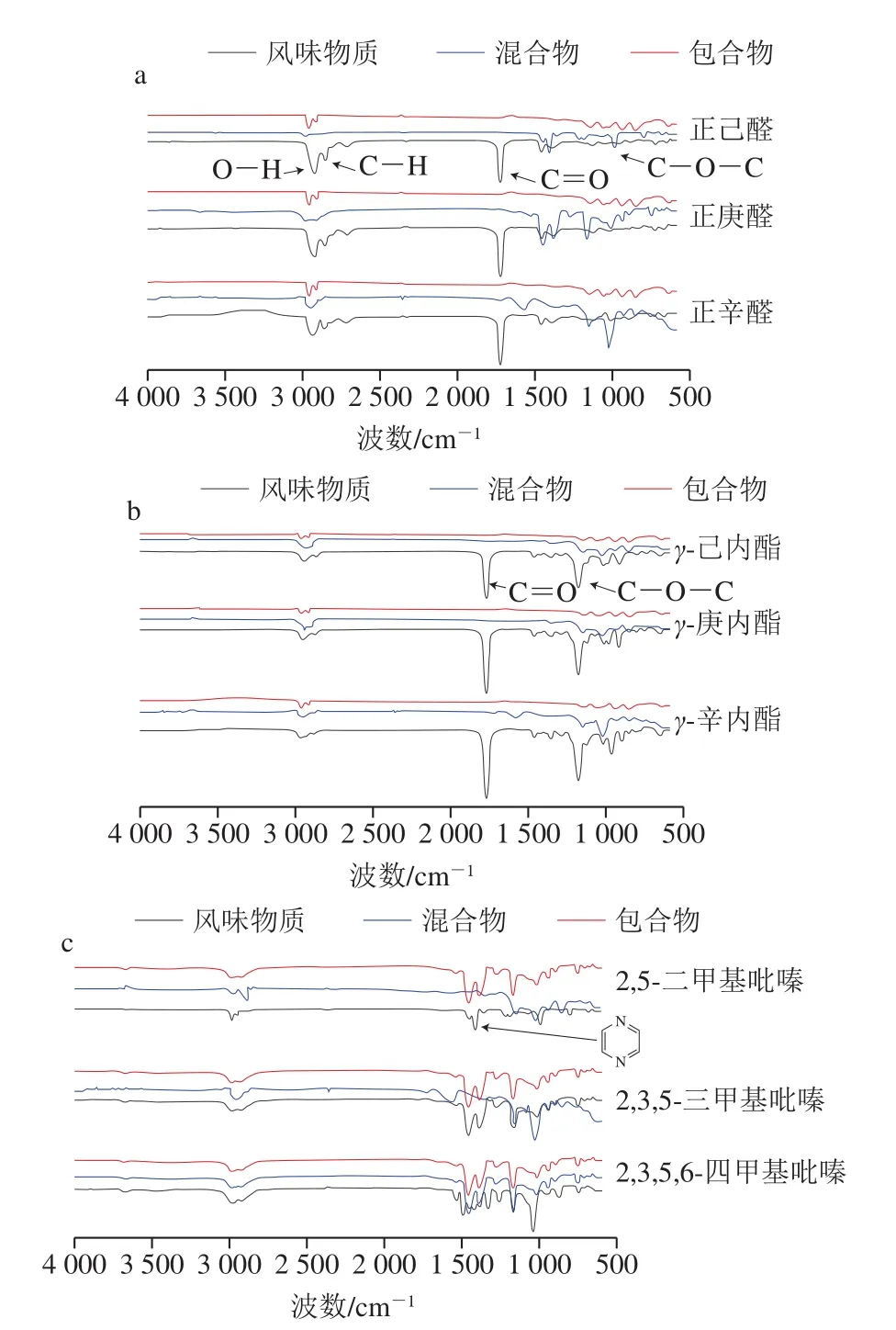
图1 线性(a)、环状(b)、立体状(c)风味物质及其混合物、包合物的傅里叶红外光谱Fig.1 FTIR spectra of linear (a), circular (b) and three-dimensional (c)flavor substances as well as their physical mixtures and inclusion complexes with OSA-DBS
2.3 热重分析
由图2可知,包合物和混合物以及壁材在进行加热的过程中,0~100 ℃加热阶段主要是样品中水分加热蒸发的损失,温度达到200 ℃时才开始出现明显的质量损失,一方面是因为样品的干燥非常彻底,水分含量很低,没有因为水分散失而出现明显变化;另一方面是因为在200 ℃开始,壁材因为高温灼烧开始发生裂解,样品盘总质量出现大幅度的下降。在250~350 ℃过程中,壁材和芯材均会出现严重质量损失,且包合物在这个温度区间质量损失大大下降,可能是因为壁材和芯材都发生了热裂解导致[28]。
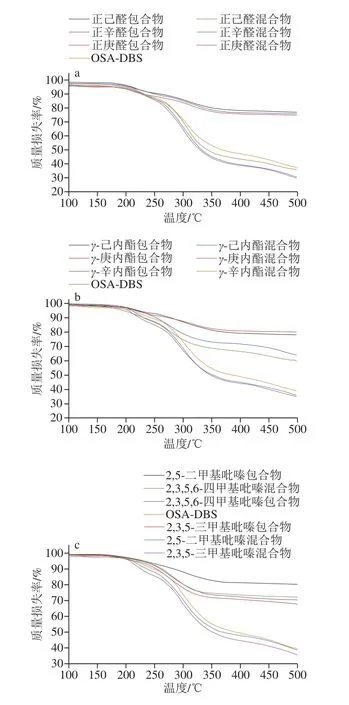
图2 线性(a)、环状(b)、立体状(c)风味物质的混合物和包合物以及OSA-DSB的热重分析Fig.2 TGA curves of linear (a), circular (b), and three-dimensional (c)flavor substances as well as their physical mixtures and inclusion complexes with OSA-DSB
在图2a中,正己醛、正庚醛、正辛醛3 种线性风味物质混合物在200~350 ℃之间发生严重的质量损失,占总质量的61.9%,而包合物在此阶段质量损失温度范围在247~360 ℃,损失质量只占总质量的33%,且损失温度相对于混合物有滞后。包合物相比于混合物,稳定性显著提高,由此说明稳定效果:正己醛>正辛醛>正庚醛。
在图2b中,γ-己内酯、γ-庚内酯、γ-辛内酯3 种环状风味物质包合物主要质量损失出现在250~330 ℃,且质量损失占样品盘上面总质量的20%左右。而3 种风味物质混合物在200~350 ℃之间,混合物的质量损失约为56%。2,3,5,6-四甲基吡嗪包合物的质量损失曲线和其混合物的靠近,说明2,3,5,6-四甲基吡嗪包合物的外壳上有部分风味物质黏连。通过热重实验得出包合作用增加了风味物质的稳定性,且稳定效果:γ-庚内酯>γ-己内酯>γ-辛内酯。
在图2c中,混合物的质量损失有2 个阶段,第1阶段是主要是风味物质的损失发生在207~275 ℃之间,第2阶段主要是淀粉的分解280~350 ℃。2,5-二甲基吡嗪、2,3,5-三甲基吡嗪包合物的质量损失发生在215~350 ℃之间,与其混合物的质量损失阶段207~345 ℃很接近,可能是因为壁材表面附着有风味物质。其中2,5-二甲基吡嗪包合物的质量损失曲线相对于2,3,5-三甲基吡嗪稍有靠后,表明2,5-二甲基吡嗪包合物稳定性更高。从曲线可以得出稳定效果:2,5-二甲基吡嗪>2,3,5-三甲基吡嗪>2,3,5,6-四甲基吡嗪。
3 种同一构型不同碳原子数的风味物质包合物的热重分析曲线走势基本一致,说明了同一构型包合物之间的差别不大,且包埋后的风味物质热稳定性和芯材的热稳定性明显高于混合物。但是,不同构型的风味物质之间,线性结构的风味物质在255 ℃以后发生明显质量损失,环状结构风味物质的质量严重损失是从265 ℃开始的,立体状结构风味物质的明显质量损失是在270 ℃,因此推测3 种构型风味物质包合物热稳定性:立体状风味包合物>环状风味包合物>线性风味包合物。
2.4 扫描电子显微镜观察
从图3可以看出,被包埋的风味物质整体颗粒表面比较光滑,颗粒可能较为完整,大多近似为球形和椭球形。这可能是由于普鲁兰酶催化水解支链淀粉中的α-1,6糖苷键,使支链淀粉转变成疏水的线性短链葡聚糖,经过与亲水的辛烯基琥珀酸酐酯化之后,得到双亲性螺旋结构分子分别包埋线性、环状和立体状的风味物质,使得极性基团和非极性基团在超声作用的条件下形成更加牢固的膜,与风味物质紧紧的包覆在一起。此外,同一构型的风味物质包合物,随着碳原子数增加,形成的包合物颗粒稍微偏大。
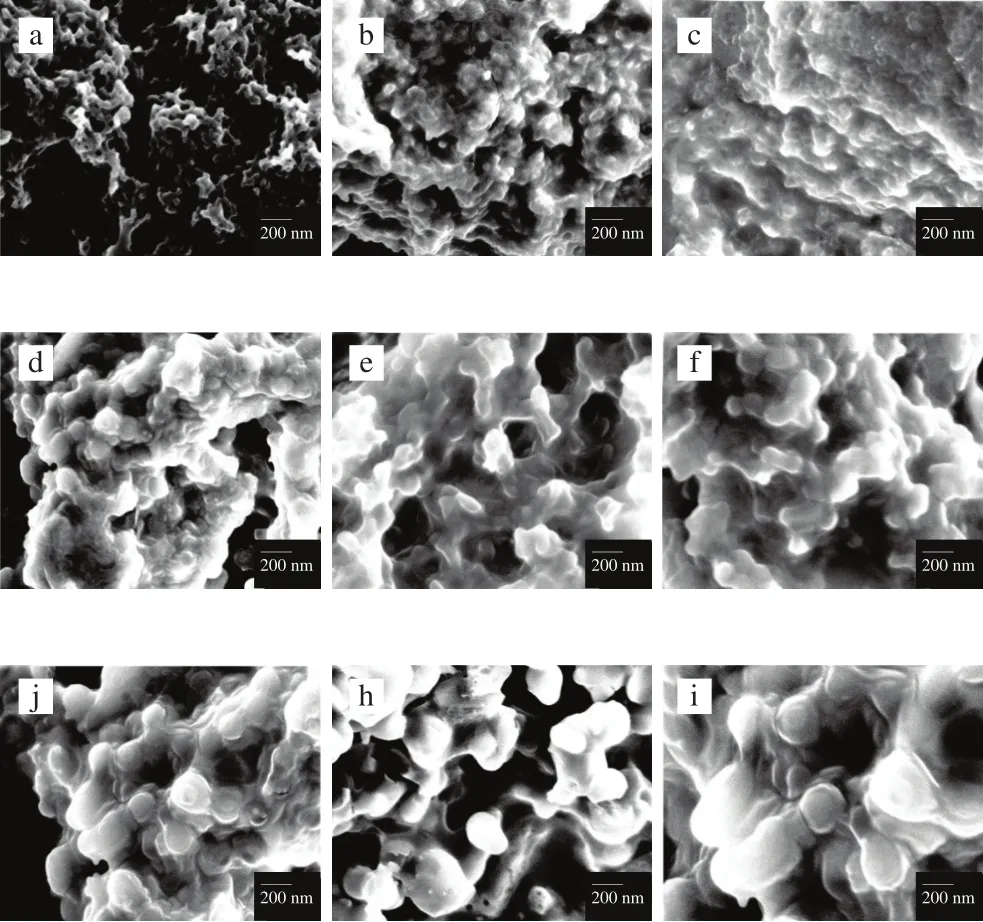
图3 OSA-DBS-不同构型风味物质包合物的扫描电子显微镜图Fig.3 SEM graphs of inclusion complexes between flavor substances and OSA-DBS
3 结 论
本实验主要利用OSA-DBS包埋线性(正己醛、正庚醛、正辛醛)、环状(γ-己内酯、γ-庚内酯、γ-辛内酯)、立体状(2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪)3 种构型的风味物质,并对其进行结构表征。结果表明,风味物质包合物制备成功,且热稳定性得到提高,热稳定性关系:线性<环状<立体状。包合物可能是球状,且包合物粒径在90~180 nm之间。在同一构型中,其包埋率和载药量具有随碳原子数的增加而逐渐增加的趋势,对于3 种不同构型的风味物质,OSA-DBS对立体状风味物质的包埋效果更好。这也为OSA-DBS包埋其他风味物质提供一些参考依据。OSA-DBS-不同构型风味物质包合物的动力学稳定性将是接下来需要深入的研究。
