pH响应性PTEN/PLGA-(HE)10-MAP纳米粒的构建及体外评价
2021-07-08岳瀚勋黄仕琴
雍 琴,岳瀚勋,石 敏,黄仕琴,赵 轩,余 娴*
(1重庆医科大学附属第二医院Ⅰ期临床试验研究室,重庆400010;2漯河市中心医院药学部,漯河462000;3重庆市江津区中心医院药学部,重庆402260)
恶性肿瘤是威胁人类健康的主要慢性非传染性疾病。据GLOBOCAN全球肿瘤负担状况报告称,2020年全球新发肿瘤病例大约1 930万,肿瘤已成为21世纪全球各国家和地区的主要死因,严重阻碍人类预期寿命的延长[1-2]。免疫治疗和基因治疗作为新兴肿瘤治疗手段正在快速发展,基因治疗是其中的重要组成部分[3]。肿瘤的发生极为复杂,基因治疗针对其遗传学背景,将具有治疗潜力的外源性目的基因导入靶细胞内,以纠正过度活化的基因或补偿缺陷的基因,从而达到抑制肿瘤生长、治疗肿瘤的目的。抑癌基因是基因治疗中相当重要的一类目的基因,其中第10号染色体同源缺失性磷酸酯酶-张力蛋白(phosphatase and tensin homologue deleted on chromosome 10,PTEN)基因于1997年由Li等[4]研究原发性乳腺癌时分离得到,是第一个被发现具有双特异性磷酸酶活性的抑癌基因。在前期研究中发现,PTEN表达下调与食管癌细胞分化程度、浸润深度及淋巴结转移密切相关,PTEN重组质粒DNA能在Eca109细胞中表达PTEN蛋白,发挥抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的作用[5-7]。但由于DNA类基因治疗药物存在难以被细胞摄取、难以在靶组织蓄积以及体内稳定性差等缺点,如何将基因安全、高效地导入靶细胞是基因治疗亟待解决的科学问题[8]。
在基因治疗中,利用纳米技术赋予生物材料多功能性用于递送基因药物,能够显著增加药物的溶解度、改善其生物利用度,提高药物在体内的稳定性并降低不良反应[9]。聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]由一定比例的乳酸和羟基乙酸构成,其在体内的最终降解产物是二氧化碳和水,目前已被美国食品药品管理局和欧洲药品管理局批准用于药物递送[10]。引入具有不同功能的多肽例如细胞穿膜肽(cell-pen⁃etrating peptides,CPPs)、pH敏感肽作为作用片段,对纳米材料进行特性改造,可有效提高基因的靶向导入效率。模型两亲性多肽(model amphipathic peptide,MAP)是由Steiner等[11]设计合成的一种两亲性CCPs,可通过内吞作用携带多种生物活性分子进入细胞。组氨酸-谷氨酸(histidine-glutamic acid,HE)重复寡肽是一段具有高度pH敏感性的多肽序列,运用生物技术融合得到pH响应性寡肽与CPPs的重组体(HE)10-MAP。在正常组织pH环境下,(HE)10可掩蔽MAP的阳离子电荷,使其丧失穿膜活性;而在肿瘤组织弱酸性微环境中,组氨酸质子化带正电荷,MAP与谷氨酸之间的静电作用被消除,穿膜活性得以恢复,可携带药物进入细胞[12]。对于pH响应的CPPs递送系统研究时间尚短,目前还未有该系统应用于载基因药物的相关报道。
本研究将PTEN质粒DNA作为模型药物,结合pH响应肿瘤靶向、CPPs递送以及纳米递送系统的优势,构建一种新型pH响应性多肽重组体修饰的纳米粒药物递送系统PTEN/PLGA-(HE)10-MAP,其制备、结构及靶向作用示意图如图1所示,并对其进行体外评价,为研发具有临床应用价值的基因药物靶向递送系统提供理论依据;为新型抗肿瘤基因药物的研发提供新的策略。
1 材料
1.1 试剂

Figure 1 Schematic showing the formulation of PTEN/PLGA-(HE)10-MAPnanoparticles(NPs)and the mechanism of pH-sensitive internalization of histidine-glutamic acid-model amphipathic peptidenanocomplex[(HE)10-MAP]
PLGA[丙交酯-乙交酯(75∶25),Mr:20 kD,济南岱罡生物科技有限公司];(2,3-二油酰基-丙基)三甲基氯化铵[(2,3-dioleoyloxy-propyl)-trimethyl⁃ammonium-chloride,DOTAP,艾伟拓(上海)医药科技有限公司];聚乙烯醇(polyvinyl alcohol,PVA,醇解度:摩尔分数87.0%~89.0%)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐[N-(3-dimethylami⁃nopropyl) -N′-ethylcarbodiimide hydrochloride,EDC]、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)(上海阿拉丁生化科技股份有限公司);CCK-8试剂盒(美国MedChemexpress公司);4%多聚甲醛溶液(PFA,重庆赛米克生物科技有限公司);Triton X-100(北京Biotopped科技有限公司);Lipo8000TM转染试剂、RIPA裂解液、PMSF、ECL发光液、PTEN兔单克隆抗体、GAPDH兔单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(H+L)(上海碧云天生物技术有限公司);DAPI染液(重庆蒙博生物科技有限公司)。其他试剂均为市售分析纯。
1.2 多肽、质粒及细胞
MAP(KLALKLALKALKAALKLA)、pH响应性寡 肽与CPPs的重 组体(HE)10-MAP[(HE)10G5KLALKLALKALKAALKLA)][生工生物工程(上海)股份有限公司];pEGFP-N2(EGFP)、pcDNA3、pcDNA3-PTEN(PTEN)质粒DNA由本实验室保存[13-14];人食管癌细胞Eca109、人正常结直肠黏膜细胞FHC、人正常肝细胞L-O2由本实验室保存。
1.3 仪器
JY88-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);Zetasizer Nano ZS90纳米粒度电位仪(英国Malvern Panalytical仪器有限公司);IX53倒置荧光显微镜(日本Olympus株式会社);Varioskan LUX酶标仪,NanoDropTMOne超微量紫外-可见光分光光度计(美国Thermo Fisher Scientific公司)。
2 方 法
2.1 纳米粒的制备及表征分析
2.1.1 纳米粒的制备 采用双乳化-溶剂挥发(W/O/W)法[15]制备PLGA纳米粒:含PTEN质粒DNA 200μg的TE缓冲液(pH 8.0)200μL作为W1相;称取DOTAP粉末10 mg、PLGA颗粒50 mg,加入二氯甲烷1 mL使二者溶解,以该混合溶液作为O相;以质量分数为2%的PVA水溶液3 mL作为W2相。将W1相缓慢滴入O相,冰浴超声乳化2 min,功率55 W,超声1 s暂停2 s,振幅35%,形成W/O型初乳溶液。沿管壁向该乳液中缓慢加入W2相,继续冰浴超声2 min形成W/O/W型复乳溶液,将复乳溶液逐滴加入至质量分数为1%的PVA水溶液8 mL中,常温下恒速(500 r/min)磁力搅拌4 h以挥发除去有机溶剂。通过低温高速离心(4℃,13 700 r/min,15 min)收集纳米粒,继而用适量无菌去离子水重悬洗涤3次后得到载PTEN质粒DNA的PLGA纳米粒混悬液(PTEN/PLGA NPs)。同法制备未载质粒DNA的PLGA纳米粒(PLGA NPs)。于-80℃放置至完全冷冻,真空冷冻干燥并称重。
参考相关文献[16],通过酰胺缩合反应制备经多肽修饰的PLGA纳米粒:取PLGA纳米粒混悬液2 mL,于磁力搅拌器上,室温条件下加入EDC 0.91 mg低速搅拌10 min后,加入NHS 1.09 mg避光搅拌30 min,活化羧基基团;继而冰浴条件下加入过量的MAP或(HE)10-MAP,得到多肽修饰的载PTEN质粒DNA纳米粒[PTEN/PLGA-MAP NPs或PTEN/PLGA-(HE)10-MAP NPs]及空载体纳米粒[PLGA-(HE)10-MAPNPs]。避光低速搅拌过夜,使PLGA的羧基端与多肽的氨基端脱水偶联;离心,洗涤3次以去除未结合的多肽,适量无菌去离子水(pH 6.5)重悬,置于4℃储备待用。
2.1.2 纳米粒的表征分析 取少许PTEN/PLGA-(HE)10-MAPNPs混悬液,使用无菌去离子水适当稀释至澄清后,使用纳米粒度电位仪测定其粒径分布及pH 7.4、7.0和6.5条件下的Zeta电位。
利用紫外分光光度法测定离心后上清液中未包封质粒DNA的浓度,按照相关公式分别计算纳米粒的包封率与载药量。
2.1.3 纳米粒的细胞毒性分析 取对数生长期的Eca109、FHC、L-O2细胞接种于96孔板中,37℃、5%CO2培养,待细胞贴壁生长至70%融合时,根据载药量计算,按纳米粒质量浓度梯度15、25、35、45 mg/mL加入空载体纳米粒PLGA-(HE)10-MAPNPs,PBS组为空白对照,各组设置3个复孔,1个空白孔,分别培养24 h和48 h。弃去原培养基,每孔加入CCK-8试剂10μL及无血清培养基90μL,37℃继续孵育2 h,置于酶标仪中测定450 nm处吸收度,计算细胞存活率。
2.2 PTEN质粒DNA抗Eca109肿瘤细胞增殖活性
利用转染试剂Lipo8000TM转染质粒进入细胞。取对数生长期Eca109细胞,接种到96孔板,细胞分组为:pcDNA3组(pcDNA3/Lipo8000TM),PTEN组(PTEN/Lipo8000TM)。质粒DNA质量浓度梯度为2、4、6、8、10μg/mL,以无血清RPMI 1640培养基为空白对照,各组设置3个复孔,转染细胞后分别培养24,48,72 h,通过CCK-8试剂检测吸收度,计算细胞抑制率。
2.3 纳米粒的摄取表达
2.3.1 倒置荧光显微镜观察绿色荧光蛋白的表达 按照“2.1.1”项方法制备载表达绿色荧光蛋白的EGFP质粒DNA纳米粒(EGFP/PLGA NPs、EGFP/PLGA-MAPNPs和EGFP/PLGA-(HE)10-MAP NPs)。取对数生长期的Eca109细胞,接种到24孔板,细胞生长融合度达70%时,分别使用裸EGFP质粒DNA(pEGFP)、EGFP/PLGA NPs转染细胞,每孔加入质粒DNA的质量为1μg。PBS组作为空白对照,各组设置3个复孔。转染48 h后,弃掉原培养基,用4%多聚甲醛溶液在室温固定细胞20 min;用含0.5%Triton X-100的PBS在室温通透化处理15 min;加入DAPI染色液室温孵育染色15 min后观察。细胞摄取荧光比例通过软件Image J分析计算获得。
2.3.2 Western blot检测PTEN蛋白的表达 取对数生长期的Eca109细胞,接种到6孔板,待细胞贴壁生长至70%融合时,更换培养基为pH 6.5的RPMI 1640,PBS组为空白对照,pcDNA3/Lipo8000TM组为阴性对照,PTEN/Lipo8000TM组为阳性对照,实验组加入PTEN/PLGA-(HE)10-MAP NPs。每孔质粒DNA质量浓度均为4μg/mL。48 h后加入RIPA裂解液4℃振摇裂解细胞,收集各组细胞裂解液,加入上样缓冲液煮沸10 min,采用BCA法测定蛋白浓度。常规方法进行Western blot实验,使用ECL化学发光试剂将清洗好的聚偏二氟乙烯膜显影,检测蛋白条带。
2.4 纳米粒的体外抗肿瘤作用
取对数生长期的Eca109细胞,接种到96孔板,当细胞生长至70%融合时,模拟肿瘤组织弱酸性微环境,更换培养基为pH 6.5的RPMI 1640,按所载质粒DNA质量浓度梯度4、6、8、10μg/mL分别加入PTEN/PLGA NPs和PTEN/PLGA-(HE)10-MAPNPs,以PBS组为空白对照,各组均设置3个复孔,继续培养48 h后按照CCK-8试剂盒说明书检测,计算细胞抑制率。
2.5 纳米粒的体外靶向性
模拟正常组织和肿瘤组织微环境,分别调节RPMI 1640培养基的酸碱度为pH 7.4、7.0和6.5。取对数生长期的Eca109细胞接种于24孔和96孔板中,待细胞生长至70%融合。24孔板内,分别使用EGFP/PLGA NPs、EGFP/PLGA-MAP NPs和EGFP/PLGA-(HE)10-MAPNPs作用于细胞,每孔加入质粒DNA的质量为0.5μg,以PBS组为空白对照,作用48 h后,使用DAPI染液染色,观察转染效果;96孔板内分别利用PTEN/PLGA NPs、PTEN/PLGA-MAP NPs和PTEN/PLGA-(HE)10-MAP NPs转染细胞,每孔质粒DNA终浓度为4μg/mL,以PBS组为空白对照,各组设置3个复孔,作用48 h后,按照CCK-8试剂盒说明书检测,计算细胞抑制率。
2.6 统计学处理
实验均至少重复3次,所有数据以xˉ±s表示,采用SPSS26.0统计软件分析,多组间比较采用单因素方差分析(One-Way ANOVA),两独立样本均数间的比较采用LSD检验,以P<0.05为差异具有统计学意义。
3 结 果
3.1 纳米粒的表征
3.1.1 粒径、多分散系数及Zeta电位 采用动态光散射法测得PTEN/PLGA-(HE)10-MAPNPs的粒径为(266.5±2.86)nm,粒径分布符合良好的正态分布模式,多分散系数(polydispersity index,PDI)均值为0.231±0.01,说明粒径分布集中均一。在pH 7.4、7.0和6.5条件下纳米粒的Zeta电位分别为-(6.7±0.26)mV、+(0.7±0.22)mV和+(37.5±0.85)mV,随pH的降低,Zeta电位由负逐步转为正,表明制备的纳米粒在弱酸性环境中稳定,且在一定pH范围具有pH敏感性。
3.1.2 包封率与载药量 使用紫外分光光度法检测上清液中质粒DNA的质量,根据相关公式计算包封率和载药量。测得纳米粒的包封率为(80.6±6.11)%。1 mg PLGA纳米粒载有质粒DNA的质量为(2 473.4±186.96)ng。表明制备的纳米粒能有效封装质粒DNA。
3.2 纳米粒具有较低的体外细胞毒性
检测空载体纳米粒PLGA-(HE)10-MAPNPs对肿瘤细胞(Eca109)及正常细胞(FHC、L-O2)的毒性,结果如图2所示。同PBS组相比,虽然部分浓度下PLGA-(HE)10-MAPNPs对细胞存活率的影响具有统计学差异(P<0.05),但在较高浓度下作用不同时间后细胞存活率仍在80%以上,说明细胞的生长状态和数量未受明显影响。这表明制备的纳米粒细胞毒性较低,生物相容性良好。
3.3 PTEN质粒DNA可抑制肿瘤细胞Eca109的增殖

Figure 2 Cytotoxicity analysis of non-loading PLGA-(HE)10-MAPNPs in Eca109 cells(A,D),FHCcells(B,E)and L-O2 cells(C,F)for 24(A-C)and 48 h(E-F),respectively(±s,n=3)
如图3所示,pcDNA3质粒DNA在不同浓度下均未表现出抗Eca109细胞增殖的能力,与之相比,PTEN质粒DNA自4μg/mL开始即明显表现出抑制Eca109细胞增殖的作用(P<0.01),此时抑制率约为50%。随PTEN质粒DNA浓度的增加,细胞抑制率显著升高(P<0.05),当质量浓度达到10 μg/mL时抑制率达到约90%,表明PTEN质粒DNA可抑制肿瘤细胞Eca109的增殖且其抗增殖作用具有浓度依赖性,但未表现出明显的时间依赖性。
3.4 纳米粒可被细胞有效摄取表达
3.4.1 EGFP蛋白的表达情况 通过荧光染色法观察绿色荧光蛋白在细胞内的表达与分布。如图4所示,pEGFP组几乎未见绿色荧光,转染效率仅为(0.12±0.07)%;EGFP/PLGA NPs组可见明显的绿色荧光,纳米粒的转染效率为(19.90±2.24)%,且细胞质、细胞核及绿色荧光蛋白共定位。提示构建过程中的超声乳化步骤不会影响质粒DNA的活性,PLGA纳米粒能显著提高细胞对所包载质粒DNA的摄取表达。
3.4.2 PTEN蛋白的表达情况 采用Western blot检测不同复合物转染Eca109细胞后PTEN蛋白的表达。结果显示PTEN/PLGA-(HE)10-MAPNPs组检测到与PTEN/Lipo8000TM组一致的相对分子质量为54 kD的PTEN蛋白特异性条带。如图5所示,与PBS组和pcDNA3/Lipo8000TM组相比,PTEN/PLGA-(HE)10-MAP NPs组和PTEN/Lipo8000TM组PTEN蛋白的表达显著增加(P<0.01),表明制备的载PTEN质粒DNA纳米粒PTEN/PLGA-(HE)10-MAP可被细胞有效摄取并表达目的蛋白。
3.5 纳米粒具有体外抗肿瘤作用
通过CCK-8法检测弱酸性环境下PTEN/PLGA-(HE)10-MAPNPs抑制Eca109食管癌细胞增殖的能力,并考察(HE)10-MAP对PLGA纳米粒抗肿瘤作用的影响。如图6所示,在pH 6.5时,PTEN/PLGA NPs组具有较弱的体外抗肿瘤作用,而PTEN/PLGA-(HE)10-MAPNPs组表现出明显增强的抗肿瘤活性(P<0.05),说明(HE)10-MAP增强了PLGA纳米粒的抗肿瘤作用。其原因可能是在弱酸性环境中(HE)10-MAP提高PLGA纳米粒的穿膜效率,导致PTEN蛋白表达增加,进而增强其抑制肿瘤细胞增殖的作用。PTEN/PLGA-(HE)10-MAPNPs组在质粒DNA质量浓度4μg/mL时抑制率达到50%,随浓度的增加其抑制细胞增殖的作用增强(P<0.01),10μg/mL时抑制率超过80%,表明制备的载PTEN质粒DNA纳米粒抗肿瘤作用具有浓度依赖性。
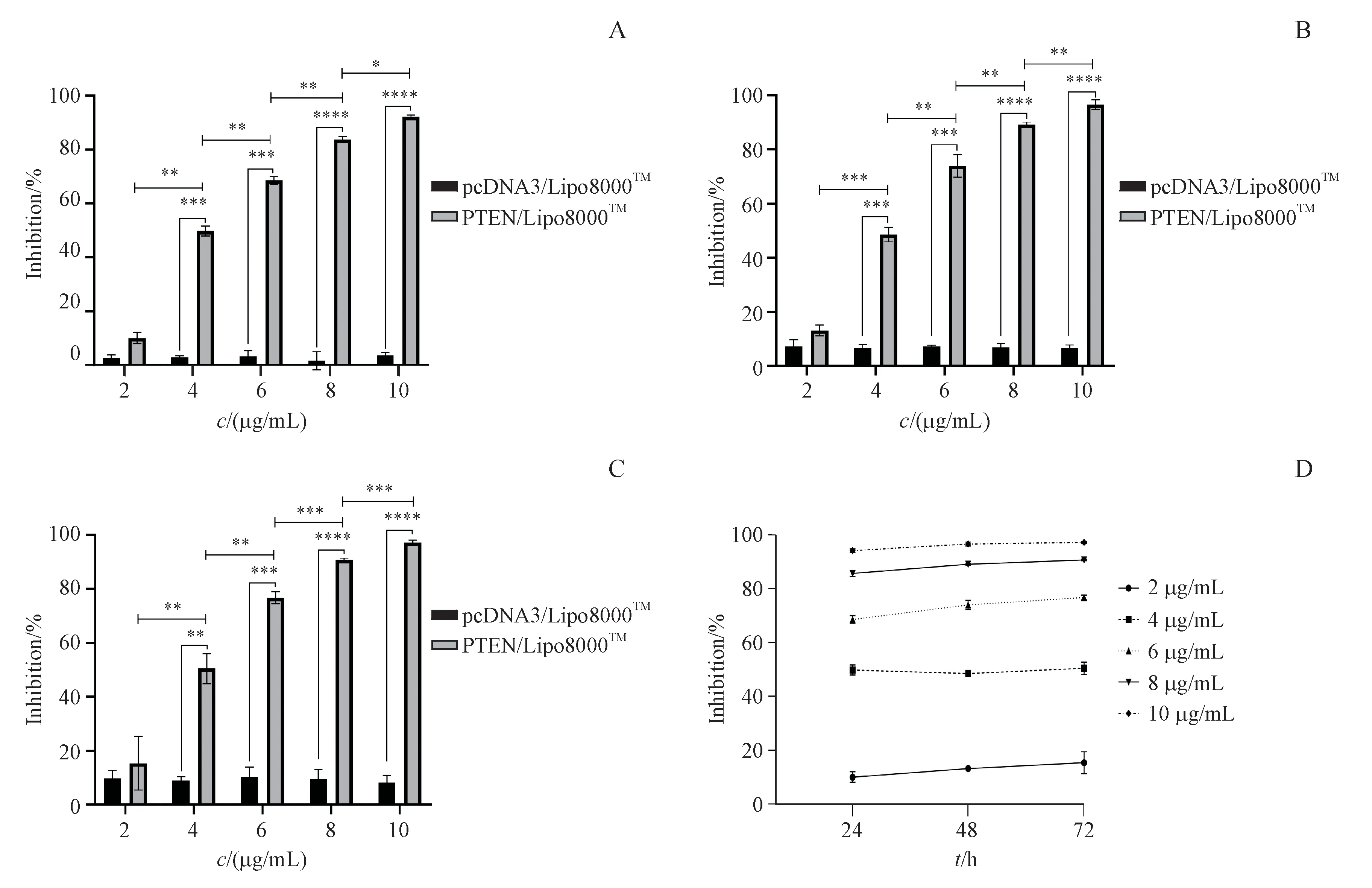
Figure3 Analysisof antiproliferativeactivity mediated by PTENin Eca109 cells(xˉ±s,n=3)

Figure 4 Expression of EGFPprotein transfected by NPs in Eca109 cells(Scale bar:200μm)

Figure 5 Western blot of PTEN protein in transfected cells under medium with pH 6.5(xˉ±s,n=3)
3.6 纳米粒具有体外pH响应性靶向作用

Figure 6 Analysis of antiproliferative activity induced by PTEN-load⁃ed NPsin Eca109 cellsunder mediumwith pH 6.5(xˉ±s,n=3)
通过荧光染色法与CCK-8实验共同验证纳米粒的pH响应性。使用荧光显微镜观察各pH条件下载EGFP质粒DNA的不同纳米粒对Eca109细胞作用48 h的转染效果。如图7所示,各纳米粒组均可见细胞质、细胞核及绿色荧光蛋白的共定位,再次说明质粒DNA的结构特性未被破坏。如图7-B所示,与PBS组相比,EGFP/PLGA NPs组可见少量荧光表达,但在不同pH条件下荧光强度基本无差异(P>0.05),说明pH不影响EGFP/PLGA NPs的摄取表达。在图7-C中,相较于EGFP/PLGA NPs组,EGFP/PLGA-MAPNPs组在各pH条件下均表现出增强的荧光(P<0.05),但荧光强度在不同pH条件下差异无统计学意义(P>0.05),提示未融合(HE)10的MAP虽可提高PLGA纳米粒的转染效率,但并无pH特异性。在pH 7.4和7.0条件下,EGFP/PLGA-(HE)10-MAP NPs组 较EGFP/PLGA-MAP NPs组的荧光强度明显减弱(P<0.05),在pH 6.5时的荧光表达则基本无差异,证实(HE)10在正常组织pH条件下可有效掩蔽MAP的穿膜活性。
Figure 7 Transfection effects of EGFP-loaded NPs with/without(HE)10-MAPin Eca109 cells under medium with different pH(xˉ±s,n=3)
制备的载PTEN质粒DNA纳米粒具有一定的体外抗肿瘤作用,通过检测细胞抑制率,侧面反映纳米粒在不同pH条件下的转染效率。以pH 7.4条件下PBS组作为对照计算pH 7.0和6.5时PBS组的细胞抑制率,结果显示不同pH条件下各PBS组的细胞抑制率差异无统计学意义(P>0.05),即调节酸碱度孵育48 h后细胞生存状态基本未发生变化。如图8所示,不同纳米粒组的细胞抑制率结果与荧光染色的结果一致。PTEN/PLGA-MAPNPs组在各pH条件下的抑制率相较于PTEN/PLGA NPs组均显著升高,但两组纳米粒的抑制率均未因pH的改变而有所变化(P>0.05),说明MAP的穿膜作用无pH靶向性。而在pH 7.4和7.0条件下,PTEN/PLGA-(HE)10-MAPNPs组的细胞抑制率明显低于其pH 6.5时的抑制率(P<0.01),同时也分别低于PTEN/PLGA-MAP NPs组pH 7.4和7.0时的细胞抑制率(P<0.01)。上述研究结果进一步表明(HE)10-MAP在弱酸性环境中可恢复MAP的穿膜活性,从而提高所载药物的转染效率。
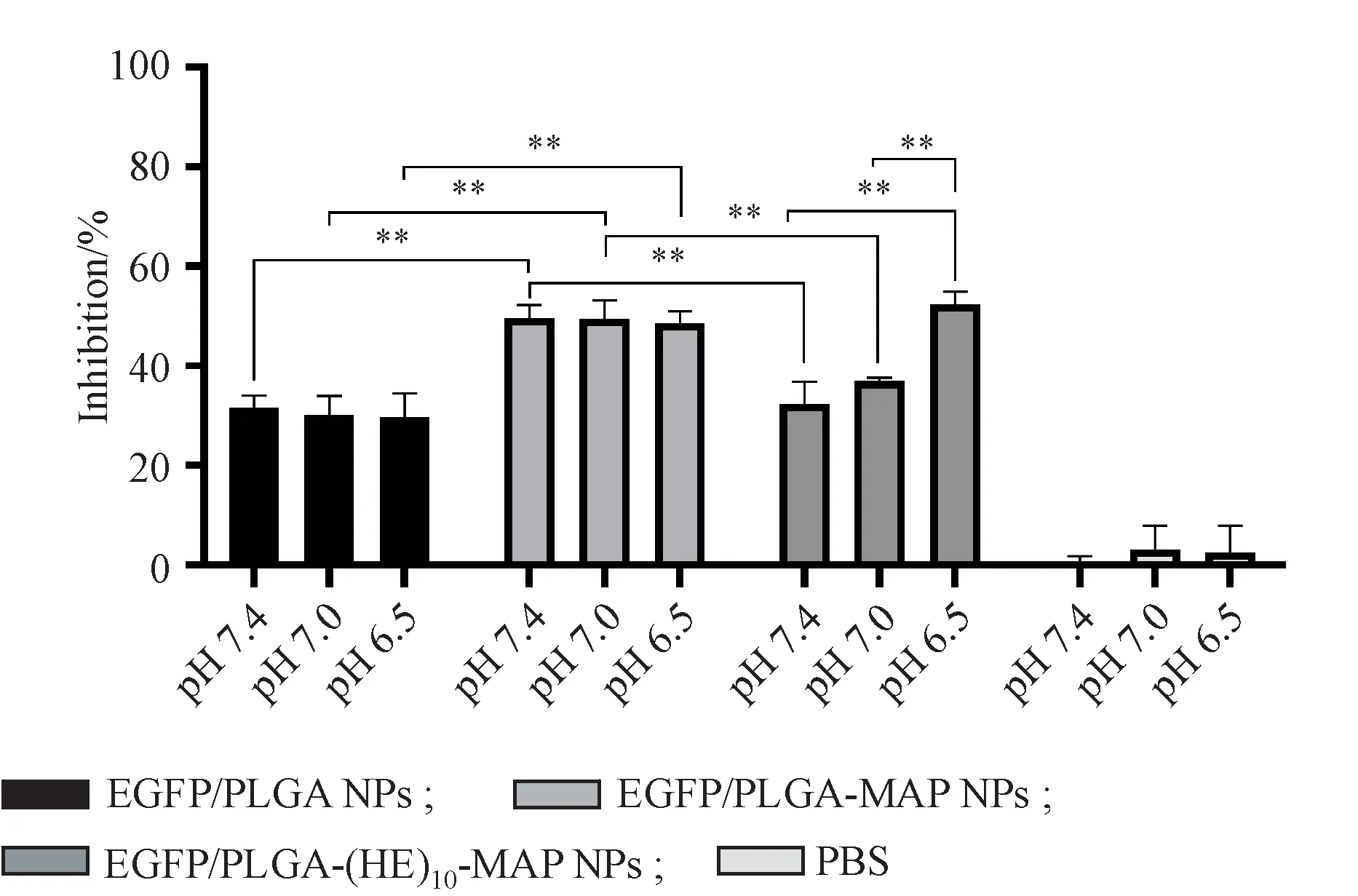
Figure 8 Analysis of antiproliferative activity of PTEN-loaded NPs with/without(HE)10-MAP in Eca109 cells under medium with different pH(xˉ±s,n=3)
4 讨 论
根据特定的肿瘤微环境设计的刺激响应型纳米递送系统是提高肿瘤基因治疗效率的有效途径[17]。本研究以PTEN质粒DNA作为抗肿瘤的模型基因药物,以Eca109细胞作为代表性肿瘤细胞进行体外抗肿瘤相关实验。经验证,PTEN蛋白的表达增加可抑制食管癌细胞Eca109的增殖。选用安全的PLGA作为载体材料,使用带正电荷的阳离子化合物DOTAP形成反胶束修饰PLGA纳米粒,实现质粒DNA的有效包封[18]。其中PLGA具有极高的生物安全性和良好的可塑可修饰性,作为纳米粒载体可防止药物降解、降低药物毒性并减少刺激,且在反复给药的情况下亦可随人体代谢排出体外,而不会在体内蓄积[19]。针对肿瘤组织细胞外液pH(6.0~7.0)呈弱酸性的特性,选用pH响应性寡肽与CPPs的重组体(HE)10-MAP偶联至其表面[20],制备pH响应性PLGA纳米粒以期实现靶向递送抗肿瘤基因药物的作用。其中MAP在多项研究中均表现出较其他常用CPPs更高的转导效率和更佳的抗蛋白酶水解稳定性[21]。而在正常组织环境中,HE重复寡肽能够掩蔽MAP的穿膜活性[22]。有研究表明,(HE)10-MAP具有高pH敏感性,在pH 6.5~7.5条件下,其净电荷随pH的降低由负转正,其内化亦随之大幅增加,在pH 6.5左右达峰值[23]。
制得的pH响应性多肽重组体修饰的载PTEN质粒DNA的PLGA纳米粒PTEN/PLGA-(HE)10-MAP包封率在80%以上,对质粒DNA具有良好的包封效果;粒径位于200~300 nm之间,PDI约为0.231,小于0.25,说明纳米粒分布均匀[24];细胞毒性实验提示制备的纳米粒递送系统基本安全无毒。在pH 6.5时,Zeta电位约为+37.5 mV,大于+30 mV,说明制备的纳米粒分散体系在弱酸性环境中具备静电稳定性和空间稳定性[25];同时Zeta电位随pH的降低呈现由负到正的变化趋势,表明纳米粒具有pH敏感性,能很好地被肿瘤细胞摄取[26]。Western blot与CCK-8实验结果均显示纳米粒在与肿瘤组织相似的弱酸性环境中可被有效摄取表达,且表现出显著的抗肿瘤作用和pH靶向性。
为验证纳米粒可提高细胞对质粒DNA的摄取表达且具有pH响应性,制备偶联/未偶联(HE)10-MAP的载EGFP的PLGA纳米粒,观察其荧光表达情况。结果显示,经PLGA纳米粒包载的EGFP质粒DNA可在细胞内成功转录表达,纳米粒的构建过程不破坏质粒DNA结构活性的完整性;偶联(HE)10-MAP后仍可表达绿色荧光蛋白,且在弱酸性条件下表达增加,表面修饰(HE)10-MAP的PLGA纳米粒具有靶向性且可显著增加质粒DNA的转染效率。
综上所述,本研究成功制备具有pH肿瘤靶向性的PTEN/PLGA-(HE)10-MAP纳米粒,并证实该纳米粒是一种可行的基因药物靶向递送系统。但本研究仅进行了体外实验部分,将在后续实验中完善纳米粒的体内实验与评价,以期为进一步研发及临床应用提供理论依据。
