3 种土壤对扑草净的吸附过程及其化学特征基团变化
2021-07-08孙仕仙邓志华
肖 敏 孙仕仙 邓志华
(1.西南林业大学湿地学院/国家高原湿地研究中心,云南 昆明 650233;2.西南林业大学生态与环境学院/云南省山地农村
生态环境演变与污染治理重点实验室,云南 昆明 650233)
当前农业的快速发展离不开化学农药的施用,我国是农业大国,农作物的生长与调节离不开农药。根据国家统计局数据显示,近18 年来我国农药年平均使用量为160.79 万t/a。农药的应用有效提高了农作物产量,但人们对农药的不恰当使用也引起了一系列环境问题。农药的大规模施用不仅会影响农作物的质量,造成农产品中农药量的累积,而且会通过食物链的富集和传递最终威胁人类的健康[1]。农药施用后,其中65%排入周边土壤,残留在土壤中的农药通过径流、淋滤等途径进一步污染地表和地下水体[2]。目前,农药已经成为我国水土环境影响范围最广,危害程度最大的有机污染物之一。扑草净(4,6−双异丙胺基−2−甲硫基−1,3,5−三嗪)属于三氮苯类除草剂,是一种选择性输导型土壤处理剂[3],具有杀草谱广,药效长等优点,常用于农业防除禾本科及阔叶杂草,在播种或发芽前直接施用于土壤[4]。扑草净的化学性质较稳定,可长期存在于环境及生物体中,在田间可稳定存在12~18 个月[5]。扑草净属于环境内分泌干扰物,会干扰人体内分泌系统的正常运转[6],由于其潜在的环境风险,欧盟自2004 年起就禁止使用[3],但在中国仍被广泛施用。近年来,研究者在农作物、水产品、地下水、地表水甚至母乳中都检测到扑草净及其降解产物[7-8]。
土壤对有机污染物的吸附影响着有机污染物在环境中的迁移、转化和生物利用等过程。农药被土壤吸附以后,农药在土壤中的毒性、流动性和生物活性都有所降低,即土壤对农药具有缓冲和净化解毒作用。农药在土壤中的吸附过程对农药的挥发、生物降解、光解和水解等过程都有重要影响,并在很大程度上决定农药在土壤中的分布特点[9]。研究表明,被土壤或沉积物颗粒吸附的农药其生物有效性可能更持久[10]。因此,研究农药在土壤中的吸附行为及其吸附机理非常重要。土壤是有机物与无机物共存的混合物,土壤中有机物主要包括烃类、醇类、酚类、酮类、酸类、胺类以及芳香烃,而无机物则主要包括各种矿物、氧化物以及阴离子等[11]。傅里叶变换红外光谱技术由于其通用性、快测性以及低成本性等特点,在土壤研究中得到越来越广泛的应用。在农业环境中,掌握土壤对扑草净的吸附动力学及吸附机理对于杂草控制、作物毒性、扑草净的流失或转移等具有重要意义。目前,有关扑草净的研究多集中在扑草净在土壤中的残留、吸附与解吸、迁移与淋溶行为,以及有机质对扑草净吸附的贡献方面。曹军[12]研究发现土壤有机质含量越高越有利于扑草净在土壤中的吸附;当pH 值接近扑草净的pKa时,吸附达到最大。陈广[13]研究了不同极性和不同分子量溶解性有机物(DOM)组分对土壤中扑草净迁移行为的影响,并通过光谱学手段探讨了各组分的组成与特征。姜蕾[14]研究发现DOM 能明显抑制土壤对扑草净的吸附,增强土壤中扑草净的解吸,促进扑草净在土壤中的迁移。但在扑草净在土壤中的吸附过程中,利用傅里叶红外光谱探讨其吸附机理的相关研究较少。
本研究以不同类型的南方农田土壤为供试土壤,以三氮苯类除草剂扑草净为研究对象。探讨扑草净在不同类型土壤中的吸附特征,对土壤中扑草净的吸附动力学模型以及吸附过程中土壤主要基团的变化特征进行研究,进而揭示扑草净在土壤中的吸附行为及吸附机理,为探讨扑草净在土壤中的归趋提供基础数据,为扑草净环境风险的评价提供参考。
1 材料与方法
1.1 材料
扑草净由山东济南子安化工有限公司提供,纯度为97%;正己烷为色谱纯,其他试剂均为分析纯,由昆明盘龙华森公司提供。试验所用红壤、水稻土采自昆明市西山区砚台村、黄壤采自昆明市晋宁区大沟尾村,所有供试土壤均采自0~20 cm 表层土壤,经自然风干后研磨过筛备用。取适量土壤置于121 ℃高压灭菌锅内灭菌2 h,重复灭菌3 d,经105 ℃烘干至恒质量后冷却至室温进行吸附实验[15]。土壤pH 值采用水土比为2.5∶1 的电位法测定[16],土壤质地采用全自动激光粒度仪测定,使用烘干法测定土壤含水量,采用乙酸铵法测定土壤阳离子交换量,采用重铬酸盐氧化法测定土壤有机质含量[16]。供试土壤理化性质如表1 所示。

表1 供试土壤理化性质Table 1 Physical and chemical properties of the tested soil
1.2 实验设计与方法
1.2.1 吸附动力学实验
分别称取粒径为2 mm,(2±0.002) g 灭菌后的土壤样品于离心管中,同时加入30 mL 浓度为4 mg/L 的扑草净溶液(以0.01 mol/L CaCl2为背景溶液,旨在增强离子作用)[17],将离心管置于25 ℃恒温摇床避光振荡(240 r/min)。分别在不同时间段停止振荡(5、10、20、30、60、180、360、540、720、1440 min),取出样品离心5 min(8000 r/min),后取10 mL 上清液转移至分液漏斗中,加入20 mL 乙酸乙酯萃取,重复萃取1 次。将萃取液置于40 ℃水浴蒸发锅中蒸干,用5 mL 正己烷溶解后过0.22 μm 有机相滤膜,滤液用气相色谱质谱联用仪(GC−MS)检测。每个取样时间为1 个处理,每个处理设置3 个重复。
1.2.2 GC-MS 检测条件
采用气相色谱质谱联用仪GC−MS(赛默飞世尔)测定样品中扑草净含量。测试条件为:色谱柱为TR−5MS(30 m×0.25 mm,0.25 μm);载气为高纯氦气,流速为1.5 mL/min;进样口温度为250 ℃;不分流进样,进样量为1 μL;升温程序为:40 ℃,保持1 min,以35 ℃/min 的速率升至180 ℃,保持1 min,然后以20 ℃/min 的速率升至280 ℃,保持1.5 min。电子轰击离子源(EI),电离电压70 eV;离子源温度为250 ℃,接口温度为250 ℃;扫描方式为选择离子扫描(SIM),定量离子(m/z)为58、168、241;外标法定量。样品加标回收率为99.24%~108.44%,相对标准偏差(RSD)为0.04%~4.03%,检出限为0.1 μg/L。
1.2.3 红外光谱分析条件
取不同吸附时间的土壤样品,放入冷冻干燥机冷冻干燥,取冻干后的土样与溴化钾混合压片(按m(样品):m(溴化钾)=1∶200 的比例),在傅里叶交变换红外光谱仪上测定吸附前后土壤主要官能团的变化。扫描范围为4000~400 cm−1。
1.3 数据分析
采用Excel 2010,Origin 9.1 进行数据分析。
1.3.1 土壤中扑草净的吸附量
可根据式(1)计算土壤中扑草净的吸附量:

式中:qe为土壤中扑草净的吸附量(mg/kg),p0和pe分别为扑草净的初始质量浓度和吸附平衡时上清液的质量浓度(mg/L),V为扑草净溶液体积(mL),m为土壤质量(g)。
1.3.2 吸附动力学方程
准一阶动力学方程:

准二阶动力学方程:

式中:qt和qe分别是吸附时间t、吸附平衡时间的吸附量,mg/g;k1、k2分为准一阶、准二阶动力学方程吸附数率常数。
2 结果与分析
2.1 3 种土壤吸附扑草净的动力学特征
吸附动力学可以反映溶质吸附速率和吸附效率,对揭示扑草净在土壤环境中的迁移和转化速率具有重要价值。由图1 可知,水稻土对扑草净的吸附率在80、360 min 和720 min 出现平台期,红壤和黄壤对扑草净的吸附率在180、360 min 和720 min 出现平台期,表明扑草净在3 种土壤中的吸附过程分为快速、慢速吸附和吸附平衡3 个阶段。在快速吸附阶段,即0~180 min 内,供试土壤对扑草净的吸附速率较快,供试土壤对扑草净的吸附量呈现急剧增大趋势,表明液相中的扑草净被快速吸附到供试土壤表面。随着接触时间的进一步增加(180~360 min),吸附速率增加逐渐缓慢,吸附过程慢慢趋向动态平衡;当吸附时间超过360 min 后,黄壤对扑草净的吸附趋于饱和;当吸附时间达到720 min 后,扑草净在3 种供试土壤中的吸附量趋于动态饱和,表明在1440 min 内3 种土壤对扑草净的吸附都基本达到平衡,此时3 种土壤对扑草净的吸附率分别为水稻土(26.0%),红壤(23.1%),黄壤(19.4%),出现这种现象的原因可能是,供试土壤表面的吸附位点有限,随着反应的不断进行吸附点位逐渐达到吸附饱和,相应的吸附速率也随之下降,土壤对扑草净的吸附最终趋向平衡。为了进一步从吸附动力学角度探讨扑草净在供试土壤的吸附过程及特征,分别采用准一阶动力学方程和准二阶动力学方程对扑草净在3 种土壤中的吸附动力学数据进行拟合分析,结果如表2 所示,2 种方程的拟合情况良好。由动力学方程的拟合相关系数(R2)可知,扑草净在3 种土壤中的吸附动力学过程与准二阶动力学方程更吻合,表明扑草净在这2 类土壤中的吸附过程主要受化学吸附控制,这与陈卫林等[18],李军等[19]研究一致。上述现象表明,扑草净在3 种供试土壤中的吸附过程较复杂,可能由外部液膜扩散、颗粒内膜扩散和表面吸附等多种作用综合产生[20-21]。

图1 不同类型土壤对扑草净的吸附动力学特征Fig.1 Adsorption kinetics characteristics of different types of soil for the removal of prometryn

表2 扑草净在3 种供试土壤中的吸附动力学参数Table 2 The adsorption kinetic parameters of prometryn in 3 kinds of tested soils
2.2 黄壤吸附扑草净的红外光谱分析
土壤的组成成分十分复杂,是由不同种类的混合物组成,单个特定化合物的光谱无法反映土壤复杂的属性,可通过土壤红外光谱图中特征峰的峰强、形状及位置等分析土壤的组成特征[22]。土壤中晶格硅氧键伸缩振动及其他能量较小的羟基弯曲振动频率范围在400~1300 cm−1,3700~3100 cm−1主要是土壤黏土矿物中含有的羟基键伸缩振动形成的吸收谱带。扑草净分子在供试土壤中吸附前后红外光谱图的变化情况可为扑草净在土壤中的吸附特征及吸附机理过程分析提供科学依据。由扑草净的红外光谱图可知,3260 cm−1附近为扑草净分子中N—H 伸缩振动的特征吸收峰[23],2970 cm−1附近为扑草净分子C—H 键伸缩振动形成的吸收峰[24-25],1500~1600 cm−1附近的吸附峰为扑草净分子中C=N 振动形成的特征吸收峰。
为了探讨外源扑草净与土壤之间的相互作用,对吸附前后的土壤进行了红外光谱分析。由吸附前后黄壤吸收峰强度、特征吸收峰位置变化情况可知(图2),当吸附时间为20 min时,3621 cm−1附近的羟基[26]伸缩振动峰移向3618 cm−1处,发生了一定程度的红移。与此同时,3427 cm−1附近黏土矿物吸附水的羟基伸缩振动峰[27-28]消失。559 cm−1附近的Si—O—Mg、Si—O—Al 弯曲振动峰[29]移到532 cm−1,502 cm−1附近的Si—O—Si[28]特征峰移向470 cm−1,发生了不同程度红移;当吸附进入慢速吸附(180 min)和平衡阶段(1440 min),扑草净−黄壤复合物的羟基特征峰,Si—O—Mg、Si—O—Al 特征峰和Si—O—Si 特征峰也存在不同程度移动现象。实验结果表明,黄壤中的羟基官能团和黏土矿物在吸附初期就参与了扑草净的吸附过程,扑草净分子与黄壤中的羟基进行作用,形成氢键,在红外光谱图上出现氢键的特征峰;扑草净分子中的N—H 键与黄壤中的Si—O—Mg、Si—O—Al 键也存在相互作用和干扰,造成黄壤中的Si—O—Mg、Si—O—Al 特征峰出现移动现象。
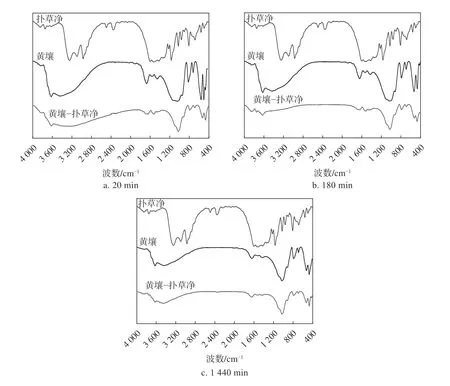
图2 黄壤吸附扑草净前后红外光谱图Fig.2 FTIR spectra of zheltozem before and after adsorption of prometryn
2.3 红壤吸附扑草净的红外光谱分析
如图3 所示,当红壤与扑草净的吸附时间为20 min 时,红壤−扑草净复合物3619 cm−1附近的羟基特征峰移到3621 cm−1处,存在一定蓝移,3442 cm−1处黏土矿物吸附水表面羟基伸缩振动峰向3446 cm−1处移动,出现蓝移。原来535 cm−1处Si—O—Mg,Si—O—Al 弯曲振动峰向531 cm−1处移动,473 cm−1处Si—O—Si 弯曲振动峰向470 cm−1处移动,出现一定程度红移;当吸附时间为180 min 时,红壤−扑草净复合物羟基特征峰和Si—O—Mg、Si—O—Al 弯曲振动峰也出现移动现象;当吸附时间达到24 h 后,3621 cm−1附近的羟基特征峰存在向3622 cm−1蓝移现象。上述现象说明,氢键是红壤与扑草净之间结合的主要作用力,扑草净分子中的N—H 键与红壤的Si—O—Mg、Si—O—Al 键之间也存在相互作用和干扰。存在这种现象可能是因为扑草净在土壤中的吸附−解吸是一个动态过程,随着吸附时间的增加,吸附作用转移到吸附作用力较强的吸附位点。吸附初期,土壤表面各吸附位点均有作用,随着吸附时间的增加,作用力较弱的位点呈现的特征峰移动变得不明显,扑草净分子被吸附到作用力较强的位点,最终达到吸附饱和,吸附特征吸收峰位置出现稳定。
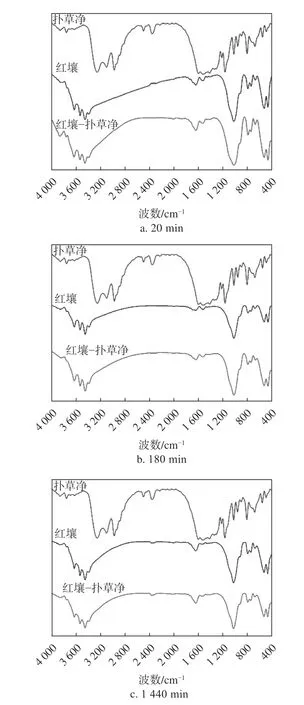
图3 红壤吸附扑草净前后红外光谱图Fig.3 FTIR spectra of krasnozem before and after adsorption of prometryn
2.4 水稻土吸附扑草净的红外光谱分析
由水稻土在吸附扑草净前后红外光谱图的变化可知(图4),当吸附时间达到20 min 时,水稻土在3624 cm−1处的高岭石峰单峰[30]吸收强度减弱,表明高岭石参加了吸附。3528 cm−1和3444 cm−1处特征峰消失,说明羟基参与了扑草净的吸附。1026 cm−1处Si—O—Si 特征峰或脂肪族C—N 伸缩振动峰强度和790 cm−1处的石英Si—O—Si 伸缩振动峰强度减弱,说明黏土矿物和有机物对吸附过程存在一定影响;当吸附时间达到180 min时,527 cm−1和469 cm−1附近的Si—O—Mg,Si—O—Al 弯曲振动峰和Si—O—Si 弯曲振动峰峰强度出现了减弱现象,表明黏土矿物对吸附过程也有一定影响;吸附时间为24 h 时,吸附出现平衡。此时水稻土红外光谱的羟基特征峰、Si—O—Mg,Si—O—Al弯曲振动峰仍然出现一定移动现象。实验结果表明,氢键是扑草净与水稻土表面之间的重要作用力,同时土壤黏土矿物也参与了扑草净的吸附。

图4 水稻土吸附扑草净前后红外光谱图Fig.4 FTIR spectra of paddy soil before and after adsorption of prometryn
3 结论与讨论
3 种供试土壤对扑草净的吸附能力有限,吸附最终达到饱和,吸附过程经历了快速、慢速和平衡3 个阶段,扑草净在供试土壤中的吸附均能在24 h 内达到吸附饱和。这种初始快速吸附现象表明,扑草净在施用或排放至土壤时,不容易通过渗滤等途径离开土壤,而会在土壤上产生较长的吸附和停留过程,该过程是扑草净与供试土壤之间生物、化学作用的复杂过程[31],其上会产生类似DBP 在白浆土和黑土中的吸附过程所出现的吸附平衡现象[32],和三峡库区水动带土壤对莠去津吸附动力学过程[33]。准二阶动力学方程能较好描述这3 种土壤对扑草净的吸附动力学过程,这与6 种杀虫剂在地中海盆地农业土壤中的吸附过程研究一致[34]。准二级动力学模型对化学吸附过程有很好的拟合效果,说明土壤与扑草净之间很可能是通过电子交换或形成化学键进行吸附,因此二者之间的吸附作用力比较强,吸附作用比较牢靠[35]。
红外光谱法是研究农药在土壤上吸附机理最常用的手段之一。3 种供试土壤的红外光谱图均在3621 cm−1,1645 cm−1和1035 cm−1等处有特征吸收峰,表明3 种供试土壤属于蒙脱石型图谱[29]。类似结论在潮土、红壤、棕壤、黄壤、荒漠土和暗棕壤的FTIR 分析[28]研究中也有报道。在土壤对扑草净的吸附过程中,氢键是扑草净与3 种供试土壤之间的主要作用力。这可能是因为土壤中含有的羟基官能团与扑草净分子的N—H 键和C—H 键形成氢键,类似的现象在甲萘威与土壤粘土矿物的结合[36]、土壤−水体系中黄体酮的吸附机制[37]、邻苯二甲酸二丁酯在土壤中的吸附[38]以及阿特拉津在砖红壤、燥红土、红壤和水稻土中的吸附[17]等研究中均有报道。除此之外,扑草净分子中的—NH 官能团与土壤黏土矿物Si—O—Mg,Si—O—Al 键之间可能存在相互作用和影响,进而促进了土壤对扑草净的吸附。
