2 个蝴蝶兰品种对低温胁迫的生理响应
2021-07-08马晓华胡青荻张庆良钱仁卷刘洪见张旭乐
马晓华 胡青荻 张庆良 钱仁卷 刘洪见 张旭乐
(浙江省亚热带作物研究所,浙江 温州 325005)
蝴蝶兰(Phalaenopsis amabilis),兰科(Orchidaceae)蝴蝶兰属(Phalaenopsis)植物,生长于热带和亚热带地区,约有70 多个原生种,是观赏价值极高的一种附生兰,因其花色绚丽、花型奇特、姿态优美,素有‘洋兰皇后’的美誉[1-2]。目前,蝴蝶兰是国内外年宵花市场上最受广大消费者喜爱的中高档盆花之一,市场需求量逐年递增。蝴蝶兰为热带花卉,喜温暖湿润的环境,尤其对温度十分敏感,最适宜的生长温度约为18~28 ℃,当环境温度低于10 ℃会停止生长,低于5 ℃,根系停止吸水,出现冻伤,植株容易死亡[3]。当前温度已成为限制蝴蝶兰生产且影响其花卉品质的重要环境因素之一,严重制约了蝴蝶兰产业的迅速发展。因此,探索不同的蝴蝶兰品种在低温条件下的生理生化响应,筛选耐低温型的蝴蝶兰品种一直是国内外学者的研究重点之一。
大量研究表明,植物在长期的进化过程中,形成了相关的抗氧化酶保护系统以调节逆境胁迫所带来的不利反应,但不同的植物种属间由于遗传特性不同,对环境的适应调节能力存在显著差异,即使是同种属的不同品种也会因选育方向、遗传背景等原因表现出完全不同的环境适应能力[4]。近年来,随着蝴蝶兰产业的发展,蝴蝶兰属至少包含35 种以上,并且还存在着极多的种间和属间的杂交种[5],由此表明,蝴蝶兰的遗传基础复杂多样,不同品种间极可能存在着巨大的抗性差异。刘学庆等[6]研究探索了6 个蝴蝶兰品种的耐低温能力,发现大部分蝴蝶兰品种的极限耐受夜温低于9 ℃。高冬冬等[7]研究了3 个蝴蝶兰品种在低温0 ℃和5 ℃条件下48 h 内叶片的生理响应,表明0 ℃/12 h 可能是蝴蝶兰耐冷性品种的低温承受极限,但还需要结合实际进行更深入的探索。田丹青等[5]通过对3 个蝴蝶兰品种的抗寒性分析,发现抗氧化酶系统中的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和丙二醛(MDA)含量与蝴蝶兰的抗寒性关联度较高,可以作为蝴蝶兰抗寒性的鉴定指标。目前0~5 ℃的低温是长江中下游地区在蝴蝶兰的冬季生产过程中限制花卉品质和观赏价值的重要环境条件之一,而关于蝴蝶兰品种在极端低温条件下短期的生理生化变化研究较少,大多数集中在4 ℃或5 ℃条件下蝴蝶兰在0~12 h 内的生理响应或不同浓度水杨酸(SA)对蝴蝶兰抗冷性的影响[7-8]。
‘绿熊’和‘安娜’是该地区市场的主推品种及低温型蝴蝶兰育种的重要材料之一,而关于‘绿熊’和‘安娜’的相关研究却未见报道。因而本试验选用‘绿熊’和‘安娜’2 个蝴蝶兰品种,主要研究其在5 ℃极端低温条件下的生长变化和生理响应,探索不同的蝴蝶兰品种在极端低温条件下的适应能力,以期为蝴蝶兰抗寒性品种的选育和栽培管理提供一定的试验素材和理论基础。
1 材料与方法
1.1 试验材料
试验于2019 年11—12 月,在浙江杭州的浙江省农业科学院低温控制室内(118˚21′~120˚30′E,29˚11′~30˚33′N)进行。供试材料为蝴蝶兰‘绿熊’和‘安娜’。自2017 年至2019年栽培,期间以智利进口水草为基质,精细水肥管理。试验选择长势良好,叶片4~5 片,健康无病虫害的2 年生正常生长的植株。
1.2 试验设计
首先将供试的蝴蝶兰植株置于昼(25 ℃)/夜(18 ℃)、光照昼(180 μmol/(m2·s);12 h)/夜(0 μmol/(m2·s);12 h)、相对湿度(RH)70%~75%的41H02 培养箱(PERCIVALE,美国)内预处理5 d,并保证基质等其他条件满足植物的生长需求,使各植株生长一致。预处理结束后将各植株放入温度为5 ℃培养箱内,RH 70%~75%,光照设置与预处理相同,分别在0(CK)、12、24、48 h 取各植株叶片进行生理指标分析。低温处理结束后放置在正常的气候室内进行恢复生长,期间每天观察植株的表观变化至冷害症状显著。
1.3 试验方法
试验处理结束后,采用Li−6400(LI−COR,美国)便携式光合仪在开放气路下测定不同处理的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr)。由于蝴蝶兰为景天酸代谢途径植物,气孔夜间开放,在22:00—24:00,设光合有效辐射0 μmol/(m2·s),流速500 mol/s,叶室温度与培养温度相同,CO2浓度400 μmol·mol。蝴蝶兰叶片酶液提取,pH=7.5预冷的磷酸缓冲液(0.05 mmol/L),加入0.5 g 叶片样品冰浴研磨成匀浆,4 ℃下8000 rpm 离心20 min,取上清液备用。SOD 活性测定采用SOD试剂盒(南京建成生物公司,中国),愈创木酚法测定POD 活性[9],紫外吸收法测定CAT 活性[10],细胞膜透性测定采用电导法[11],MDA 含量测定采用硫代巴比妥法[10],叶绿素含量测定采用乙醇浸提法[12]。蒽酮比色法测定植株的可溶性糖[12],考马斯亮蓝染色法测定植株的可溶性蛋白[13],脯氨酸采用磺基水杨酸和茚三酮的方法测定[13]。
1.4 数据分析
数据分析采用SPSS 16.0 软件统计处理,运用Duncan 检验法进行多重比较。
2 结果与分析
2.1 低温对2 个蝴蝶兰品种表型的影响
叶片是植物营养储存和转化的重要部位,也是植物进行光合作用的主要器官,其生长状况直接影响植物的光合作用效率,进而影响植株整体的生长和发育状态[14]。由图1 可知,低温胁迫后正常条件恢复生长4 d,2 个蝴蝶兰品种的冷害症状差异十分明显。与CK 相比,‘安娜’的冷害表现较为严重,‘绿熊’的冷害表现十分轻微。具体症状为‘安娜’在低温胁迫48 h 后,恢复生长1 d 老叶表现出轻微冷害症状,叶尖稍有冻斑;2 d 新叶出现冻斑,老叶萎蔫;3 d 新叶出现冻斑更加严重,老叶萎蔫;4 d 新叶出现冻斑加剧,老叶萎蔫脱落。‘绿熊’经过48 h 低温胁迫,在正常条件下恢复生长4 d 后,没有明显的冷害症状,只有部分老叶有极其轻微冻斑,部分叶片褪绿发黄。

图1 低温胁迫(5 ℃低温处理48 h,恢复生长4 d)对蝴蝶兰叶片表型的影响Fig.1 The effect of cold stress (5 ℃ cold stress 48 h,recovery growth 4 d) on the leaf morphology of P.amabilis
2.2 低温对2 个蝴蝶兰品种光合参数的影响
光合作用是植物物质和能量代谢的基础,蝴蝶兰作为景天酸代谢途径的植物,其光合作用在低温条件下的变化见表1。在低温条件下,‘绿熊’与‘安娜’2 个蝴蝶兰品种的Pn、Gs、Ci和Tr均随温度处理时间的增加呈下降趋势(P<0.05)。‘绿熊’叶片的Pn、Gs在低温处理0、12、24 h 差异不显著,但在处理48 h 时含量最低(P<0.05)。‘绿熊’叶片的Ci和Tr随着低温时间的增加而逐渐降低,且在处理48 h 达最小(P<0.05)。‘安娜’的Pn、Gs、Ci和Tr与随着低温处理时间的增加呈显著降低趋势,且下降幅度显著大于‘绿熊’(P<0.05),并在低温处理48 h 时含量达到最低,分别是0 h 的72.8%(P<0.05)、66.67%(P<0.05 )、78.52%(P<0.05)和81.7%(P<0.05)。
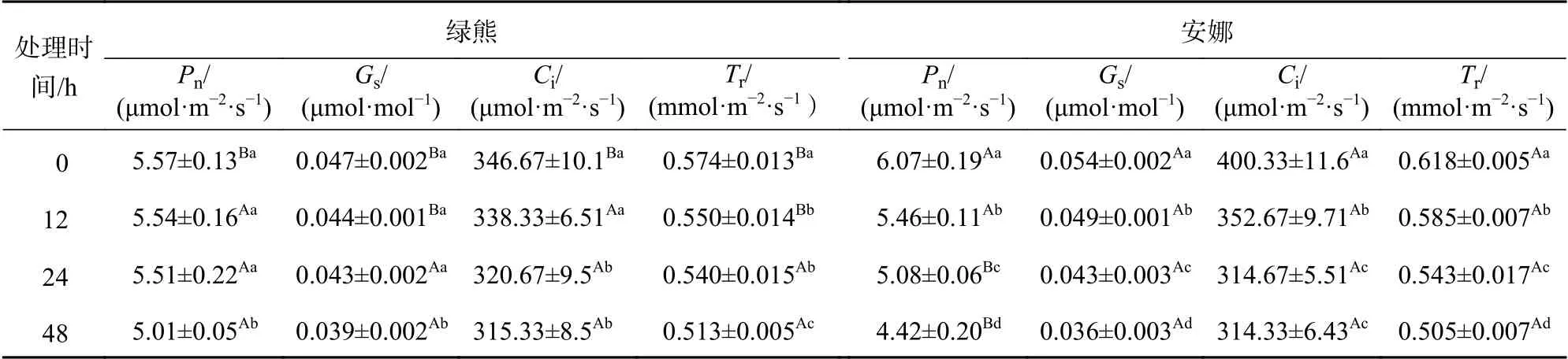
表1 低温胁迫对2 个蝴蝶兰品种光合参数的影响Table 1 The effect of cold stress on the photosynthetic parameter of 2 cultivars of P.amabilis
2.3 低温对2 个蝴蝶兰品种相对电导率与MDA 含量的影响
相对电导率(REC)是细胞膜透性的重要体现,MDA 是植物细胞膜脂过氧化的终产物,因而二者常被当作了解逆境对生物膜伤害程度的重要指标[15]。由图2 可知,在低温胁迫条件下,‘绿熊’与‘安娜’蝴蝶兰的REC 与MDA 含量均随处理时间的增加呈上升的趋势(P<0.05)。‘绿熊’叶片的REC 在低温处理0、12、24 h 差异不显著,但在处理48 h 时达最大值,显著高于低温0 h 的REC 值(P<0.05);MDA 含量在低温处理24 h 和48 h 差异不显著,但在处理48 h 时为最大显著高于其他时间处理,是0 h 的106.41%(P<0.05)。‘安娜’叶片的REC 和MDA 含量,随着低温处理时间的增加呈显著上升趋势,并在处理时间至48 h 达最大值(P<0.05),且上升幅度明显高于‘绿熊’。

图2 低温胁迫对蝴蝶兰叶片REC 与MDA含量的影响Fig.2 The effect of cold stress on the REC and MDA content in the leaves of P.amabilis
2.4 低温对2 个蝴蝶兰品种抗氧化酶活性的影响
SOD、CAT 和POD 是植物体内主要的抗氧化酶,会及时清除过剩的活性氧使其在植物体内维持一个动态平衡[16]。由图3 可知,低温胁迫显著增强了‘绿熊’与‘安娜’叶片的POD、CAT、SOD 活性,并随着处理时间延长上升趋势十分显著(P<0.05)。随着低温时间的增加,‘绿熊’叶片的POD 酶活性逐渐上升,但在在处理12 h和24 h 差异不显著,低温处理48 h 时达最大值;‘绿熊’叶片的CAT 和SOD 酶活性随着处理时间的延长呈上升趋势十分显著(P<0.05),并且在48 h 时达最大值,且显著高于在相同处理时间的‘安娜’叶片的CAT、SOD 酶活性(P<0.05)。‘安娜’叶片的POD、CAT、SOD 酶活性随低温时间的增加而显著升高(P<0.05),并在低温处理至48 h 时达最大值;但CAT 酶活性在处理24 h和48 h 时差异不显著。
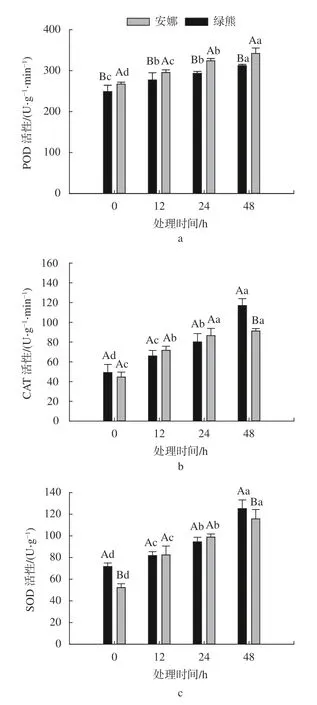
图3 低温胁迫对蝴蝶兰叶片POD、CAT 和SOD 活性的影响Fig.3 The effect of cold stress on the POD,CAT and SOD enzyme activity in the leaves of P.amabilis
2.5 低温对2 个蝴蝶兰对渗透调节物质含量的影响
由图4 可知,低温胁迫显著增加了‘绿熊’叶片可溶性糖和可溶性蛋白的含量,且显著高于相同条件下的‘安娜’叶片的含量,并随着处理时间的增加呈显著上升的趋势(P<0.05)。‘绿熊’叶片的可溶性糖含量在处理时间24 h 和48 h时差异不显著,但显著高于0 h(P<0.05),分别是0 h 的135.8%和136.1%。‘绿熊’叶片的脯氨酸含量也随着处理时间的增加逐渐上升,但显著低于‘安娜’叶片在相同处理时间的脯氨酸含量(P<0.05)。‘安娜’的可溶性糖和可溶性蛋白含量随着处理时间的延长增加趋势缓慢;且可溶性糖在处理时间为12、24、48 h 时差异不显著;可溶性蛋白在处理时间24 h 和48 h 时差异不显著,但显著高于0 h(P<0.05)。‘安娜’叶片的脯氨酸含量随着处理时间的延长呈显著上升的趋势(P<0.05),在处理时间48 h 时达最大,是对照组的204.04%。
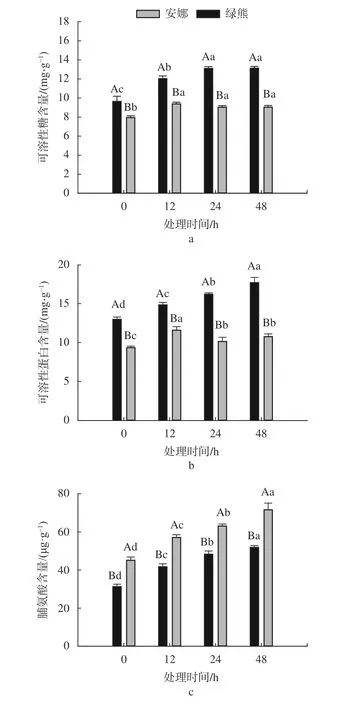
图4 低温胁迫对蝴蝶兰叶片可溶性糖、可溶性蛋白和脯氨酸含量的影响Fig.4 The effect of cold stress on the content of soluble sugar,soluble protein and proline in the leaves of P.amabilis
3 结论与讨论
蝴蝶兰是目前花卉市场上最受广大消费者喜爱的年销花之一,低温是影响其观赏期及品质的重要环境因素之一,且随着蝴蝶兰产业的发展,大量的新品种不断产生,而关于新品种的低温耐受力并未有明确的标准和界定。本研究发现5 ℃的低温胁迫显著影响了蝴蝶兰品种‘绿熊’和‘安娜’的叶片形态,二者均出现了不同的冻害症状。‘安娜’主要表现为叶片发软,并出现大量水渍状冻斑;而‘绿熊’只是部分叶片出现了褪绿条纹和极其轻微的小点冻斑,整体叶片硬度也比‘安娜’要高,这与高冬冬等的研究相似[7]。表明‘绿熊’品种叶片的低温耐受力要优于‘安娜’,说明‘绿熊’蝴蝶兰在低温胁迫下会通过引发一系列生理生化的反应以保持良好健康的叶片形态来缓解极端低温对其造成的伤害。
光合作用制造有机物并提供其他生命活动所需能量,是植物生长发育的基础,而光合参数直观地体现了植物的光合作用水平[17]。本研究发现5 ℃低温胁迫显著降低了‘绿熊’和‘安娜’的Pn、Gs、Ci和Tr,并随着低温时间的延长而逐渐降低。但在处理时间12 h 和24 h 时,‘绿熊’的Pn和Gs与其CK 差异不显著,表明5 ℃低温处理24 h 对‘绿熊’所造成的伤害可以通过其自身的生理生化反应缓解并抵消。而当处理时间延长至48 h 时,‘绿熊’和‘安娜’的Pn、Gs、Tr和Ci均显著低CK,表明二者此时的Pn均受到了气孔因素的限制。而且因为‘安娜’的Ci在5 ℃低温处理24 h 和48 h 时差异不显著,且‘安娜’Pn的下降幅度远高于‘绿熊’,表明此时‘安娜’蝴蝶兰的Pn可能不仅受到了气孔因素的限制,而且还包含非气孔因素的影响,与郝平安对其品种他蝴蝶兰研究结果相似,表明此时极端低温已经对安娜的光合器官和光合系统等造成了损伤[18]。
渗透调节是植物适应逆境的重要生理机制,其主要依赖植物细胞的渗透膜,因而植物细胞膜的透性和完整性也是植物耐低温能力的一个重要体现[19]。本研究发现5 ℃低温显著增加了‘绿熊’和‘安娜’叶片的REC 和MDA 含量,并随着低温时间的延长而显著增加,与郝平安[18]在其他蝴蝶兰品种的研究相似,表明2 种蝴蝶兰在低温条件下通过调节生物膜的渗透性维持细胞膨压,促使其在低温胁迫时保持细胞内的生理生化活动正常进行。而‘安娜’叶片MDA 含量在5 ℃处理48 h 时的显著增加也表明此时其叶片的生物膜受到了低温损伤,并发生了膜脂过氧化现象。植物在逆境条件下会产生大量活性氧(ROS),直接或间接地对植物细胞造成氧化伤害,本研究中,‘绿熊’和‘安娜’叶片SOD、CAT 和POD活性随着5 ℃低温处理时间的延长显著增加,说明二种蝴蝶兰均通过增强SOD、CAT 和POD的抗氧化酶以清除低温胁迫引起的过剩活性氧,避免活性氧堆积造成的氧化损伤,维持细胞内环境的稳定,与杨为海等的研究结果一致[20]。
脯氨酸在植物体内经常作为活性氧的清除剂和渗透调节物质发挥作用[21]。5 ℃处理显著增加了‘绿熊’和‘安娜’体内的脯氨酸含量,并随着处理时间的延长显著增加,可能是叶片在低温胁迫过程中通过增加脯氨酸的含量防止组织脱水,缓解低温对植株造成的伤害。可溶性蛋白和可溶性糖含量的升高也为植物渗透调节提供物质和能量基础,帮助植物抵御低温伤害[22]。随着低温时间的增加,‘绿熊’的可溶性糖和可溶性蛋白积累量显著升高,并大幅度高于‘安娜’,表明‘绿熊’进行了蛋白质小分子的合成和糖分的积累以助于植株抵御低温伤害,也是‘绿熊’的低温抵抗力优于‘安娜’的另一重要体现。
