重组酶介导等温核酸扩增技术检测伯氏疏螺旋体方法的建立
2021-07-07马晓菁谢彩云刘丽娅谷文喜易新萍
马晓菁 , 谢彩云 , 刘丽娅 , 叶 锋 , 谷文喜 , 钟 旗 , 易新萍
(新疆畜牧科学院兽医研究所 , 新疆 乌鲁木齐 830011)
伯氏疏螺旋体(Borreliaburgdorferi,B.burgdorferi)属螺旋体科(Spirochaetaceae)疏螺旋体属(Borrelia),是莱姆病(Lyme disease)的病原体。莱姆病呈世界性分布,主要通过携带病原体的蜱虫叮咬传播,至少有30多个国家报告有莱姆病的存在,且发病区域和发病率呈上升趋势[1]。我国于1986—1987年在黑龙江省海林县首次从病原学上证实莱姆病的存在[2]。全国已经有19个省、市、自治区确定存在莱姆病的自然疫源地[3]。目前我国莱姆病新发病例高达2万余例,且发病率和发病人数呈上升趋势[4]。莱姆病主要的诊断方法包括病原体检测、免疫学检测以及分子生物技术检测。其中伯氏疏螺旋体的获得为莱姆病的诊断提供确凿证据,但在临床样本中伯氏疏螺旋体数目稀少,且培养周期较长,使其检测在临床中应用受到限制[5]。同时由于伯氏疏螺旋体抗原成分的复杂性,以及各亚种之间存在抗原差异,使得莱姆病的免疫学诊断受到了挑战[6]。莱姆病分子水平的检测主要以PCR技术为基础,巢氏PCR和实时荧光定量PCR技术较为广泛的应用于伯氏疏螺旋体的检测[7-8]。重组酶介导等温核酸扩增(Recombinase aided amplification,RAA)技术,利用来自于大肠杆菌的 recA 重组酶替代PCR高温解链,在单链 DNA 结合酶(Single-stranded DNA binding,SSB)和DNA聚合酶的共同作用下使DNA 片段在体外快速地扩增[9]。与常规的PCR技术相比,RAA技术不需要专业的PCR仪,反应温度低,反应速度快。本研究选取伯氏疏螺旋体16S rRNA基因保守序列设计引物,采用RAA技术电泳法,旨在为伯氏疏螺旋体检测提供了一种简便、快速的手段。
1 材料与方法
1.1 菌株 伯氏疏螺旋体B31标准株(ATCC35210)、大肠杆菌标准株(CVCC1531)、沙门菌标准株(CVCC3762)、钩端螺旋体标准株(DSM21-537),均由新疆畜牧科学院兽医研究所保存。
1.2 主要试剂 细菌基因组DNA提取试剂盒,购自天根生化科技有限公司;DNA marker,购自北京庄盟国际生物基因有限公司;RAA 核酸扩增试剂盒(电泳法),购自江苏奇天基因生物科技有限公司。
1.3 细菌基因组DNA提取 按照TIANamp Bactieria DNA Kid说明书分别提取伯氏疏螺旋体标准株B31、大肠杆菌标准株、沙门菌标准株以及钩端螺旋体标准株基因组DNA,-20 ℃ 保存备用。
1.4 引物设计 根据伯氏疏螺旋体16S rRNA基因保守序列设计并合成特异性RAA引物,见表1,引物由昆泰锐生物技术有限责任公司合成。

表1 伯氏疏螺旋体RAA(电泳法)引物Table 1 RAA(electrophoresis assay) primers of Borrelia burgdorferi
1.5 RAA扩增体系及条件 在1.5 mL离心管中配制反应体系(表2),溶液涡旋混匀并离心,将混合好的上述溶液加入到装有冻干粉的基础反应单元反应管中,向每个反应管中加入2.5 μL乙酸镁溶液并混合均匀。将反应管放置在37 ℃水浴40 min,反应结束后,每个反应管中加入50 μL酚/氯仿(1∶1),震荡混匀,12 000 r/min离心1 min,取10 μL上层溶液进行2%琼脂糖凝胶电泳。

表2 RAA(电泳法)扩增体系Table 2 The amplification system of RAA(electrophoresis assay)
1.6 RAA特异性 分别以伯氏疏螺旋体B31、大肠杆菌、沙门菌以及钩端螺旋体基因组DNA为模板,按照RAA试剂盒配制反应体系,37 ℃水浴40 min。 反应结束后,每个反应管中加入50 μL酚/氯仿(1∶1),震荡混匀,12 000 r/min离心1 min,取10 μL上层溶液进行2%琼脂糖凝胶电泳,观察结果。
1.7 RAA敏感性 10倍系列稀释1 ng/μL伯氏疏螺旋体标准株B31基因组DNA,分别以浓度为1、0.1、10-3、10-4、10-5、10-6ng/μL和10-7ng/μL伯氏疏螺旋体标准株B31基因组DNA为模板,按照RAA试剂盒配制反应体系,37 ℃水浴40 min。反应结束后,每个反应管中加入50 μL酚/氯仿(1∶1),震荡混匀,12 000 r/min 离心1 min,取10 μL上层溶液进行2%琼脂糖凝胶电泳,观察结果。
2 结果
2.1 RAA特异性分析 以伯氏疏螺旋体B31、大肠杆菌、沙门菌及钩端螺旋体基因组DNA为模板,RAA产物经2%琼脂糖凝胶电泳,观察结果。结果可见,阳性质控品扩增出419 bp目的片段,伯氏疏螺旋体B31获得152 bp条带,与目的片段一致,大肠杆菌、沙门菌以及钩端螺旋体均未扩增出目的条带(图1),表明该方法具有良好的特异性。
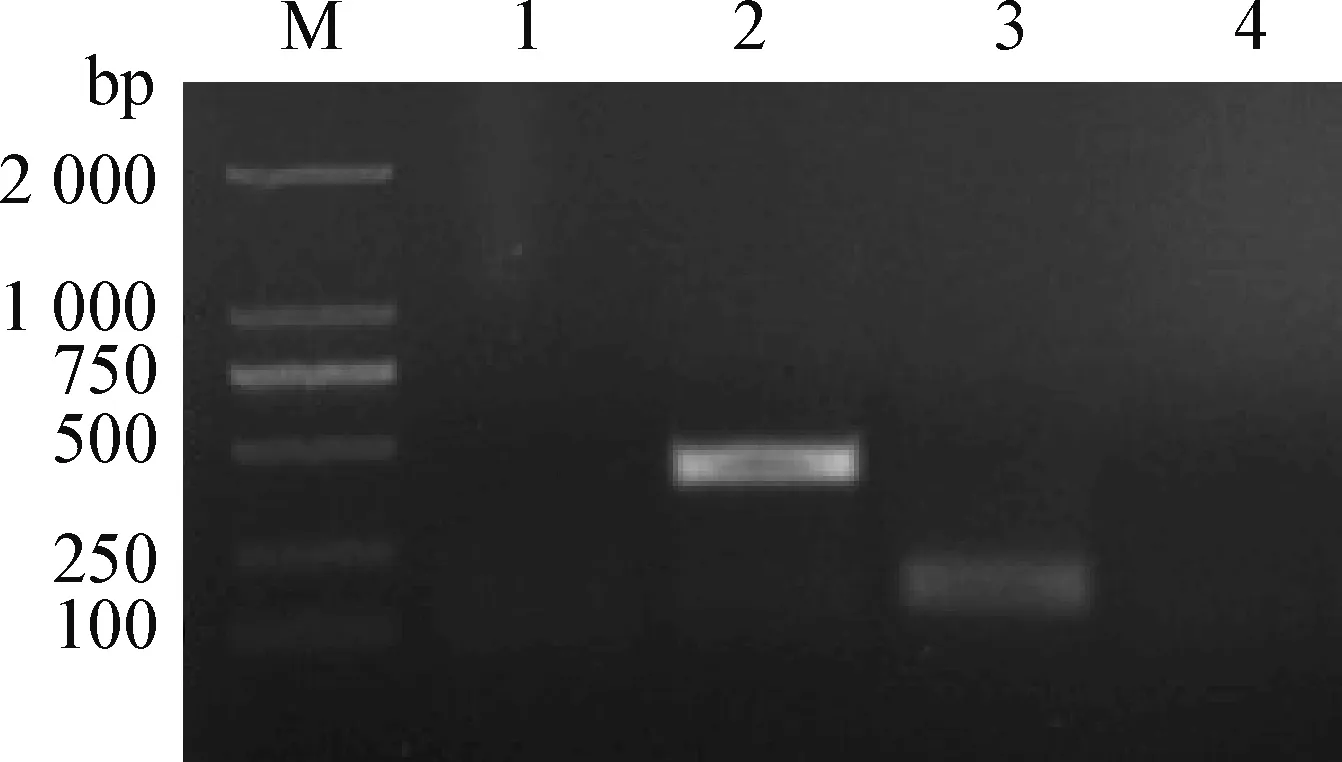
图1 伯氏疏螺旋体RAA特异性结果Fig.1 The specificity results of Borrelia burgdorferi by RAAM:DNA标准分子量 DL2 000; 1:钩端螺旋体基因组DNA(DSM21537); 2:RAA阳性质控品; 3:伯氏疏螺旋体B31基因组DNA; 4:大肠杆菌基因组DNA(CVCC1531)M:DNA marker DL2 000; 1:Genomic DNA of Leptospira(DSM21537); 2:Positive quality control of RAA; 3: B31Genomic DNA of Borrelia burgdorferi; 4:Genomic DNA of E.coli(CVCC1531)
2.2 RAA敏感性确定 将1 ng/μL伯氏疏螺旋体B31基因组DNA 10倍系列稀释,RAA产物经2%琼脂糖凝胶电泳后观察结果。结果可见,浓度为0.1 ng/μL、0.01 ng/μL、1pg/μL和0.1pg/μL可扩增出与目的片段一致的条带,其余稀释度未扩增出目的条带(图2),伯氏疏螺旋体RAA电泳法最低检出模板DNA浓度为100 fg/μL。
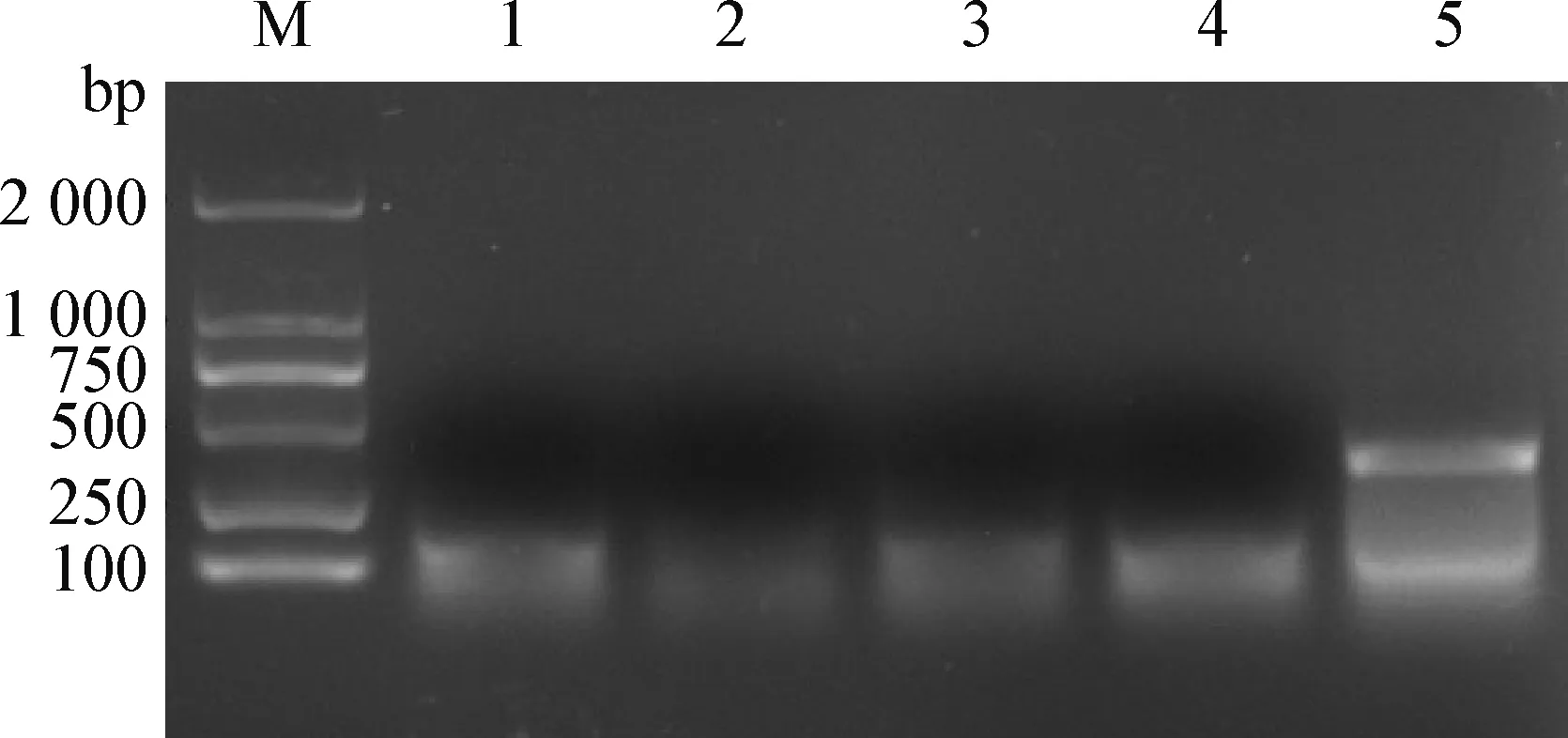
图2 伯氏疏螺旋体RAA敏感性结果Fig.2 The sensitivity results of Borrelia burgdorferi by RAAM:DNA标准分子量 DL2 000; 1:伯氏疏螺旋体B31基因组DNA;2:0.01 pg/μL伯氏疏螺旋体B31基因组DNA; 3:0.1 pg/μL伯氏疏螺旋体B31基因组DNA; 4:1 pg/μL伯氏疏螺旋体B31基因组DNA; 5:RAA阳性质控品M:DNA marker DL2 000; 1: B31 genomic DNA of Borrelia burgdorferi; 2:0.01 pg/μL B31 genomic DNA of Borrelia burgdorferi; 3:0.1 pg/μL B31 genomic DNA of Borrelia burgdorferi; 4:1 pg/μL B31 genomic DNA of Borrelia burgdorferi; 5:Positive quality control of RAA
3 讨论
莱姆病是伯氏疏螺旋体引起的一种人兽自然疫源性人兽共患病。人感染莱姆病严重者可造成终生残疾,甚至死亡[10]。动物被携带病原体的蜱虫叮咬后,可出现关节肿大、脑炎等一系列临床症状。因此,莱姆病不仅对人类公共安全造成危害,也严重影响畜牧业发展。从不同样本中分离得到伯氏疏螺旋体,为莱姆病确诊提供有力证据。但伯氏疏螺旋体分离培养耗时、阳性率低,因此临床诊断应用较少。目前莱姆病免疫学检测常用方法包括间接免疫荧光(IFA)、酶联免疫吸附试验(ELISA)以及免疫印迹和免疫酶染色法等。但IFA只能检测到菌体表面蛋白,因此灵敏度和特异性较低,易造成假阳性或假阴性,已逐步被酶联免疫试验代替。ELISA方法虽广泛应用于莱姆病的检测,但抗原存在变异,且全细胞抗原缺乏种族特异性[11],降低了该方法的特异性,易误诊。免疫印迹法具有较高的特异性,但操作复杂[12]。
随着聚合链反应(Polymerase chain reaction,PCR)技术不断完善,伯氏疏螺旋体分子水平的检测主要以PCR技术应用最为广泛,该方法具有敏感、特异以及操作简便等优点,但是核酸的扩增依赖不断变化的温度,需要专业的仪器,限制了该方法在基层推广以及现场检测的应用。20世纪90年代起无需热变性的核酸恒温扩增技术不断发展,其中重组酶介导等温核酸扩增(RAA)技术是近年来常温核酸扩增的创新技术,该技术采用recA重组酶与DNA紧密结合,并与引物形成聚合体扫描双链DNA,在与引物同源的序列处使双链DNA解旋,在SSB和DNA聚合酶共同作用下,新的DNA片段可以在体外快速地扩增出来[11]。RAA引物设计简单,扩增过程不需要高温解旋DNA,目的片段可在短时间内获得指数级积累。目前RAA技术应用广泛,张小平等[13]利用RAA技术建立沙门菌快速检测方法;周冬根等[14]建立中东呼吸综合征冠状病毒RAA检测方法。
本研究以伯氏疏螺旋体16S rRNA基因保守序列设计RAA引物,等温扩增仅伯氏疏螺旋体获得目的片段,该方法具有良好的特异性。在对不同浓度伯氏疏螺旋体标准株B31基因组DNA扩增后,最小检出浓度为100 fg/μL。该方法的建立与传统的PCR方法相比具有较好的特异性以及敏感性,扩增过程不需要PCR仪,且反应时间大大缩短。为今后莱姆病快速诊断提供一种简便、可靠的手段。
