近70年来太湖水体磷浓度变化特征及未来控制策略*
2021-07-07朱广伟秦伯强张运林朱梦圆张毅博
朱广伟,秦伯强,张运林,李 渊,朱梦圆,许 海,张毅博
(1:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,太湖湖泊生态系统研究站,南京 210008)(2:浙江工商大学旅游与城乡规划学院,杭州 310018)
磷是自然湖泊及水库中影响水体营养状态及浮游植物生产力的最主要营养元素[1],是湖泊生态环境保护中最关注的元素[2].我国生态环境部每年发布的《中国生态环境状况公报》中,关于湖泊(水库)的水环境问题部分,磷是最常见的污染指标.湖泊与水库中磷浓度及其变化,既受人类活动污染状况的影响,也受湖泊流域自然地球化学过程及湖体生态系统结构及变化的影响.揭示湖泊和水库中磷的浓度变化特征及驱动机制,是制定相关水体磷控制目标及削减策略的前提.
浅水湖泊是目前我国磷浓度控制、达标管理的难点,湖泊的营养本底及湖沼学自然过程是影响治理难度的重要因素.浅水湖泊中底泥动力悬浮过程频繁,颗粒磷沉降这一水体磷自净方式在浅水湖泊中大为减弱[3],湖泊水体磷浓度对外源削减的响应迟钝[4].羊向东等利用古湖沼学技术,推断太白湖等长江中下游地区湖泊的总磷(TP)本底为0.05 mg/L[5].生态环境部2020年12月30日发布的《湖泊营养盐基准——中东部湖区(总磷、总氮、叶绿素a)(2020年版)》,确定该区域湖泊TP的基准为0.029 mg/L.这意味着,该区域湖泊即使未受任何人为污染,依据GB 3838-2002中关于湖库水质分类的TP浓度限值,水体TP浓度已经处于Ⅲ类(>0.025 mg/L)~Ⅳ类(>0.050 mg/L)状态.叠加了强烈的人类活动因素后,该区域部分湖泊的TP控制目标设定为Ⅲ类水,极具挑战.气候波动将引发湖泊生态系统的磷平衡发生变化,也是湖泊TP浓度波动的自然驱动力之一.近年来,我国多个浅水湖泊治理中出现TP浓度“反弹”的现象,如2017年太湖水体TP浓度升高[6-7],2019年龙感湖、黄大湖、泊湖等长江中下游湖泊水体TP浓度升高[8-9],也成为许多浅水湖泊控磷目标实现困难的重要成因.因此,弄清湖泊水体磷浓度变化的驱动因素,区分自然波动与人为污染的贡献,对湖泊水质目标的科学设定意义重大.
太湖是我国最早开展水体磷浓度观测记录的湖泊之一.从1949年10月,中国科学院水生生物研究所的朱樹屏、杨光圻先生就开始对太湖北部的五里湖和梅梁湾进行为期1年的逐月磷浓度观测[10],至今已有70余年.1960年夏(6月15日-8月25日),中国科学院南京地理所组织队伍对全太湖135个点进行采样调查,测定水体磷浓度[11].1980-1981年,江苏省科委设置“太湖环境质量评价”项目,调查了太湖水面50个样点及环湖9条河道的水体磷浓度[12].1987年5月-1988年3月,国家“七五”攻关课题“太湖主要入湖污染及其控制研究”在太湖布设39个采样点,开展了5次水体磷浓度采样调查[13].自1991年10月以来,中国科学院太湖湖泊生态系统研究站(TLLER)开始按照中国生态系统研究网络(CERN)的观测规范,在太湖布设固定点位实施逐月水体磷浓度监测,观测记录持续至今[14].从70年来的调查结果看,太湖水体磷浓度在早期就存在较大的时空差异.比如1949年调查时,五里湖水体年均磷酸盐浓度为0.022 mg/L,但最高月份已达0.154 mg/L[10].1960年夏天调查时,多数湖区水体磷酸盐浓度低于0.02 mg/L,但东太湖部分水域已达0.28 mg/L[11].
太湖、巢湖、滇池等湖泊的富营养化治理已近40年.目前包括这“三湖”在内,许多湖泊的磷控制依然未能达到预期的治理规划目标.系统回顾这些湖泊水体磷浓度的长期变化特征,探寻影响大型浅水湖泊水体磷浓度变化的驱动因素,将为下一步我国湖泊富营养化控制目标与方案制定提供借鉴.本文试图通过回顾分析太湖70年来水体磷浓度的变化特征,特别是分析主要时段水体磷浓度的月变化过程、颗粒态与溶解态比例变化,以及不同年代的空间变化,刻画浅水湖泊水体磷浓度的波动强度,解析影响浅水湖泊水体磷浓度变化的驱动因素,为类似大型浅水湖泊磷浓度控制及生态保护策略的制定提供借鉴.
1 材料与方法
1.1 数据来源及其监测点位
本文采用的磷数据,监测资料来源于7个阶段,各阶段水面点位的布设见图1.其中,1949年10月-1950年10月,朱樹屏等布设了2个点位,分别位于五里湖及梅梁湾的梅园[10],即图1中的TH09及TH00.1960年夏天进行太湖资源调查时,布设湖体调查点位共计135个,选择其中代表性的点位7个[11].1980-1981年调查时,共布设湖体调查点位50个[12].1987年5月-1988年3月,湖体布设水质调查点37个[13](图1).1991年TLLER按CERN规范观测后,观测点位也经过了3次调整:1991-1996年,在太湖布设10个采样点,即图1中的TH00~TH09;1997-2004年增加4个出入湖河口,即TH10~TH13;2005年起,监测点增加到32个,去掉了TH02,新增19个点,即图1中的TH00~TH32.32个监测点位中,逐月监测点14个,即TH00、TH01、TH03~TH08、TH10、TH13~TH14、TH16~TH17、TH32,其余点位为季度采样,分别于2、5、8和11月采样[14].
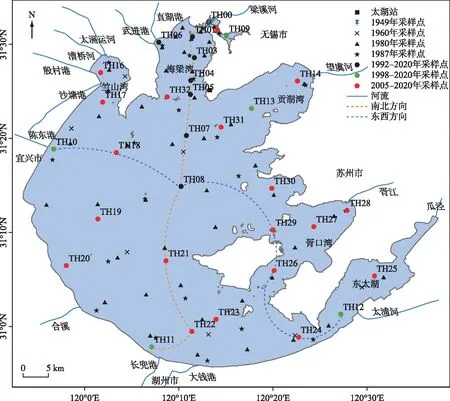
图1 各时期太湖水体磷浓度调查点位
采样方法上,1949年朱樹屏等调查时,采集表层和底层2层水样分别测定[10],本文所用结果为其表层、底层平均值.1960、1981及1987年的调查,报告中未明确采样深度,推断为表层样.1991-2004年TLLER调查中均为表层水体采样.2005年以后TLLER调查时,每个点位采集表层(水下0.2 m)、中层(水深的一半深度,一般为1.0~1.5 m左右)、底层(底泥上0.2 m)3层水样进行混合后,取样分析[14].据2003年7月在太湖梅梁湾2.4 m水深水域进行为期1周的水柱磷浓度分层监测(共分5层),水柱TP、溶解性总磷(TDP)、溶解性反应活性磷(DRP)的平均浓度分别为0.097、0.050、0.007 mg/L,而同时表层0.2 m深度分别为0.098、0.051、0.008 mg/L[15],表明在太湖的开敞水域,水柱磷浓度垂向分布大致均匀,表层采样与水柱分层混合采样的结果具有可比性.
1.2 水体磷形态及相关指标测定方法
TLLER进行的水体TP、TDP浓度测定方法分别为过硫酸钾氧化、钼锑抗显色分光光度法(GB 11893-1989),测定波长为700 nm(岛津UV-2450型分光光度计),该方法较早由日本学者Junko Ebina等提出[16].其中,TP与TDP测定区别在于是否进行水样过滤.滤膜一般为孔径1.2 μm的GF/C滤膜(英国Waterman公司).TP测定时,水样完全混合,包括水体中不易沉淀的悬浮颗粒态及生物体等,与过硫酸钾氧化剂溶液混合后在灭菌锅中全部氧化分解,取上清液钼-锑-抗显色测定水体TP浓度.而滤后液氧化分解、显色测定的则为TDP.此外,对于滤后液不进行碱性过硫酸钾氧化分解而直接进行钼-锑-抗显色,所获得的是水体中易于表现出磷酸根化学活性的部分磷,即DRP.
1949-1950年、1960年及1981-1982年调查时,测定指标为磷酸盐,也是采用水体中直接添加钼酸铵、抗坏血酸试剂形成蓝色的磷钼杂多酸,立即用分光光度计比色测定.该方法与目前使用的GB 11893-1989中的方法基本一致,但未采用碱性过硫酸钾试剂氧化分解,也未进行过滤,直接进行酸性钼-锑-抗显色[17],包括了部分颗粒态磷转化为磷酸根的部分磷.尽管其测定结果表达为磷酸根磷,但其浓度应高于DRP,更接近TDP.因此,在后文的对比分析中,将这3个时段测定的磷浓度作为TDP进行分析.
水体透明度(SD)的测定采用直径为25 cm的黑白盘现场测定.水体悬浮颗粒物(SS)浓度的测定采用GF/C滤膜过滤、103~105℃烘干法获得.水体浮游植物叶绿素a(Chl.a)测定时,过滤滤膜为孔径0.5 μm的醋酸纤维滤膜,或孔径约为0.7 μm的GF/F玻璃纤维滤膜(Whatman公司),将藻类细胞截留在滤膜上,然后将滤膜冷冻、研磨使细胞破裂,热乙醇提取其中的色素,定容后分光光度法测定Chl.a浓度[18].
1.3 数据统计方法
数据的统计及绘图主要采用Office Excel软件完成,SS与各形态磷、Chl.a与各形态磷的关系拟合用Origin 2018软件完成.在对2005年以来水体TP浓度分析时,进行了异常值剔除,即对高于多年平均值3倍误差以上的数据进行剔除.2005-2020年的全湖3840个总磷测定平均值为0.135 mg/L,相对误差为0.153 mg/L,均值加上3倍误差值为0.596 mg/L.为此,将浓度高于0.596 mg/L以上的数据,共计31套剔除.这些数据大多是5-9月的水华高发季节某些严重水华堆积点位的样品数据,代表性较差.
2 结果
2.1 太湖水体TP及TDP历史变化特征
以记录相对完整的太湖五里湖TH09点位、梅梁湾梁溪河口的TH00点位及太湖湖心的TH08点位为例,1991-2020年水体TP浓度的逐月变化特征,如图2所示.

图2 太湖典型监测点水体TP浓度月变化
月间水体浓度波动较大是太湖水体TP的基本特征.以TH00为例,TP浓度最小值为0.031 mg/L,最大值为0.824 mg/L,均值为0.207 mg/L,误差值为0.141 mg/L,这还不包括2005年之后剔出的31个异常值.对于湖心区的TH08,波动性明显小于河口区的TH00,TP浓度最小值为0.014 mg/L,最大值为0.359 mg/L,平均值为0.090 mg/L,总体误差值为0.049 mg/L.而位于五里湖的TH09,TP浓度最小值为0.005 mg/L,最大值为0.302 mg/L,平均值为0.122 mg/L,误差值为0.062 mg/L.3个点位的相对误差分别为68%、54%及51%,均超过了50%以上,表明在太湖大部分水域中,水体TP浓度一年中均存在较大的波动性.
长期来看,在年内TP浓度存在一定波动性的背景下,3个点位的水体TP浓度也具有一定的规律性.TH00、TH09两个靠近无锡市区的点位,年内波动性和年均浓度都呈现了明显的下降,这又反映出无锡市磷污染治理等流域人类活动变化的影响力.以五里湖的TH09为例,2003年启动了国家863项目“重污染水体底泥环保疏浚与生态重建技术”[19],对五里湖(又称为“蠡湖”)进行了系统的退渔还湖、面源治理及生态修复,外源磷入湖负荷大幅度削减,水体TP浓度发生了明显的突变:1991-2002年的TP浓度平均值为0.140 mg/L(范围为0.005~0.302 mg/L,n=54),误差值为0.081 mg/L,相对误差为58%.而2003-2020年的TP浓度平均值为0.111 mg/L(范围为0.034~0.283 mg/L,n=86),误差为0.043 mg/L,相对误差为39%,平均浓度及波动性均明显下降.处于梁溪河口的TH00点位,在2007年无锡水危机发生之后,启动了渎山泵站排水工程,使得梁溪河从一个入湖河道变成一个出湖河道,梅梁湾最大的磷外源被切断,该点位的水体TP浓度也发生巨大变化.1991年-2007年5月,TH00点位的水体TP浓度平均值为0.266 mg/L(范围为0.032~0.824 mg/L,n=189),误差为0.137 mg/L,而2007年6月-2020年12月,该点的TP浓度均值下降为0.138 mg/L(范围为0.031~0.681 mg/L,n=161),误差为0.112 mg/L,均值下降了58%.此外,在2007年之前,该点的极大值均发生在11月至次年3月的非水华季,枯水季节的低水位及梁溪河入湖污染对该点的磷波动起主导的作用,呈现典型的外源控制特征.而2007年开始,该点TP浓度超过0.4 mg/L的高值均发生在5-9月的水华季,蓝藻水华物质的河口堆积成为该点磷浓度异常的主导因子,呈现典型的内源控制特征.
位于湖心区的TH08点位,受河道入湖过程及蓝藻水华堆积等偶然因素的影响概率大为减少,总体TP浓度的波动性显著小于滨岸带点位.TH08点位TP浓度月监测值的多年误差明显小于TH00及TH09,多年均值为0.090 mg/L,浓度范围为0.014~0.359 mg/L(n=349).值得关注的是,2017年之后该点的TP波动性明显增大.在2017年以前,该点的TP浓度均值为0.082 mg/L(范围为0.014~0.216 mg/L,n=301),误差为0.039 mg/L,而2017-2020年,该点的TP浓度均值增至0.140 mg/L(范围为0.050~0.359 mg/L,n= 48),误差增加到0.076 mg/L,与2017年之后太湖湖心区的蓝藻水华问题加剧有关[6].此外,2007年之后,由于梅梁湾的入湖污染基本得到控制,梁溪河基本成了排水河道,空间上呈现贡湖湾、湖心区向梅梁湾补给水量的水文特征,湖心区与梅梁湾的TP浓度逐渐均一化.这在TH08与TH00的TP月度变化曲线在2007年之后趋于一致的现象中可以得到验证.
由于去掉了颗粒态磷,太湖TDP浓度的时空波动性明显小于TP,但仍表现出较大的季节和空间差异,如图3所示.TDP存在较高年内波动性的现象,在1949-1950年的调查中已经存在.1949年10月-1950年10月的13次调查中,梅梁湾TH00附近水域的TDP浓度(未过滤样的磷酸根浓度)均值为0.020 mg/L[10],水柱平均最大值为0.060 mg/L,误差值为0.018 mg/L,相对误差达到90%.而当时五里湖的TDP浓度均值为0.022 mg/L,水柱平均最大值为0.085 mg/L,相对误差则为100%.在1991-2007年期间TH00点位TDP变幅相对更大.而湖心区的TH08点位,2007年后TDP年内变幅也呈现增大的现象,这与TP反映的近年来磷均值及波动性增高的现象一致.

图3 太湖典型监测点水体TDP浓度月变化
1960年夏天调查时太湖水体磷酸盐浓度依然呈现较大的时空差异性.调查表明夏季太湖水体磷酸根浓度一般在0.01~0.05 mg/L之间,但最大值可达0.28 mg/L.其中东太湖及马山南较高,达0.16~0.25 mg/L,其他地区均在0.02 mg/L左右[11].1981-1982年调查时,全湖50个点位,水体可溶性磷酸盐浓度介于0.020~ 0.055 mg/L之间,平均值为0.036 mg/L,湖心平均值为0.034 mg/L,入湖河道平均值为0.057 mg/L,平均值较1960年有明显的增加[12],但空间差异性减小.1987年5、7、9、12月及1988年3月调查时,全湖TP浓度平均值分别为0.036、0.025、0.013、0.068、0.114 mg/L,就月均值而言,同样表现出较大波动性,而每个月的全湖不同样点之间,也存在较大的差异,如5次调查的全湖TP浓度范围分别为0~0.13、0~0.18、0~0.053、0~0.608及0.037~0.485 mg/L[13].
与TP的波动性特征一致,TH00点位的TDP在1991-1996年变幅很大(图3b),均值为0.095 mg/L(n=55),相对误差达65%,而且月与月之间的浓度值跳跃性大, 反映出城市排污河道梁溪河污染状况及其入湖排放对太湖水体TDP的冲击.同期湖心区TH08点位TDP浓度均值为0.018 mg/L(n=47),误差为0.011 mg/L,波动性明显小于TH00点位,且与TH00点位的低值浓度相当.
与TP类似,在2007年之前,河口区TH00点位的TDP浓度波动较大,2003年前五里湖TH09点位的TDP浓度也波动较大,后期3个点位的波动变化趋于一致.2001-2007年5月,TH00的TDP浓度均值为0.100 mg/L(n=73),误差为0.043 mg/L,之后均值为0.041 mg/L(n=163),误差为0.028 mg/L.TH09在2003年之前均值为0.057 mg/L,误差为0.024 mg/L;之后为0.042 mg/L,误差为0.027 mg/L.TH08在2007年5月之前的均值为0.017 mg/L(n=72),误差为0.011 mg/L,而之后则均值为0.033 mg/L(n=163),误差为0.020 mg/L,均值及波动性的增幅均接近50%.然而,与TP情况不同的是,TH08点位TDP的峰值出现在大多在非水华季节的10月至次年4月.2001-2020年共出现了24次TDP浓度超过0.050 mg/L的情况,其中20次发生在非水华高发季(5-9月),包括10月份出现5次,3月份出现5次,2月份出现4次,1月份出现2次,4月2次,11月及12月各1次.非水华高发季的枯水期出现TDP的峰值,表明此时外源污染的影响较大.
2.2 太湖水体磷浓度年变化趋势
2005年以来,在太湖水体磷监测比较统一的情况下,根据北太湖14个点逐月监测值及全太湖32个点逐季度监测值,分别计算出北太湖、全太湖水体各形态磷浓度的数学平均值,如图4.从图上可以看出,2005-2020年间,北太湖与全太湖的TP、TDP及DRP年均值之间具有较好的一致性,北太湖始终高于全太湖.其中,北太湖TP平均值为0.147 mg/L,全太湖平均值为0.112 mg/L,北太湖较全太湖高出31%;北太湖TDP平均值为0.051 mg/L,全太湖为0.035 mg/L,北太湖较全太湖高出46%;北太湖DRP平均值为0.024 mg/L,全太湖为0.015 mg/L,北太湖较全太湖高出60%.北太湖与全太湖年均TP浓度之间的相关系数达0.83(n=16),TDP浓度之间的相关系数为0.82,DRP浓度之间的相关系数为0.83,这说明即使太湖的水体磷浓度波动性较大,但是大量的调查结果之间是具有一定的可比性的.

图4 北太湖及全太湖年均TP、TDP及DRP浓度年变化(N表示北太湖,W表示全太湖)
即便是从全湖年均值来看,年际之间的波动性仍较大,难以仅从外源污染负荷变化来解释.2005-2020年的16年中,全太湖TP年均最小值为0.086 mg/L(2010年),最大值为0.135 mg/L(2006年),2010年较2006年4年内降幅超过36%,难以仅从流域面源污染控制的方面完全解释,因为外源污染削减是个逐渐变化的过程.2010年之后的变化也证明了其下降过程并不是个持续的过程.2010年的极低值出现很可能伴随了湖体生态系统变化等非外源因素.即使是相对稳定的TDP,年均值的最小值为0.023 mg/L(2005年),最大值为0.047 mg/L(2008年),相差了1倍.这种波动表明人类活动因素以外的自然因素对太湖磷浓度的影响是相当明显的.
从年均值的多年变化来看,有2个现象值得关注.第一,总体上全湖TP年均值与TDP之间的变化趋势较为一致,但是2007年、2017年明显呈相反的变化.这与2007及2017年特殊的蓝藻水华情势有关[6-7].第二,太湖水体中DRP浓度有增高的趋势,特别是北太湖的增高趋势更明显些,即使是在TP浓度较高的2010-2014年间,DRP浓度没有明显下降.由于DRP是水体中与藻类生长关系最密切的磷形态,这一问题值得关注.
梁溪河泵站的启用,通过改变河道外源污染负荷变化,显著影响了TP、TDP的季节变化特征.TP、TDP在5-9月的水华高发季与非水华高发季的差别随着2007年梁溪河调水泵站的启用变化显著(图5).2007年梁溪河调水泵站启动之前,梁溪河口TH00点位非水华高发季(10月-次年4月)的水体TP浓度(TH00-NB)总体高于水华高发季(TH00-B).调水之后,非水华季的浓度大幅度下降,甚至低于湖心区的TH08点位.对于TDP而言,尽管变化不如TP明显,但是也明显受到影响.

图5 太湖水华高发季(B)与非水华高发季(NB)水体TP及TDP浓度变化对比
对于湖心区的TH08点位而言,总体而言是非水华季TP高于水华季,但是2017、2019及2020年的藻情相对严重年,水华季的TP浓度明显高于非水华季,呈现较为反常的现象.而对于TDP而言,2017-2020年水华季均显著高于非水华季,这与该区域近年来藻情的变化联系密切.
2.3 太湖水体磷浓度空间变化
太湖水面面积2338 km2,出入流复杂,往复流频繁,湖泊水质与周边入湖河道水质关系密切,因此太湖水质在空间上具有较大的差异性.此外,太湖不同湖湾水深不同,风浪扰动强度不同,发育的水生植被不同,水质差异较大.从图4可以看出太湖不同湖区的磷浓度差异是巨大的.而这种差异主要由人类活动引起的外源污染负荷在过去的30年中不断变化引起的.
图6是不同时期太湖自北向南水体TP浓度的差别.从图可以看出,1991-1992年,外源污染还比较局限与河口区,从梁溪河口的TH00到梅梁湾三山岛的TH01点,TP浓度迅速下降.但是1993-1997年,梅梁湾外源污染较重,自梁溪河口至湖心区的TH08,呈现TP浓度不断下降的趋势.而1998-2003年的磷污染有明显的减轻, 除TH00点位高于1993-1997年均值外,其余各点均低于1993-1997年均值,意味着1998年太湖“零点行动”等流域点源污染治理发挥了作用.
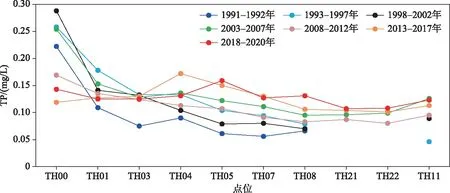
图6 不同时期太湖水体TP浓度自北向南变化特征
太湖水体自北向南的TP变化梯度自2008年以后变化更明显:整条曲线呈现扁平化,梅梁湾北部的高值区大幅度下降,而湖心区、南太湖不断升高.特别是2018年以来,梅梁湾内的5个点平均值为0.137 mg/L,湖心区TH07、TH08的均值为0.129 mg/L,而南太湖苕溪入口的小梅口为0.123 mg/L,呈现自北而南全太湖磷浓度均质化的特征.这与太湖出入流变化导致的空间浓度场相对更加均一有关,包括望虞河引水与梁溪河泵站出水形成的流场变化等,以及整体北太湖来水量增加等因素[20].
同样,太湖水体磷浓度自西向东也呈现逐渐均质化的趋势(图7).但是这个均质化过程并非持续发生的.从图7可以看出,1998年,西太湖最大污染入湖河口区TH10与湖心区TH08的差别及浓度都相对较低.但是2003年之后自西向东TP浓度梯度变得十分明显,西太湖TP浓度快速增高,同时湖心区TH08的浓度相应升高.此后,2008年太湖流域及湖体的大规模污染治理开展之后,西部河口区的TH10仍继续增高,但是湖心区TH08以东点位TP浓度则开始下降.然而,2013年之后,虽然西太湖的TH10、TH18等点位TP浓度继续下降,但湖心区以东的点位则有所增高.2018年之后,西部重污染区的TH10、TH18点位TP浓度继续下降,而湖心区大幅度增高,胥口湾、东太湖等东部清洁水域的TP浓度继续增高,呈现出磷污染区东扩的现象.其中的机制,既与1998年以来太湖的治理工程内容发生变化有关,也与近年来太湖生态系统结构变化,如东部湖区沉水植被的退化有关.

图7 不同时期太湖水体TP浓度自西向东变化特征
此外,自西向东,太湖水体中各形态磷的比例也发生了变化,如图8所示.西部入湖河口区TH10的活性磷比例最高,而东部胥口湾、东太湖等相对清洁水域的活性磷比例也相对更低.这从一个方面表明外源磷输入对湖体磷浓度的影响还是比较大的.

图8 太湖水体自西向东不同点位水体中TDP/TP及DRP/TDP比值变化
3 讨论
3.1 浅水湖泊水动力扰动引起底泥频繁悬浮是水体磷浓度波动大的主要物理成因
颗粒态磷是太湖水体中磷的主要形态.2005-2020年期间3840组调查数据的平均值表明,不能通过直径约0.7 μm滤膜的颗粒态磷占TP的比例为66%,全湖平均的颗粒态浓度均值为0.077 mg/L.而较高的颗粒态磷浓度及其占比,是大型浅水湖泊频繁发生底泥再悬浮过程的必然结果,原位观测及底泥再悬浮通量的周年观测都证明了大型浅水湖泊底泥再悬浮过程对水体颗粒磷浓度的巨大影响[21-22].
大型浅水湖泊,在没有沉水植被遮蔽底泥的情况下,相对高的浊度、低的透明度是其常态.2005-2020年,太湖各测点的SD平均值为0.39 m,SS的平均值为50.70 mg/L,SD与SS呈现明显的幂函数相关.按照我国湖泊营养状态评价中的SD、Chl.a、TP、TN和高锰酸盐指数5参数法评价,SD为0.39 m所对应的营养状态指数为69.4,属富营养状态.若要太湖水体SD的营养状态得分低于富营养,临界值为1.06 m,按照太湖16年的数据拟合公式,太湖的SS需低于5.5 mg/L,水体透明度才能达到1.06 m.这在没有水草的开敞水域,稳定维持如此低浓度悬浮物的情况可能性不大.
将2005-2020年所有监测数据中按照SS浓度从小到大排序,按照0~5、5~10、10~20、20~30、30~40……290~300 mg/L进行排序,分段获得对应数据组中TP、TDP、DRP浓度均值,然后构建不同SS浓度段SS浓度均值与各形态磷浓度均值的对应关系,如图9所示.太湖水体TP与SS浓度之间存在显著的幂函数关系:在SS浓度低于65 mg/L范围内,TP与SS浓度呈现较好的线性响应关系,SS浓度越高,TP浓度越高.当SS浓度大于65 mg/L之后,TP浓度随SS浓度增加的趋势变得明显平缓,关系的波动性明显增加.其原因是由于高浊度样品的颗粒物来源的复杂性决定的.高浊度既可能是大风浪扰动引起的无机颗粒物增高所致,也可能是藻类大量堆积所致.颗粒物成分不同,颗粒磷含量不同,导致总磷含量差别巨大.而TDP、DRP浓度与SS浓度的关系则更为复杂,在SS浓度低于30 mg/L以下时,TDP、DRP浓度随SS浓度增加而快速增加,但当SS浓度大于30 mg/L之后,2种溶解态磷浓度随着水体SS浓度的增高,反而呈下降趋势.这表明,水体悬浮颗粒物浓度较高时,会吸附水体中的溶解态磷,磷在水相与颗粒物相间的固液平衡,将朝着吸附的方向发展.但是,从图10b中可以看出,随着SS浓度升高,TDP的下垂曲线末端仍在0.033 mg/L左右,DRP的下降极值接近0.010 mg/L.太湖SS与各形态磷浓度的关系表明,在湖泊底泥再悬浮不能有效控制,水体透明度不能得到明显改善的情况下,大型浅水湖泊水体磷浓度控制到Ⅲ类水水平(TP<0.05 mg/L)是相当困难的.而控制到II类水目标(TP<0.025 mg/L)是几乎不可能的.这也是生态环境部将我国东部湖区水体TP浓度的基准值定位0.029 mg/L的原因之一.由于大型浅水湖泊的水动力扰动过程频繁,导致水体颗粒态磷及伴随的溶解性磷不断变化,使得该类型湖泊水体磷浓度存在较大的波动性.
3.2 浮游植物生物量时空变化大是富营养化湖泊水体磷浓度波动大的主要生物成因
磷是影响湖泊浮游植物生长及湖泊营养状态的重要因素,是湖泊富营养化的限制性营养盐.但是,当湖泊水体中磷浓度超过一定的阈值,对藻类生物量增加的效应会大大下降, 而藻类生物量的增加与聚积以生物体磷的形式反过来对营养盐浓度的影响更大.据许海等研究,太湖的冬春季节浮游植物生长对磷比较敏感,而夏季则往往是氮磷共同限制,甚至是氮限制[23],此时水体的磷浓度,可能是浮游植物生物体累积的结果,而非成因.由于浅水湖泊藻类高存量对水体pH、溶解氧等的巨大影响,富营养化湖泊蓝藻水华反过来会促进底泥磷释放,加剧了水相磷浓度维持高值,成为水体磷浓度高低的重要影响因素.
将2005-2020年所有监测数据中按照Chl.a浓度从小到大排序,按照0~5、5~10、10~20、20~30、30~40……190~200、200~220、220~240、240~280、280~360 μg/L进行排序,分段获得对应数据组中TP、TDP、DRP浓度均值,然后构建不同段Chl.a与各形态磷的关系,如图10所示.从图10a中可以看出,太湖水体Chl.a与TP浓度呈较好的幂函数关系,水体Chl.a浓度越高,水体TP浓度越高.表明水体浮游植物生物量高低是影响水体TP浓度高低的重要因素.根据图10中Chl.a与TP浓度的拟合公式,按照2005-2020年太湖平均Chl.a浓度为27.1 μg/L计算,相应水体TP的平衡浓度为0.132 mg/L.这说明,太湖蓝藻水华等藻类高生物量问题无法得到根治的情况下,TP将持续处于较高水平.而增温、暴雨、风速下降等气候因素引发的藻情变化,也势必同时影响太湖水体的TP浓度,这与之前对2017年太湖水体TP“反弹”的机理分析相一致[6-7].与TP不同,TDP及DRP与Chl.a浓度的关系则成典型的单峰状(图10b,c).对于TDP而言,在Chl.a浓度低于157.0 μg/L时,TDP浓度随着Chl.a浓度增高而增高,高于157.0 μg/L之后,则随着Chl.a浓度的升高而降低.一般而言,太湖水体Chl.a浓度达到60 μg/L时,就意味着水体发生了藻类水华.Chl.a与TDP的这种峰值关系说明,当蓝藻水华过度堆积时,水体TDP浓度不会持续升高,而是到了一定浓度后,藻类吸附、利用的比例增加,使得水相中的表观溶解态磷浓度下降.无论是TDP,还是DRP,随Chl.a浓度增高而增高的区间都是相当宽,也即在大多数情况下,伴随着浮游植物生物量的增高,溶解性磷浓度是相应升高的.其峰值,TDP能够达到0.064 mg/L,DRP能够达到0.042 mg/L,都明显高于目前太湖水体的年均值.意味着如果太湖的藻情继续恶化,藻类生物量进一步增高,太湖水体溶解态磷浓度仍将增高.
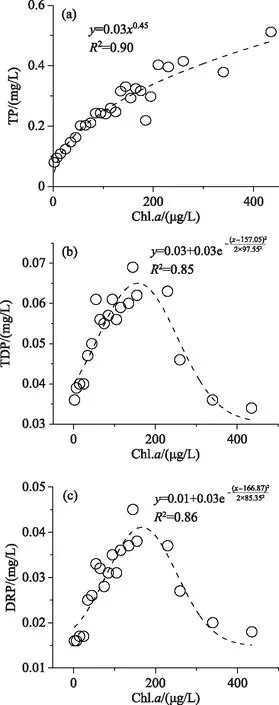
图10 太湖水体Chl.a与水体TP、TDP、DRP的分段统计关系
浮游植物Chl.a浓度与TP浓度的关系,能够解释东太湖水质恶化的现象.以东太湖TH12点位为例,2005年起,水体Chl.a浓度波动增加,特别是2011年起,随着东太湖网围养殖设施退出等经营活动变化及太湖水情变化,底泥再悬浮加剧,浮游植物Chl.a增加,与水体TP浓度增高现象一致(图11).

图11 东太湖TH12点位水体Chl.a及TP浓度的年变化
3.3 流域排污方式变化及土地利用变化是太湖外源磷负荷久控不下的社会成因
太湖的富营养化治理,从1980s初就得到重视[12],被列入国家“六五”、“七五”科技攻关任务[13],特别是1998年开始的太湖水污染治理“零点行动”[24],以及2007年无锡贡湖湾沙渚水厂发生的“水危机事件”之后的“两个确保”(确保不发生大面积湖泛、确保饮用水安全)大规模流域污染治理,均将湖体磷浓度的有效控制作为治理成败的目标之一.然而,湖体磷浓度的控制仍不理想,特别是2017年太湖发生较大规模蓝藻水华,水体磷浓度出现“反弹”,以及2020年春末夏初太湖蓝藻水华的大规模暴发,均表明太湖水体磷浓度既没有达到0.05 mg/L的磷控制目标,也没能发挥有效限制水华蓝藻生长作用.因此,管理上,既要反思太湖水体TP控制目标的可达性,也要考虑太湖流域磷的外源变化.
太湖的流域入湖磷负荷长期居高不下.据黄漪平对1987年环太湖入湖水量、水质的联合监测表明,太湖河道入湖磷负荷为1326.69 t/a[13],许朋柱等对2001-2002水文年的逐月水质水量进行调查表明,河道入湖磷负荷为1029 t/a[25],而张红举通过水量水质联合监测数据估算的2000-2012年环太湖河道入湖磷负荷年均值为1928 t/a,其中最小值在2001年,为1377 t,最大值在2010年,为2798 t[26].翟淑华等估算的2015、2016年太湖外源河道入湖量分别为2209、2594 t[27].而据江苏省水文局的测算,2017年太湖的外源河道入湖总磷负荷仍达2200 t[28],2019年和2020年4-10月份7个月的河道入湖磷负荷分别为918.8和1316.4 t.外源负荷持续偏高仍然是太湖水体磷浓度在高位波动的重要原因.据王华等分析,太湖2017年磷浓度偏高的根本原因是外源负荷量大[29].朱伟等将2017年太湖水体磷浓度反弹的成因归于2016年的流域大洪水[30],认为2016年入湖水量较2006-2015年均值多60.8亿m3,引起河道入湖磷负荷多579.2 t[30].
流域土地利用结构变化及城市化发展可能是太湖流域外源磷负荷居高不下的主要原因.据田甲鸣等对1980年以来太湖流域土地利用变化及人口的资料分析,从1980-2010年,太湖流域耕地面积占比从63.89%下降到40.02%,而建设用地面积占比由9.70%增加到25.16%[31].建设用地的单位面积磷产率显著高于耕地,随着建设用地占比的增高,1980、1995、2000、2005及2010年太湖流域土地面源磷排放量分别为0.33、0.33、0.35、0.52、0.85 t/a,2000年以后流域单位面积的磷负荷大幅增加[31].此外,流域人口密度的增加是外源磷负荷增高的另一个重要原因.1980、1995、2000、2005及2010年5个时间段太湖流域人口密度依次分别为860、987、1054、1230、1563人/km2,污水排放量依次为28.60亿、45.3亿、53.4亿、60.4亿、63.2亿t,污水量的增加相当大程度上抵消了污水处理标准提高对磷排放量的削减贡献[31].苏伟忠等对比了2015年与1985年太湖流域土地利用的变化,1985年太湖林地、园草地、耕地、建设用地和水面的占比分别为12.17%、0.39%、59.99%、10.06%和17.35%,而2015年已经分别变为12.22%、1.91%、44.44%、25.36%及16.05%[32],结果与田甲鸣等的研究相似.
随着流域人口的增加,社会用水量相应增高,可能改变了太湖来水的组成结构,污水厂尾水在太湖外源来水中的总占比显著增高,增加了太湖外源磷负荷.据欧维新等测算,2015年与1995年相比,太湖流域的水资源需求总量由237.34亿m3增加到293.87亿m3,增加了56.53亿m3,其中生活用水量增加了19.49亿m3,工业用水量增加了58.73亿m3,农业用水量下降了21.69亿m3[33].
3.4 太湖水体磷浓度控制的技术途径
太湖的富营养化治理开展了近40年,在流域污染源控制、水体生态修复、生态水利调度等方面均投入了大量的工程建设.然而由于太湖流域的社会经济发展快,土地利用状况变化大,人口仍持续集聚,磷的污染负荷居高不下.加上浅水湖体生态系统脆弱,沉水植被退化,蓝藻水华情势依然严峻,水体磷浓度存在较高的波动性,致使太湖水体磷浓度仍在高位波动.基于目前太湖水体磷浓度自然波动大、外源负荷高的问题,进一步降低水体磷浓度,可能的途径包括:(1)提高污水处理厂的除磷标准;(2)控制流域建设用地比例,控制耕地的旱化比例;(3)大规模恢复太湖东部库湾沉水植被;(4)调控太湖鱼类结构,提高生态系统抑藻控磷能力.
污水处理厂尾水排放可能成为太湖流域重要的磷点源污染.在保持污水处理厂Ⅰ级A排放标准的情况下,水厂尾水中TP浓度接近0.5 mg/L,是太湖水体磷控制目标0.05 mg/L的10倍.平均降水年份太湖流域的水资源供给量为325.43亿m3,干旱年份只有251.36亿m3[33];而太湖流域的污水排放量在2010年就达到63.2亿m3[31],按1980-2010年的发展趋势推算2020年至少达到73亿m3,占太湖流域水资源量的22%,如果污水排放标准不进行提升,稀释达标排放的污水处理厂尾水就使得流域入湖水体磷浓度处于湖库标准的Ⅴ类水(超过0.10 mg/L),成为太湖水体磷达标的重要障碍.
控制建设用地扩张,控制耕地旱化,是有效控制流域面源磷污染的一种可行的途径.面源污染控制的重点是土地利用调控.太湖流域建设用地、水田、旱地、水域、林地和草地的磷排放系数分别为3.45、2.56、2.56、1.175、0.18、0.18 kg/(hm2·a)[31],单位面积建筑用地磷排放系数农田高35%.近年来为追求经济效益,大量稻田等水田改为旱地,磷的面源流失量显著增加.据闵炬等对太湖流域农业用地2002-2017年种植结构及氮磷流失负荷测算,稻田、果园、菜园、茶园的磷投放量分别为100.8、314.3、458.6、131.3 kg/hm2[34],旱地作物,特别是茶果园的磷投放量显著高于稻田.Jiao等在武进等地的田间调查给出了类似的结论:经济驱动下水田向旱田转变,旱田的磷排放负荷显著高于水田,导致了区域磷面源排放强度增加[35].因此,在流域磷的面源控制方面,控制和调整土地利用结构是关键.
内源控制方面,浅水湖泊中草型生态系统恢复是一种较为可行的技术策略.湖泊是流域水中物质的汇聚地,发挥流域水生态的“肾”功能.对磷而言,湖泊自净作用包括2个方面:一是沉降并固定在底泥中,这是深水湖泊磷的主要自净方式[3];二是大型水草等植物的吸收或促淤沉积,这是浅水湖泊的主要自净方式.北美湿地数据库资料统计表明,湿地对磷的吸收能力上限大约是1 g/(m2·a)[36].按此能力,若全太湖均为水生植被发育良好的草型湿地,磷自净能力将达到2338 t/a.但太湖历史上有记录的水草面积也只有约600 km2,大部分湖面是没有水草的藻型湖区,底泥再悬浮过程频繁,对磷的自净能力不大.据朱梦圆等在2012年8月-2013年9月对太湖4个藻型区、2个草型区进行了半月1次的底泥再悬浮过程观测[21],太湖草型区水体磷浓度显著低于藻型区(图12),2个草型区TP浓度年均值为0.030 mg/L,而4个藻型区的TP年均值为0.104 mg/L.因此,大面积恢复太湖的草型区水生植被,是实现全湖平均总磷浓度下降的一种可行途径.
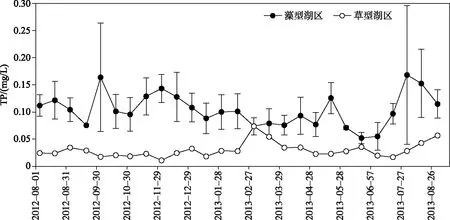
图12 太湖草型湖区与藻型湖区水体TP浓度的周年变化对比
由于浮游植物生物量变化对太湖水体磷浓度波动具有强烈的反馈,通过调整湖泊鱼类群落结构,提高对浮游植物生物量的控制能力,是另一条控制水体磷浓度的生态修复技术.毛志刚等对15年太湖食物链结构变化及其与蓝藻水华的关系研究发现,近年来太湖蓝藻生物量增高是伴随着底栖和浮游动物食性鱼类生物量增加而增高的[37].鱼类的食物链作用对蓝藻水华的影响与营养盐升高的作用相当,控制太湖蓝藻水华,必须对太湖鱼类种群结构进行调控[37].
4 结论
1)太湖70年的磷浓度监测表明,水体磷浓度存在较大的自然波动性.底泥悬浮引起的内源释放强度大、藻类水华引起的水相生物体存在的颗粒磷变化大,以及平原河网地区暴雨冲击带来的外源脉冲式补给等是大型浅水富营养化湖泊水体磷浓度波动性大的主要成因.制定类似太湖这种大型浅水湖泊的磷控制目标时,应充分考虑水体磷浓度的自然波动性.
2)近70年来太湖流域人类活动方式和强度、出入湖河道来水及其比例变化等对太湖水体磷浓度也产生了明显的影响.社会发展带来的排污量增加及流域城市化、耕地旱化等土地利用结构变化背景下,太湖流域污水负荷高,总体流域自净能力不足.近年来由于水情、藻情等变化,太湖水体磷的污染范围有向东南湖区扩大的趋势.
3)未来进一步降低太湖水体磷浓度,建议提高太湖流域污水处理厂的除磷标准,控制流域建设用地比例,控制流域耕地的旱化比例,大规模恢复太湖东部库湾沉水植被,并开展太湖鱼类结构调控,提高生态系统抑藻控磷能力.
