热射病的病理生理与救治进展
2021-07-06许书添综述李世军审校
许书添 综述 李世军 审校
热射病(heatstroke,HS),又称为重症中暑,占中暑的8.6%~18%,是热损伤相关疾病进程中最危险的阶段。其致病原因是机体剧烈运动或暴露于极端热环境时,体内热量蓄积远超散热而导致的核心体温上升[1]。临床上,HS以中枢神经系统功能障碍、多器官功能障碍(MODS)和核心体温急剧升高(通常>40.5℃)为特征。本文对HS的病理生理特点与临床救治的最新进展进行综述,以期提高HS临床救治水平。
HS可分为经典型和劳力型(EHS),两种HS的最终致病原因都是机体无法散发过多的热量,但两者潜在病理机制不同。经典型HS的核心是热环境暴露以及散热不足,而劳力型则主要与体力活动有关,其主要致病原因是机体产生过量代谢热超过生理性热丢失。EHS是中暑最严重的一种类型,也是本文重点阐述的类型,其特点为发病急,病情进展快,好发于既往体质好的年轻人。如果认识和治疗及时,死亡率往往不超过5%;如得不到及时有效的救治,病死率则高达50%以上[2]。
发病机制
HS的主要发病机制是高温、高湿及高强度运动一定时间后,体温调节从代偿(散热多于产热)到失代偿(产热多于散热),病情从轻到重连续变化过程,心输出量不足以处理高体温代谢的需求[3]。HS是热暴露的直接损伤引起,其损伤程度与热暴露程度和强度直接相关。研究发现,41.8℃的热打击对正常细胞即具有损伤效应,当达到极度高体温(49℃~50℃)时,可在极短时间内(5 min)内引起细胞结构破坏和组织坏死[4]。其实更为重要的是继发于热损伤之后的全身炎症反应综合征(SIRS),进而发展为“类脓毒症”反应,随着核心体温持续升高,细胞毒性作用和炎症反应加剧,最终导致恶性循环,引发MODS(图1)。

图1 热射病病理生理机制[3]
HS促发全身性炎症反应的机制仍有待研究。体温过高会触发内皮细胞、白细胞和上皮细胞的应激反应,影响其抵御组织损伤和促进细胞修复进程。分子伴侣家族的热休克蛋白和血浆、组织中炎症趋化因子、抗炎细胞因子均参与了这一过程[5]。
随着高热的进展,机体发生急性生理变化(循环衰竭、低氧血症和高代谢状态)和高温本身直接增加细胞毒性,导致机体炎症反应调节异常。高热引起的炎症反应与SIRS类似,已有研究表明,SIRS由循环中的信使RNA介导,可触发细胞因子和高迁移率组蛋白1(HMGB1)的释放,最终导致白细胞和内皮细胞过度活化[6-7]。与脓毒症休克类似,SIRS可导致临床症状迅速恶化,引发弥散性血管内凝血(DIC)、MODS和死亡。一项针对EHS住院患者的研究表明,约84%的HS患者符合SIRS的诊断标准,并伴有住院时间的延长[8]。另外,经典型HS患者中性粒细胞的活化也与炎症和凝血反应基本吻合[9]。因此,HS也被认为是“热相关全身炎症反应一种形式,并导致以脑病为主的MODS”。临床上,EHS在ICU中并不常见,但EHS与SIRS之间的关联极易被忽视,一旦造成延误治疗,可能会导致灾难性的临床后果。
在中暑进程中,血管内皮细胞(VECs)是重要的靶器官和效应器官,热暴露通过直接热损伤效应、炎症反应、氧化应激、细胞凋亡、焦亡等机制对VECs造成损伤,而损伤的VECs继发释放多种炎性介质,进一步放大机体的炎症反应,加重病情发展,最终形成HS[10]。目前认为HS就是源于热的直接细胞毒性和血管内皮损害引起的凝血和全身炎症反应之间的复杂的相互作用,进而导致单一脏器损害或MODS的过程。
对机体器官功能的影响
中枢神经系统(CNS)CNS对热应激最敏感,脑损害是HS首要表现,患者可有轻度的脑损害表现,重者出现去皮层状态或去大脑强直等。脑损伤的部位主要集中在小脑,表现为广泛的脑细胞萎缩与浦肯野细胞损伤,自主神经和肠神经的损伤可能是永久性的[11]。
心脏心脏属于热易激惹器官,早期机体通过增加心脏收缩力、增加心输出量、加快心率来增加外周循环,以满足排汗需要。随着热暴露时间和强度增加,心脏前负荷下降、心输出量下降,输送至皮肤血管的血流量减少,进而影响散热,进入失代偿阶段。同时心脏受到炎症反应的影响,产生心肌抑制效应,最终影响心肌顺应性和心脏功能,并发心肌代谢紊乱。
肺热损伤可引起肺部VECs损伤和失控性SIRS等诱发急性呼吸窘迫综合征。此时大量细胞因子作用于肺毛细血管内皮细胞,引起VECs结构破坏导致组织因子暴露,激活外源性凝血系统,并抑制纤溶系统,导致促凝和纤溶失衡,引起纤维蛋白原沉积、微血栓形成,肺通气血流比值失调,最终引起通气功能障碍,表现为顽固性低氧血症。
肝脏肝损伤也是HS常见的并发症,更是患者致死的直接原因之一。肝窦内皮细胞是肝窦周边一种特殊的VECs,目前发现肝窦内皮细胞在中暑的病理生理过程中扮演重要角色,其既作为敏感的受损细胞,又可作为效应细胞参与肝损伤。
肠道HS会引起胃肠道血流减少致缺血,对胃肠道细胞的活性和通透性均产生不利影响。由此产生的亚硝化和氧化应激反应损伤细胞膜,破坏了细胞间的紧密连接,促进内毒素或病原体入血,妨碍肝脏解毒,导致内毒素血症。
骨骼肌与肾脏横纹肌溶解是HS严重并发症,与线粒体异常、糖脂代谢异常、炎性肌病有关,表现为肌肉酸痛、僵硬、肌无力、茶色尿、酱油尿,后期可出现肌肿胀和骨筋膜室综合征,最终可导致急性肾损伤甚至需要肾脏替代治疗[12]。
内皮损伤和凝血HS的SIRS过程中,VECs损伤导致的炎症反应与凝血功能紊乱甚至DIC是其重要的致病机制,且两者之间互相影响,促使病情加重向MODS发展,严重影响HS患者的预后。重症中暑的动物存在严重凝血功能障碍,表现为凝血指标异常,包括凝血酶原时间延长、部分活化凝血酶时间延长、D二聚体增加及血小板计数下降、内皮损伤标志物表达增加等。组织病理学发现肝肾等器官出现弥漫性出血,中小静脉出现广泛的微血栓形成[12]。据推断,VECs损伤后通过启动凝功能紊乱甚至导致DIC,诱发微血栓形成,引起微循环功能障碍,促发HS向MODS方向发生和发展(图2)[13]。
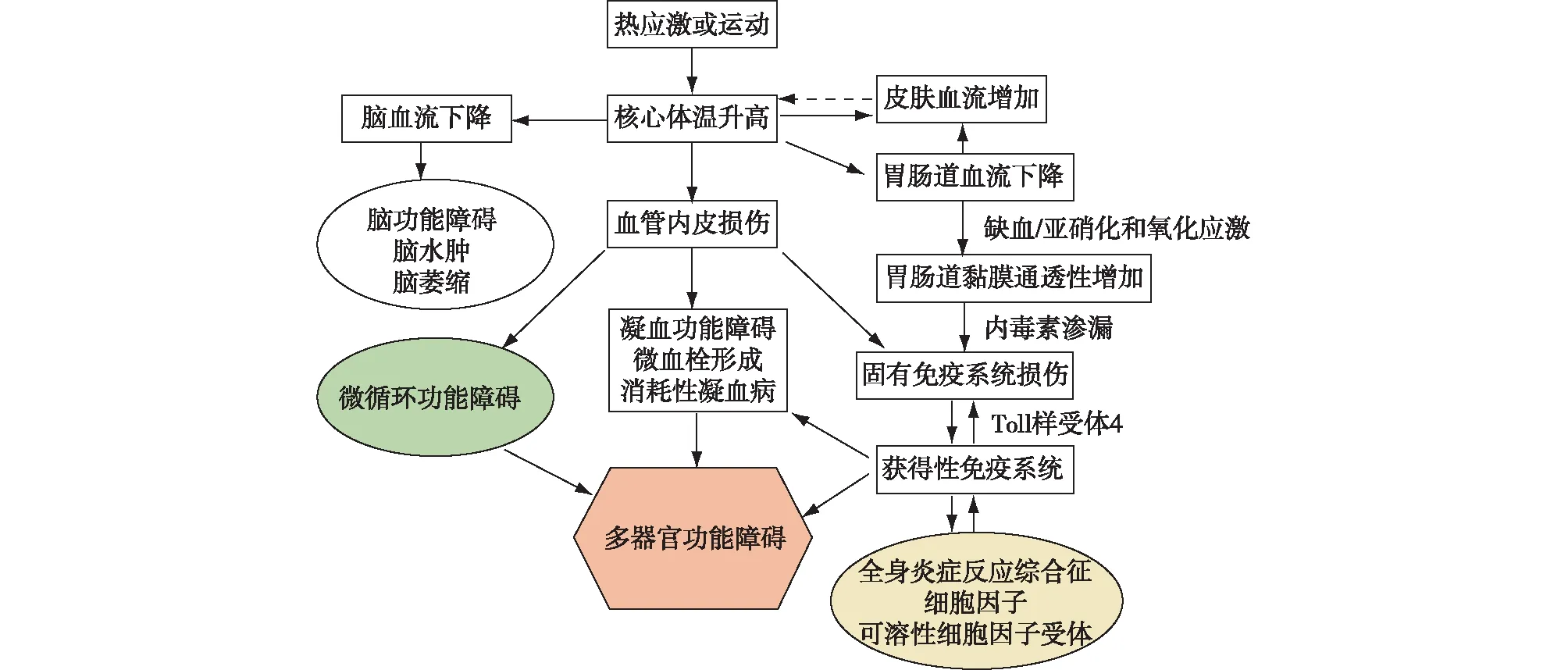
图2 血管内皮细胞损伤参与热射病多器官功能障碍发病机制[13]
临床救治
尽快降温和器官功能保护是HS救治的核心(表1)。与其他创伤的患者相比,HS患者应着重第一时间快速降温,而不是立即送医院。HS的病程可分为三个阶段;高热-神经损伤急症期、血液系统—酶促反应期(发病后24~48h达峰)和肝肾功能异常晚期(临床症状持续>96h),这三个阶段在EHS表现更为明显。医疗救治人员尽早识别和正确治疗HS,直接关乎HS患者的预后(表2)。

表1 热射病(HS)院前救治和急诊处置措施[3]

表2 热射病院内重症监护病房(ICU)处置措施[3]
控制体温由于核心体温持续超过40.5℃,预后极差;因此除非因心肺复苏延迟降温,迅速且有效的降温措施应该贯彻HS救治的始终。为控制病情恶化,目标体温<39℃(最好38.5℃~38℃)[14]。对于EHS,快速降温(速率>0.1℃/min)是安全的,且可显著改善预后。目前公认降温最好方法是冷水浸泡,其降温速率可达0.2~0.35℃/min。在执行军事任务或沙漠高温条件下,如果没有冰或冷水,可在疑似HS患者身体表面大量浇水,并加快空气流通(比如扇风),力争降温速率达到约0.1℃/min[15-16]。对于经典型HS的老年患者,冷水浸泡也是有效的降温方法,除此之外还可选择一种或多种加快热传导、加快热蒸发的降温方式,如输注冷液体(血管内降温)、冰袋、冷敷包、湿纱布外敷、扇风等等。尽管上述方法不如冷水浸泡效率高,但临床更易于实际操作[17]。由于HS患者属于多途径导致的核心温度升高,目前尚无加速降温的药物,禁用阿司匹林和对乙酰氨基酚等退热药,退热药会加重HS患者的凝血功能障碍并易引发肝损伤。目前治疗恶性高热的细胞内肌肉松弛剂——丹曲林,仍处于临床试验阶段。
器官损伤的治疗正确识别和有效降温可逆转热损伤带来的器官功能障碍,并且及时的辅助治疗也是提高患者存活率的关键。为了防止SIRS的进展,治疗关键在于及时有效的器官支持(表2)。目前有关HS器官损伤的试验性治疗仍处于动物实验和初步临床试验阶段,包括黄嘌呤氧化酶抑制剂(别嘌呤醇)通过减少门静脉系统内脂多糖水平来保护细胞间的紧密连接[18];重组活化蛋白C用于改善炎症反应和功能失调的凝血级联反应[19];Ⅲ型抗凝血酶浓缩物和重组可溶性血栓性调节蛋白α治疗DIC[20];丝氨酸蛋白酶抑制肠腔内胰酶活性以降低全身炎症反应[21]。此外还有使用大黄减轻炎症反应以治疗热相关的肝肾损伤[22]。以上这些方法尚处于不同研究阶段,数据有限。
本表给出的建议是一般性原则;建议根据患者的病情个体化治疗;在热射病发生后24~48h,器官衰竭可能很明显,需严密观察病情持续至少96h。GCS的分数范围3~15分,分数越低表明意识水平越低小结:HS是一种可防可治的急症,但也可致命或遗留严重后遗症。对于HS病理生理的认识仍有待深入。早期识别热应激能力下降的特征、寻找准确预测HS的生物标志物并研发有效控制炎症和阻遏多器官损伤的新辅助治疗手段,是未来HS救治的研究方向。
