长链非编码RNA RP11-395G23.3在子宫内膜癌中的表达及其临床意义
2021-07-06黄雨欣华克勤辛卫娟
黄雨欣,雷 蕾,华克勤,辛卫娟
(1.复旦大学附属妇产科医院妇产科,上海 200090;2.同济大学附属东方医院妇产科,上海 200120)
子宫内膜癌(endometrial carcinoma,EC)起源于子宫内膜上皮,是女性生殖系统的第二大恶性肿瘤[1]。根据相关癌症统计数据显示,我国2015年新发子宫内膜癌患者约为63 400,死亡人数约为21 800人[2]。来自美国癌症协会的最新数据则预计,2020年美国各州患子宫内膜癌的新发患者将达到65 620例。此外,该协会根据2009—2015年的数据统计得出,未发生转移的子宫内膜癌患者的5年生存率可达95%,这一数据要显著高于发生局部转移患者的69%及发生远处转移患者的16%[1]。因此,早期筛查诊断及准确判断癌症转移情况对于提高子宫内膜癌患者生存率及改善预后具有重要意义。
长链非编码RNA(long noncoding RNA,lncRNA)是一类长度超过200个核苷酸的非编码RNA[3]。lncRNA可作为基因表达的调节剂,参与多种疾病的发生发展。越来越多的证据表明,lncRNA的失调与癌变和癌症进展有关,并且lncRNA的异常表达可作为疾病的诊断或预后标志。Chen等[4]发现,lncRNA HOTAIR的上调能产生促进食管鳞状细胞癌转移并导致预后不良。
RP11-395G23.3已被证实为一种长链非编码RNA且与EC的发病机制相关[5]。然而,其在EC中的作用与临床意义在之前的研究中并未阐明。本研究选取了41例EC患者的肿瘤组织及26例正常子宫内膜组织作为对照,检测RP11-395G23.3在组织中的表达水平,并分析其与临床病理特征及免疫组化指标之间的关系。由此,探讨其作为子宫内膜癌相关生物标志物的意义。
1 资料与方法
1.1 一般资料
选取复旦大学附属妇产科医院于2013年8月—2016年5月收治的41例子宫内膜癌患者的肿瘤组织为研究对象,年龄26~76岁,平均(56.22±10.51)岁,绝经年龄(41.25±8.21)岁。患者组织病理分类:子宫内膜样癌32例,子宫内膜浆液性癌7例,子宫内膜透明细胞癌2例;根据FIGO判断的手术病理分期:Ⅰ期26例,Ⅱ期5例,Ⅲ期9例,Ⅳ期1例;病理分级(仅针对子宫内膜样癌):G1级17例,G2级8例,G3级7例。患者术前均未行化疗、放疗或激素治疗。对照组选取了26例正常子宫内膜组织。本研究得到了复旦大学附属妇产科医院伦理委员会的批准(编号:2016-64),所有受试者均签署了知情同意书。
1.2 方法
1.2.1 定量RT-PCR 从样本中提取RNA后,将总RNA(1 μg)配成总体系为20 μL并含ATP和poly(A)聚合酶(PAP)的反应混合物,于37 ℃条件下多聚腺苷酸化1 h。随后用苯酚-氯仿提取及乙醇沉淀后,使用特异性反转录引物及PrimerScript反转录酶(TaKaRa公司)对RNA进行反转录,引物序列见表1。使用2×SYBR Premix Ex Taq TM混合物(Takara公司)进行RT-PCR,来检测组织中RP11-395G23.3的表达水平。以GAPDH作为内参,引物序列见表1。相对表达量根据2-ΔΔCt法计算,以RP11-395G23.3相对表达量的均值(0.535)作为标准。小于等于均值记作低表达组,反之则为高表达组。

表1 RT-PCR引物序列Tab.1 Primer sequence of RT-PCR
1.2.2 免疫组织化学法 标本经甲醛固定、石蜡包埋及切片后,采用LSAB法处理,并用DAB显色及苏木素衬染。免疫组化指标评分采用双盲法,在镜下随机选取10个高倍视野,根据阳性细胞所占的比例及染色强度两个指标共同判断免疫组化指标评分。(1) 根据阳性细胞所占比例评分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;(2) 根据染色强度评分:无色=0,淡黄色=1,棕黄色=2,深棕色=3。最终得分为阳性细胞所占比例得分与染色强度得分相加的结果,并以此判定免疫组化指标表达。将0判定为“-”,≤2判定为“+”,≤4判定为“++”,>4判定为“+++”。此外,将“-”及“+”记作低表达组,而“++”及“+++”则记作高表达组。
1.3 统计学处理
2 结 果
2.1 RP11-395G23.3的表达水平
EC患者肿瘤组织中RP11-395G23.3表达水平(0.535±0.648)较对照组(1.477±1.329)显著降低,差异有统计学意义(t=3.312,P=0.002)。
2.2 RP11-395G23.3与EC临床特征的关系
RP11-395G23.3表达水平与脉管内见癌栓有关,差异有统计学意义(P<0.05);RP11-395G23.3表达水平与患者的年龄、组织病理分类、绝经情况、FIGO分期、组织学分级、肌层浸润、淋巴结转移间的比较均未见有统计学意义,见表2。
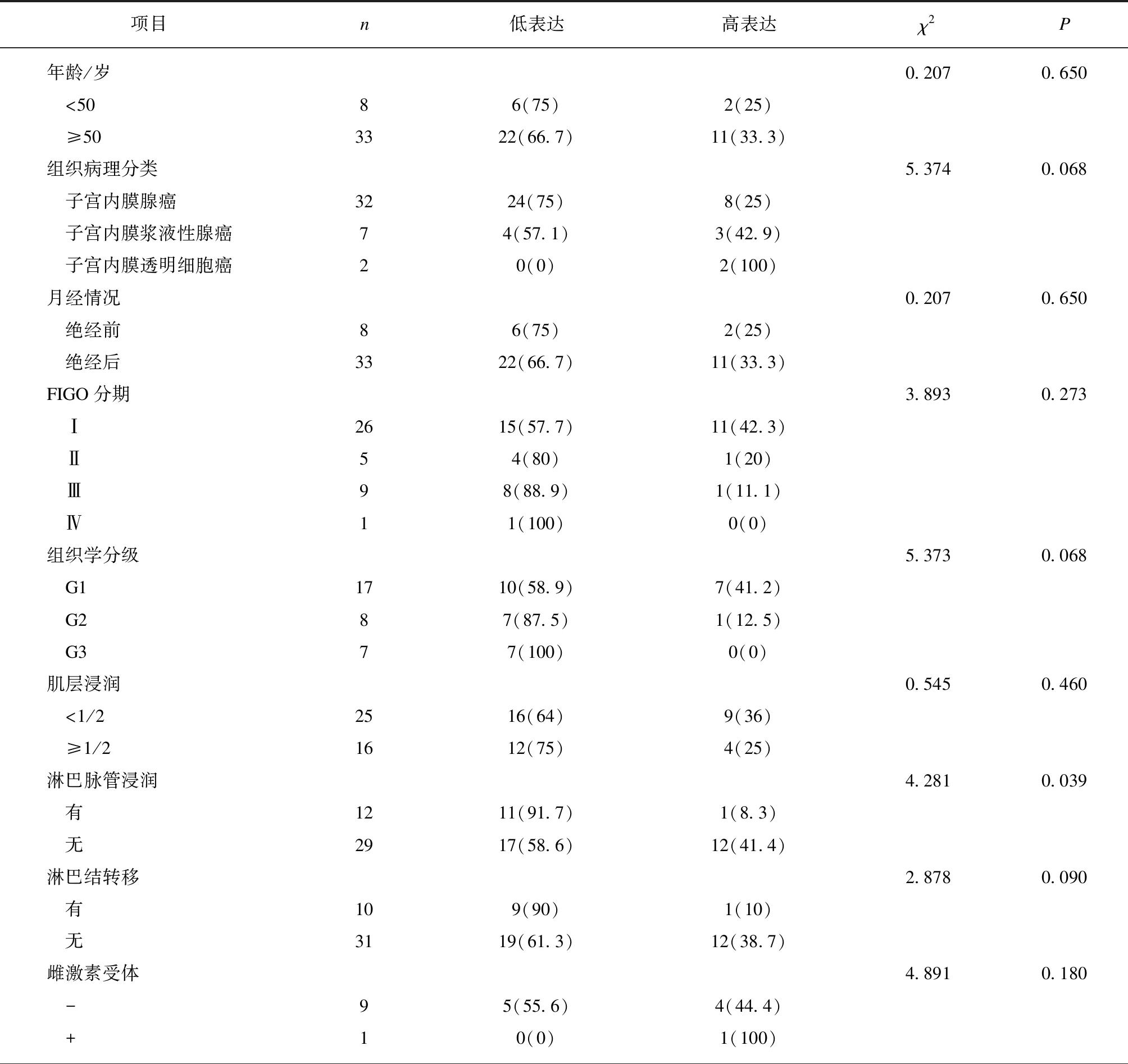
表2 RP11-395G23.3表达与EC患者临床特征及免疫组化指标间的关系Tab.2 Expression of RP11-395G23.3 and its relationships with clinical features and immunohistochemical indicators of EC patients [n(%)]
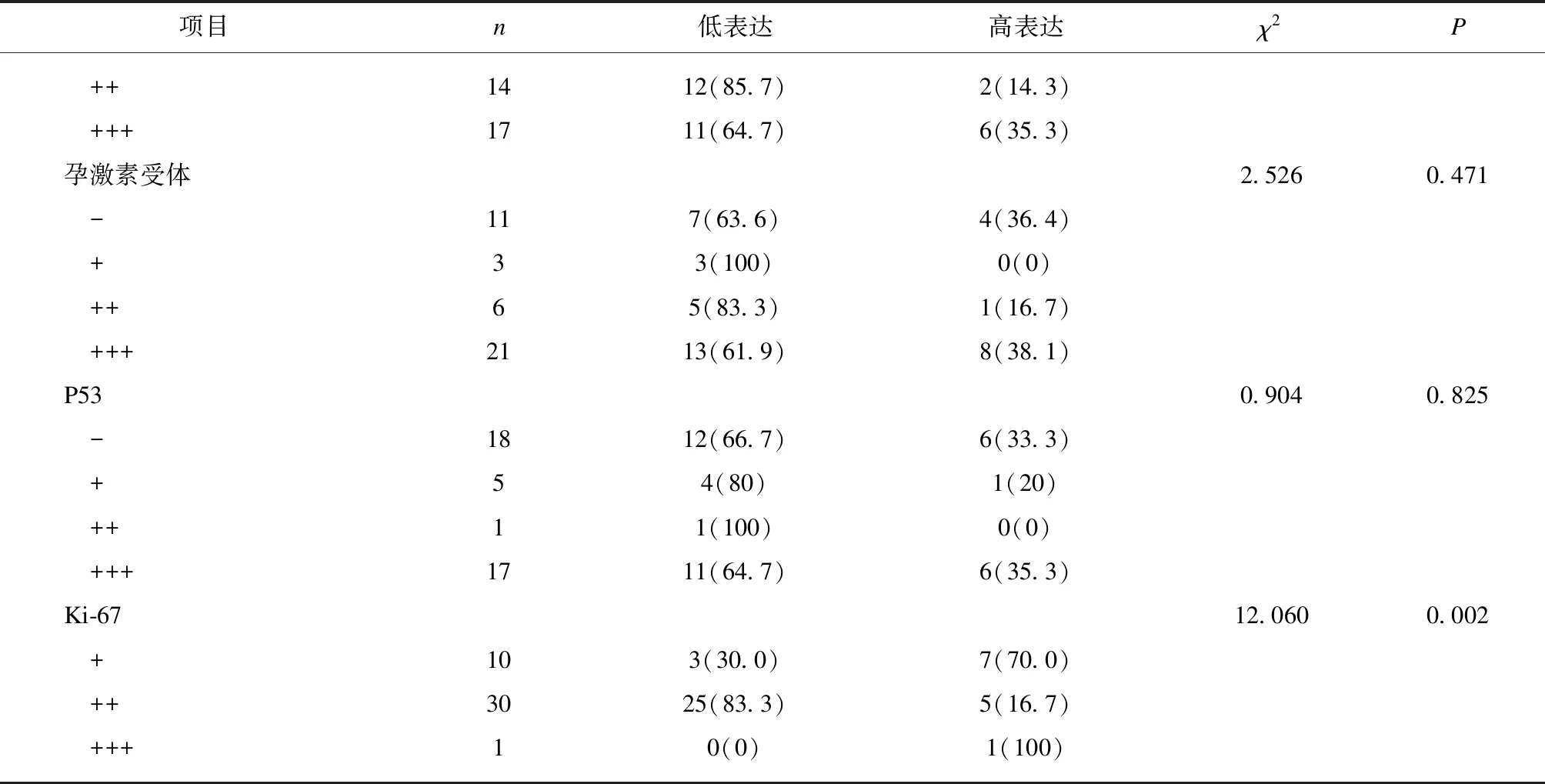
续表
2.3 RP11-395G23.3与免疫组化指标的关系及相关性分析
RP11-395G23.3表达水平与雌激素受体(estro-genreceptor,ER)、孕激素受体(progesteronerec-eptor,PR)及P53表达水无关,差异无统计学意义;RP11-395G23.3与Ki-67表达水平有关,差异有统计学意义(P<0.05);并且,RP11-395G23.3与Ki-67表达水平呈负相关(r=-0.379,P=0.014),见表3。
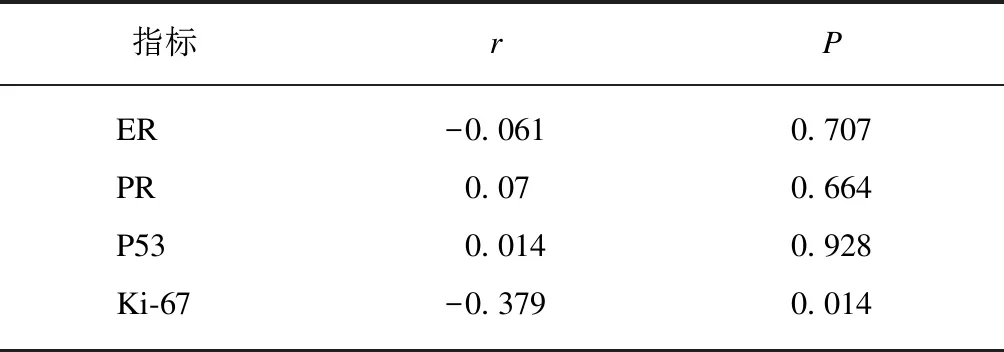
表3 RP11-395G23.3与免疫组化指标的相关性Tab.3 Correlation between RP11-395G23.3 expression and immunohistochemical indicators
3 讨 论
近年来,随着经济发展,人们饮食结构和生活习惯也发生改变,随之代谢性疾病发病率增加,子宫内膜癌出现了发病率升高和发病年轻化的趋势[6]。虽然约90%子宫内膜癌患者会出现阴道流血等表现,但早期EC患者在妇科检查时可无异常表现。未在早期确诊的患者将错失最佳的治疗时机,导致较低的长期生存率及预后不良的结果。因此,探讨有助于子宫内膜癌的早期诊断、病情进程评估及判断预后的生物标志物,具有十分重要的临床意义。
自2013年TCGA数据发布以来,人们一直在努力将分子检测纳入常规临床组织学诊断评估中[7]。越来越多的研究结果证实,lncRNA与疾病包括癌症[8]的发生机制相关。本研究旨在通过检测子宫内膜癌患者肿瘤组织中RP11-395G23.3的表达水平,将其与正常子宫内膜组织中RP11-395G23.3的表达水平进行对照,并阐明其与EC的临床病理特征以及免疫组化指标间的关系,为进一步研究子宫内膜癌的发生机制、探寻潜在的诊断及治疗靶点提供思路。
lncRNA可以通过基因转录,染色质动力学,染色质环化,组蛋白修饰,端粒生物学,蛋白质复合物组装,RNA剪接和翻译等多个方面实现其调控作用[9]。lncRNA的失调在肿瘤的发生及发展中均具有重要意义[10]。在早前的研究中,lncRNA Hox反转录RNA(Hox transcript antisense RNA,HOTAIR)被证实来自HoxC基因反义链的转录,该基因的反义链特别位于染色体12q13.13上的HoxC11和HoxC12之间[11]。在He等[12]开展的包含87个样本的研究中,近3/4的子宫内膜癌样本中检测到了HOTAIR的表达上调。与正常组织相比,HOTAIR在EC组织中的表达明显上调。He等还发现,HOTAIR与EC的转移扩散相关,HOTAIR的高表达与EC的转移和整体生存率的降低呈正相关。肺腺癌转录相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)也是一类受到广泛关注与研究的lncRNA。MALAT1启动子区域的结合位点能够与TCF4相互作用,经由Wnt/β-catenin信号传导途径诱导其自身表达。PCDH10(一种肿瘤抑制蛋白)则能通过抑制该途径来抑制MALAT-1的转录。与正常或增生的子宫内膜相比,EC样品中的lncRNA-MALAT-1被下调[13-14]。在近年来的研究中,MALA-T1,HOTAIR,SRA,H19,OVAAL,CASC2等越来越多的lncRNA被证明与EC存在密切关联[15]。
先前的研究中已证实RP11-395G23.3与miR-205-5p-PTEN网络相关,并在EC的转录后调控中发挥重要作用[5]。Qu等的[16]研究证实,PTEN为miR-205-5p的直接靶点。与正常组织相比,PTEN在EC中的表达减少而miR-205-5p的表达则显著增加。PTEN的低表达与EC的发病机制相关,而miR-205-5p的高表达与整体生存率低有关[5]。RP11-395G23.3能够通过与miR-205-5p结合以抑制后者的表达和活性,即lncRNA通过碱基配对发挥了“miRNA海绵”的作用[17]。本研究发现,EC组织中RP11-395G23.3表达水平与脉管内见癌栓及Ki-67表达水平有关,且与Ki-67表达水平呈负性相关。
多数子宫内膜癌的生长缓慢,而EC中的高级别内膜样癌及浆液性癌、透明细胞癌、癌肉瘤等类型则发展较快,能够在短期内发生转移。其中,淋巴转移为EC的主要转移途径。脉管内见癌栓则提示肿瘤细胞已入侵血管或淋巴管,极有可能导致淋巴结转移及远处转移等危险因素发生。NCCN子宫肿瘤临床实践指南中指出,广泛脉管内癌栓是内膜癌复发的显著危险因素,提示预后不良[18]。脉管内癌栓可作为子宫内膜癌的预后因素。Li等[19]指出,lncRNA参与了多种癌症细胞的转移级联反应,提示lncRNA在肿瘤的转移过程中发挥着至关重要的作用。本研究数据显示,在脉管内见癌栓的EC患者的组织标本中,RP11-395G23.3的表达水平显著低于脉管内未见癌栓组。这提示,RP11-395G23.3可能参与了子宫内膜癌的进展过程,且其低表达与EC患者的不良预后间存在密切关系。
近年来,大量证据表明,lncRNA的失调与肿瘤细胞的生长有关,可导致肿瘤细胞的持续增长[20-21]。Cai等[22]发现,长基因间非蛋白质编码RNA665(long intergenic non-protein coding RNA 665,LINC00665)在EC组织中表达明显上调,且在抑制LINC00665的表达后,子宫内膜癌细胞的Ki-67水平显著降低。即LINC00665的缺失可抑制子宫内膜癌细胞的活性,阻滞了G1期,并可诱导细胞凋亡。Ki-67是与细胞有丝分裂密切相关的核抗原,可反映细胞的增殖活性,在除G0期以外的细胞周期中均可检测到Ki-67的表达。Ki-67表达量的多少与细胞的增殖、分化密切相关,可用作肿瘤发生、发展及细胞活性的检测指标,并且可作为结直肠癌、卵巢癌、乳腺癌等多种恶性肿瘤的诊断指标[23]。王彦秋等[23]的研究显示,Ki-67与子宫内膜癌患者FIGO分期、病理分级、肌层浸润以及淋巴结转移密切相关。并且,Ki-67高表达提示子宫内膜癌患者的预后不良。根据本研究结果显示,RP11-395G23.3的表达水平也与Ki-67的表达水平相关,且二者之间呈负性相关关系。即在RP11-395G23.3高表达的组织中,Ki-67水平较低,肿瘤细胞的生长受到抑制。也就是说,随着RP11-395G23.3表达水平的增高,Ki-67表达水平将随之降低。这提示,RP11-395G23.3的低表达可能与EC的发生发展及不良预后相关。这与根据RP11-395G23.3表达水平与脉管内癌栓的形成间关系所得出的结论一致。即RP11-395G23.3可能参与EC的发生发展且其低表达与不良预后相关。因此,RP11-395G23.3与子宫内膜癌密切相关,推测RP11-395G23.3能够成为用于子宫内膜癌的诊断、判断病程进展、患者预后、甚至是治疗靶点的生物标志物。
综上,子宫内膜癌中RP-11395G23.3的表达水平与脉管内癌栓形成及Ki-67水平相关,可作为与子宫内膜癌相关的生物标志,用于子宫内膜癌的诊断、评估病程发展及治疗中,为EC的发生发展机制及患者治疗提供新思路。在未来,RP-11395G23.3等基因在子宫内膜癌的起源、转移、复发等的作用及机制将会得到更完善的阐释,并成为进一步的研究方向。但本研究的病例数较少,在进一步的研究中需要扩大研究的样本数量并通过继续随访EC患者以验证其与患者预后情况之间的关系。
