ChCl-Urea低共熔溶剂中银锡合金的电沉积行为研究
2021-07-06王怡童李奇松崔琳琳王斯琪宋思思
王怡童,李奇松,崔琳琳,王斯琪,宋思思,孙 杰
(沈阳理工大学 环境与化学工程学院,沈阳 110159)
电沉积银由于其优异的性能,如高的电导率和导热率、高的反射系数以及出色的催化和抗菌性能而在现代技术中得到了广泛的应用[1-3]。与其他金属合金化可以提高银的某些性能,如低硬度、耐磨性和耐变色性等,含锡量较高的银合金具有比纯银更高的耐蚀性[4-6]。目前尽管水溶液中电沉积金属的研究比较成熟,但仍存在电化学窗口窄、析氢、槽液成分复杂及工艺控制比较复杂等问题[7-9]。因此,寻找可替代镀液成为学者们的主要研究工作。
离子液体具有蒸汽压低、电化学窗口较宽、热稳定性好等优良特性,近年来离子液体应用于电沉积的研究逐渐受到关注[10-11]。P.Sebastián等[12]在ChCl-Urea体系中对Cu的电沉积进行了研究,分析了ChCl-Urea共晶混合物中铜离子电沉积的机理,采用循环伏安法研究电化学还原过程,采用恒电位技术研究其成核和生长过程。循环伏安和计时电流结果表明,Cu分两步还原,Cu的成核方式为三维生长,并随着过电位的增加,Cu的生长形貌由小颗粒状转变为树枝状。Haoxing Yang等[13]在ChCl-Urea体系中对Zn电沉积的电化学行为、成核机理、镀层形貌等进行了研究,得到了纯锌镀层,并确定了温度为363K时,锌在电解质中的扩散系数为7.85×10-3m2/s。
本文以ChCl-Urea低共熔离子液体为基础液,进行银锡合金镀层的制备及性能研究,采用循环伏安曲线分别深入研究银离子和亚锡离子的电化学行为以及二者共存时的电化学行为,通过对比金属单质和合金的电化学性能确定合金的沉积条件,使用SEM表征银锡合金的微观形貌,采用极化曲线对镀层耐蚀性进行分析。
1 实验部分
1.1 实验主要原料和设备
1.1.1 实验主要原料
氯化胆碱(ChCl)、尿素(Urea),国药集团化学试剂有限公司;硝酸银(AgNO3)、氯化亚锡(SnCl2·2H2O),天津市大茂化学试剂厂,均为分析纯试剂。实验用水均为去离子水。
1.1.2 实验主要设备
CS350电化学工作站,武汉科斯特仪器有限公司;VEGA3扫描电子显微镜(SEM),上海日立电器有限公司。
1.2 实验方法
取摩尔比为1∶2的ChCl与Urea混合,浓度为0.1mol/L的AgNO3溶液和浓度为0.1mol/L的SnCl2溶液溶入ChCl-Urea中,得到ChCl-Urea-0.1mol/LAgNO3-0.1mol/LSnCl2·2H2O低共熔溶剂;作为基体材料的黄铜片在使用前分别用240#、400#、1200#、2000#砂纸进行打磨抛光处理,用丙酮进行除油后,采用无水乙醇进行彻底清洗,然后用去离子水水洗,干燥备用。
电沉积实验温度为50℃,沉积时间为1h;耐蚀性测试以3.5%NaCl水溶液作为介质,测试在室温下进行,测试试样规格为1cm×1cm,测试前将试样浸入腐蚀介质中静置30min。
2 结果与讨论
2.1 银锡离子在低共熔溶剂中的电化学还原行为
图1为不同的低共熔离子液体体系的循环伏安曲线,为对银锡合金的电化学行为进行深入对比研究,分别对只含有Ag+和Sn2+的低共熔体系进行循环伏安曲线测试。
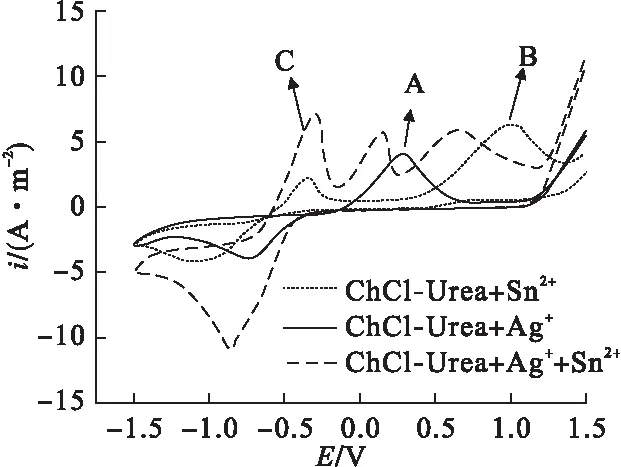
图1 不同镀液体系的循环伏安曲线
图1中曲线A是镀液体系为ChCl-Urea-0.1mol/L AgNO3的循环伏安曲线。在负扫过程中,可以观察到该曲线只有一个还原峰,故Ag+是一步还原,其电位为-0.72V,其峰值电流为-3.99A·m-2;正扫过程中,在0.28V电位条件下出现了一个氧化峰,表明在该镀液体系中碳电极上银离子先进行沉积,之后又被氧化,镀层消失。
图1中曲线B是镀液体系为ChCl-Urea-0.1mol/L SnCl2·2H2O的循环伏安曲线。其在-1.04V电位条件下出现一个还原峰,说明Sn2+也是一步还原,其电位相对于银离子的还原电位要更负,峰值电流为-4.28A·m-2;正扫过程中出现了两个氧化峰,峰值电位分别为-0.33V和1.01V,说明由金属Sn氧化成Sn2+是两步进行的,这与文献[14]的研究相吻合。
图1中曲线C是镀液体系为ChCl-Urea-0.1mol/L AgNO3-0.1mol/L SnCl2·2H2O的循环伏安曲线。其在-0.87V电位条件下出现一个还原峰,说明在阴极还原过程中Sn2+和Ag+是共还原的,峰值电流为-11.1A·m-2;正扫过程中,出现了三个氧化峰,对应的峰值电位分别为-0.31V、0.14V和0.64V,与曲线A和曲线B对比可知,-0.31V和0.64V两个电位对应的峰为Sn的氧化峰,而0.14V对应的峰为Ag的氧化峰,这与文献[15]的研究相吻合。
2.2 银锡离子在低共熔溶剂中的形核行为
为进一步研究银锡合金的成核机理,分别对ChCl-Urea-0.1mol/L AgNO3、ChCl-Urea-0.1mol/L SnCl2·2H2O和ChCl-Urea-0.1mol/LAgNO3-0.1mol/L SnCl2·2H2O体系进行了计时电流测试,结果如图2所示。
由图2可以观察到,ChCl-Urea-0.1mol/L AgNO3体系在-0.19V电位条件下的计时电流曲线(图2a)、ChCl-Urea-0.1mol/L SnCl2·2H2O体系在-0.12V电位条件下的计时电流曲线(图2b)、ChCl-Urea-0.1mol/LAgNO3-0.1mol/LSnCl2·2H2O体系在-0.15 V处的计时电流曲线(图2c)变化趋势相似,电流密度均为先增大后减小。电位随时间的增加从0V跃迁到-0.19V、-0.12V、-0.15V,由于双电层充电,施加电位后短时间内电流都迅速上升;此外,电极表面金属银核、锡核、银-锡核的形成和生长过程中由于有电子的转移,也会导致电流增加并在短时间内达到一个最大值;在一段时间后,因为三种镀液体系中工作电极表面金属Ag、金属Sn、Ag-Sn合金的沉积分别导致三种体系中含Ag+、Sn2+的电活性组分浓度下降,因而电流开始呈下降趋势;此后电流持续降低,直到Ag+、Sn2+、Ag+-Sn2+由体系向电极表面的扩散速度与电极反应速度相同时,电流开始稳定,并以该速率进行Ag+、Sn2+、Ag+-Sn2+向金属Ag、金属Sn、Ag-Sn合金的还原反应。这种现象说明ChCl-Urea低共熔溶剂体系中Ag+、Sn2+、Ag+-Sn2+的还原过程受扩散控制[16]。
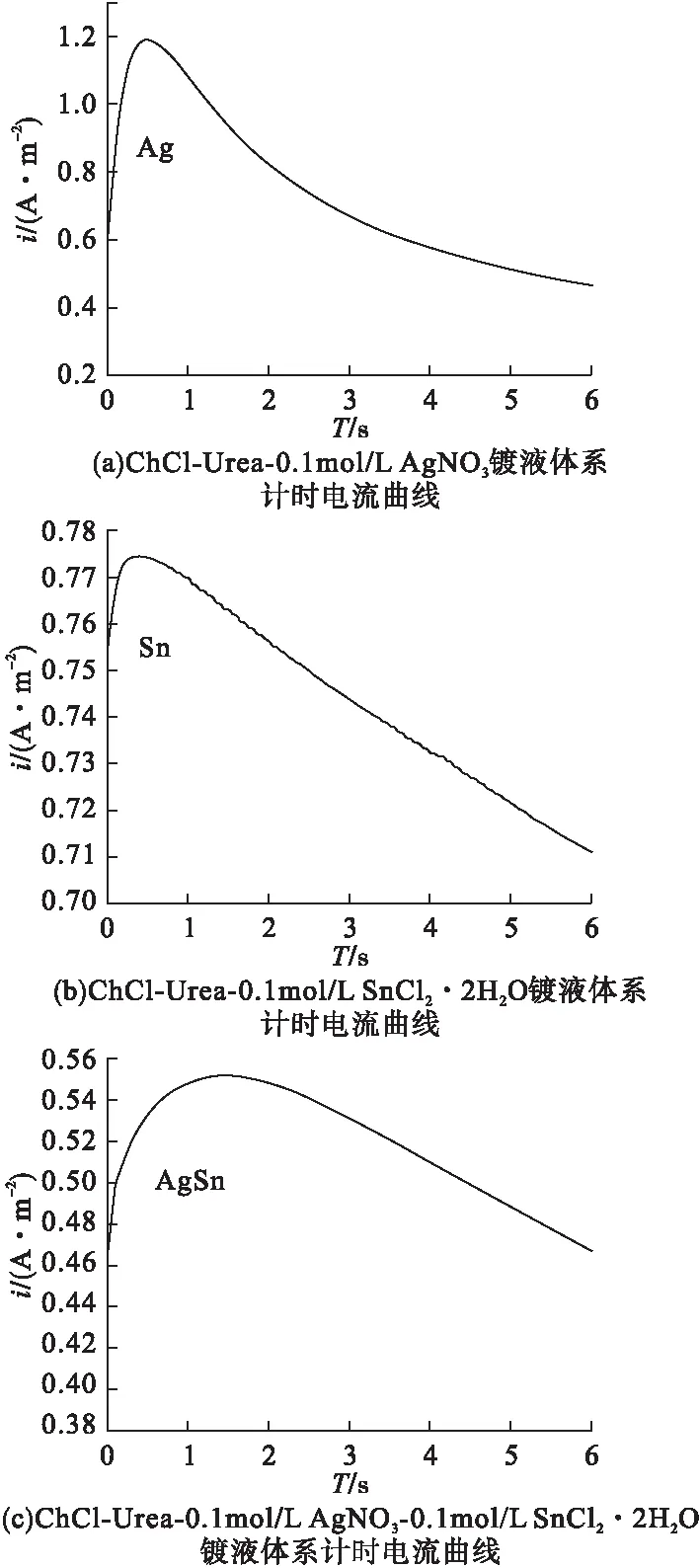
图2 不同镀液体系的计时电流曲线
根据金属电沉积形核理论[16],二维成核生长时,随着时间的增长,电流最终趋近于零,而三维成核生长时则趋近于一个不为零的电流值,因而可以判定ChCl-Urea低共熔溶剂体系中金属Ag、金属Sn、Ag-Sn合金的成核生长方式均属于三维成核生长。
为确定其成核生长方式,按照SH模型[16]对计时电流曲线结果进行无因次处理,即横坐标采用t/tm,tm为计时电流曲线中峰值处对应的时间;纵坐标采用(i/im)2,im为计时电流曲线中峰值处对应的电流密度。无因次处理结果如图3所示。

图3 无因次处理后的计时电流曲线
由图3可见,将无因次处理后的三条计时电流曲线和三维瞬时成核理论及三维连续成核理论曲线进行对比,在ChCl-Urea-0.1mol/L AgNO3-0.1mol/L SnCl2·2H2O镀液体系中Ag+和Sn2+还原生成Ag-Sn合金过程中的形核生长更符合三维瞬时成核理论,而ChCl-Urea-0.1mol/LAgNO3镀液体系中Ag的形核生长和ChCl-Urea-0.1mol/LSnCl2·2H2O镀液体系中Sn的形核生长既不符合三维瞬时成核理论,也不符合三维连续成核理论。
2.3 镀层的微观形貌分析
在循环伏安曲线的负扫过程中取三个电位,-0.45V、-0.60V和-0.85V,分别在这三个电位条件下进行Ag-Sn合金电沉积,采用SEM分析镀层的微观形貌,结果如图4所示。


图4 不同电位条件下SEM图
从图4中可以观察到,当电位为-0.45V时(图4a),黄铜基体基本被Ag-Sn颗粒覆盖,得到细小块状并呈现枝晶状微观镀层;当电位为-0.60V时(图4b),可以观察到其明显的枝晶状形貌;当电位为-0.85V时(图4c),电沉积镀层微观形貌为更致密的枝晶状。说明电位的增加并不会对银锡合金镀层微观形貌有较大的影响。
2.4 镀层的耐蚀性能分析
为研究Ag-Sn合金的耐蚀性能,将ChCl-Urea-0.1mol/LAgNO3-0.1mol/LSnCl2·2H2O镀液在不同电位条件下进行电沉积得到的Ag-Sn合金镀层进行极化曲线的测试,所得结果如图5所示。

图5 不同电位条件的极化曲线图
金属在同一腐蚀介质中的腐蚀电流越小,腐蚀速率越低,耐腐蚀效果越好。根据图5得到不同沉积电位下的腐蚀电流和极化电阻数据如表1所示。

表1 Tafel数据
由表1可见,随着沉积电位的增大,腐蚀电流减小;当电位条件为-0.85V时,Ag-Sn合金镀层腐蚀电流最小,为0.1774A·m-2。
3 结论
在ChCl-Urea低共熔溶剂中电沉积制备了Ag-Sn合金。循环伏安曲线测试表明,在低共熔镀液体系中Sn2+和Ag+共还原;计时电流测试结果表明,低共熔离子液体体系为ChCl-Urea- 0.1mol/L AgNO3- 0.1mol/LSnCl2·2H2O时,Ag-Sn成核方式为三维瞬时成核;极化曲线测试结果表明,腐蚀电流随电位的增大而逐渐减小,可以通过增加沉积电位来提高镀层的耐蚀性能。
