海洋低盐度干湿交替环境不同金属镀层对 D32钢保护特性研究
2021-07-06姜洁许甜刘婧
姜洁,许甜,刘婧
(中石油华东设计院有限公司,山东 青岛 266071)
海洋腐蚀环境是影响海洋平台寿命的关键因素之一。海洋腐蚀区域分为大气区、浪花飞溅区、潮差区、全浸区和海泥区等5个区域[1]。其中大气区主要为大气腐蚀特征,腐蚀速率较低,约为0.03~ 0.08 mm/a[2-3];潮差区主要表现为水线腐蚀,腐蚀速率约为0.1~0.37 mm/a[4-5];全浸区和海泥区金属的腐蚀行为受到溶解氧、微生物、pH、有机质[6]等一系列因素的影响,金属的腐蚀形貌为全面腐蚀和点蚀状态,腐蚀速率分别约为0.13~0.25 mm/a和0.02~ 0.08 mm/a;浪花飞溅区(浪溅区)的腐蚀速率远远大于上述4个区域,腐蚀速率一般为0.3~0.5 mm/a,最高可达2.5 mm/a(阿拉斯基科克湾)。
在现场中,大气区和浪溅区多采用有机涂层进行保护,潮差区、全浸区和海泥区多采用牺牲阳极+涂层的方式进行保护[7]。与大气区相比,浪溅区不仅受到海洋大气环境的腐蚀,同时也受到浪花干湿交替环境的影响。在干湿交替环境下,水分子可能会在涂层中发生扩散,引起涂层劣化,加剧涂层下金属的腐蚀[8-10]。
我国胜利海域属于低盐海域,盐度仅为10~20 PSU。因此文中针对胜利海域的海洋浪溅区干湿交替环境金属的腐蚀过程,分析了4种镀层金属(Al、Mg、Cu和Zn)在干湿交替和低氯离子浓度下的腐蚀 行为。据此优选一种适合胜利海域的金属镀层,为提出一种海洋干湿交替环境涂层-金属镀层-金属的保护体系提供借鉴。
1 实验设置
1.1 电镀
电镀用D32钢预处理:首先采用丙酮除油,去离子水清洗,无水乙醇脱水,并擦干,放入真空干燥器内干燥24 h后,备用;在进行电镀实验之前,采用#800—#1200的防水砂纸逐级打磨至表面无明显划痕,并进行抛光处理。
实验采用传统双电极电镀体系,其中阳极为纯度为99.99%的金属电极,阴极为D32钢(25 mm× 25 mm×2 mm,主要成分见表1)。溶液采用1 mol/L的对应氯盐。调整待镀试样与阳极的间距为6 cm,并保证两电极表面正对。连接完毕后,打开电镀电源,依据相应的工艺参数,在操作面板上进行参数设置,电镀电流密度为6 A/dm2。沉积过程中,由IKA公司ETS-D5型接触式温度传感器控制水浴温度恒定为50 ℃,磁力转子搅拌速度为200 r/min,占空比为40%,频率为50 Hz。电镀时间为30 min,最终形成的镀层厚度为(30±1) μm。

表1 D32钢主要成分 Tab.1 Main composition of D32 steel
1.2 电化学测试
实验溶液:采用分析纯NaCl和去离子水配置质量分数为2%的实验溶液。
干湿交替循环试样:在试样上滴5滴试验介质(2% NaCl溶液),保证试片表面均被试验介质润湿,然后使其在空气中自然干燥;12 h后,再滴下试验介质,反复操作(10 d)来模拟干湿交替过程。
电化学测试实验采用传统的三电极体系,其中工作电极为干湿交替循环试样,辅助电极为Pt电极,参比电极为SCE(饱和甘汞电极)。参比电极通过鲁金毛细管与溶液接触,其尖端与工作电极表面的距离小于2 mm(忽略溶液的IR降)。
电化学实验设置:电化学测试所用工作站为PARSTAT2273,极化曲线的扫描速率设为0.3 mV/s,扫描电位范围为±250 mV(相对于开路电位);交流阻抗谱扫描范围为105~10-2Hz,振幅为±5 mV;当开路电位(EOCP)在300 s内波动不超过±5 mV时,认为整个系统处于稳定状态,可进行交流阻抗和极化曲线测试。所有的测试均在恒温进行,实验温度为20 ℃(模拟海水平均温度)。
数据处理:电化学数据处理采用系统自带的“PowerSuite”软件和“ZSimpWin”软件。
1.3 干湿交替循环试验
开展干湿交替循环试验,分析不同镀层的耐蚀性。干湿循环试验设置如上所述,每12 h为一个试验周期,试验30 d后,除掉表面腐蚀产物,通过三维扫描显微镜测试其表面最大蚀坑深度,并计算其全面腐蚀速率。
2 结果与讨论
2.1 动力学过程分析
不同金属镀层干湿交替试样的开路电位和极化曲线测试结果如图1所示,极化曲线的拟合结果见表2,不同金属镀层试样的腐蚀电位和腐蚀电流密度比较如图2所示。

图2 不同金属镀层的试样的腐蚀电位和腐蚀电流密度 Fig.2 Ecorr and Jcorr of D32 steel with different metal coatings

表2 极化曲线拟合结果 Tab.2 Polarization curve fitting results
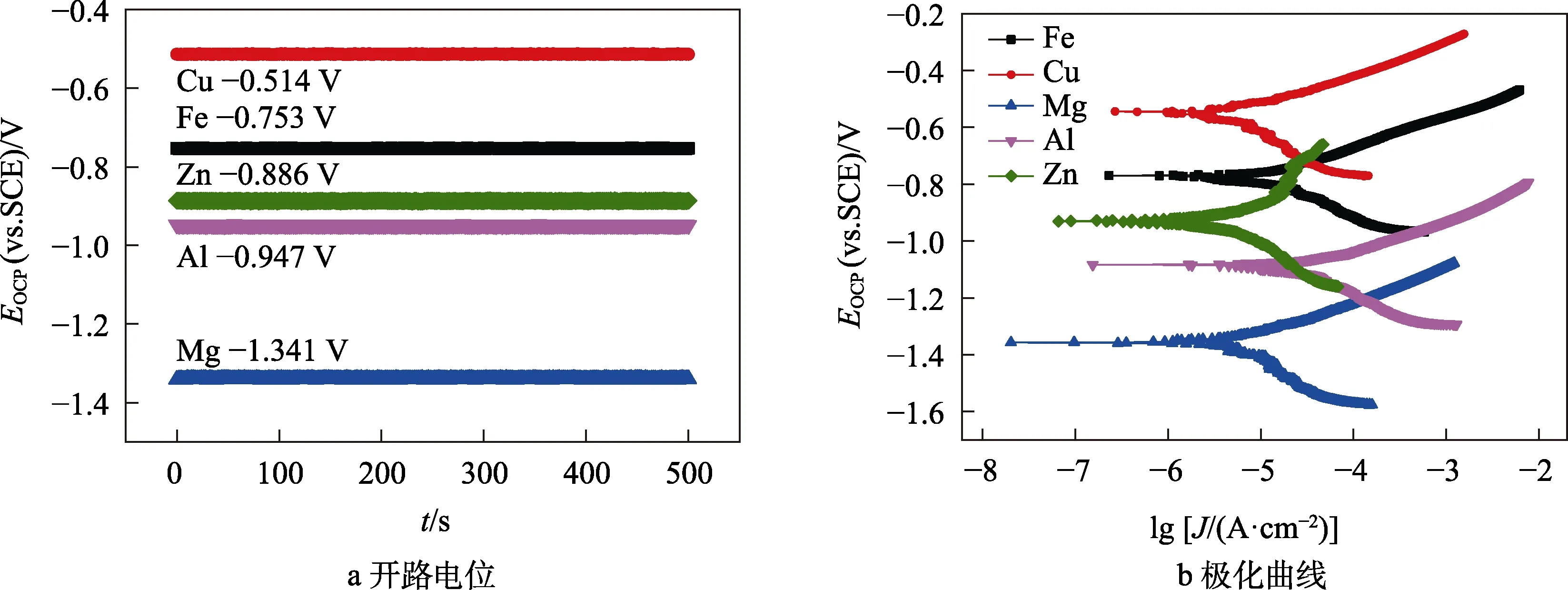
图1 不同金属镀层的试样的开路电位和极化曲线 Fig.1 (a) Open circuit potential and (b) polarization curves of D32 steel with different metal coatings
与纯铁电极相比,镀Zn/Al/Mg电极的开路电位 较负,分别为-0.886、-0.947、-1.341 V,而镀Cu电极的开路电位较正,为-0.514 V。根据极化曲线测试结果,不同金属镀层电极在Tafel区间均呈现活化腐蚀的状态,塔菲尔斜率比值均表现为阳极控制,但2个Tafel常数差别不大。镀Zn和镀Cu电极表现为较低的腐蚀电流密度,分别为4.97 μA/cm2和6.32 μA/cm2,而镀Al电极的腐蚀电流密度最大,为19.14 μA/cm2。
从不同金属的活性来说,Al为钝性金属,在干湿交替环境中,仍然极易形成致密的Al2O3钝化膜。干湿交替条件下,镀Al电极的腐蚀电流密度在5种电极中最大,高于纯Fe电极(15.01 μA/cm2)。这是因为无论在单纯的湿环境还是干环境,Al在表层都极易形成钝化膜。在文中的研究条件下,氯离子的质量分数仅为2%,而目前国际上的铝基牺牲阳极以及相关的研究结果表明,铝在不小于3.6%的含氯盐条件下才可以保持活化腐蚀状态。因此在文中引起镀Al电极腐蚀电流密度最大的主要原因是由于在干湿交替条件下,液滴在空气中自然蒸发的过程中,润湿面积与干燥面积比逐渐发生变化,在钝化膜表面形成微电池,润湿位置作为阳极,逐渐破坏腐蚀产物膜。在20个干湿循环周期内(12 h为1个周期,实验时间为10 d),致密表面膜发生破裂,表现为活化腐蚀状态。
对于镀Cu电极,首先生成CuO和Cu2O。在含有氯离子的条件下,Cu2O溶解生成Cu2+,最终主要形成疏松腐蚀产物Cu2Cl2(OH)3(Cu→Cu2O→Cu2+→Cu2Cl2(OH)3)。Cu2Cl2(OH)3不导电,表现为较好的电绝缘性,因此其腐蚀电流密度较小,但是由于其结构疏松,容易促进氯离子扩散引发点蚀。
对于镀Mg电极,其电负性最低,为-1.36 V(vs. SCE),表面镀层金属活性最大,但是其腐蚀电流密度为10.66 μA/cm2,小于纯铁电极和镀Al电极,而大于镀Zn电极和镀Cu电极。这是由于金属Mg的腐蚀活性最大,初期的腐蚀速率较快,能够在电极表面快速形成大量的腐蚀产物。从Tafel斜率比值可以看出,镀Mg电极最大,说明此时电极腐蚀过程受到阳极离子扩散过程控制,因此腐蚀电流密度相对较低。
对于镀Zn电极,相关研究表明,在大多数自然环境中,锌的腐蚀速率只有钢的1/10~1/100[11-12]。在干湿交替的环境中,文中研究结果表明,镀层电极是铁电极腐蚀速度的1/3,并且在锌镀层受破坏而铁暴露的地方,锌涂层与钢基体之间的电偶作用能提供额外的保护[13-14]。这一特性是镁镀层[15]和铝镀层[16-17]所不具备的。
不同金属镀层干湿交替试样的电化学阻抗测试结果如图3所示,电化学阻抗等效电路拟合结果见表3,不同金属镀层的试样的拟合参数比较如图4所示。
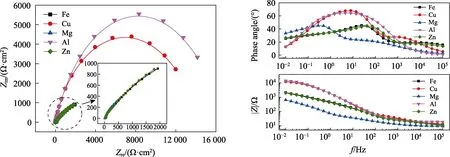
图3 不同金属镀层的试样的电化学阻抗曲线 Fig.3 EIS curves of D32 steel with different metal coatings
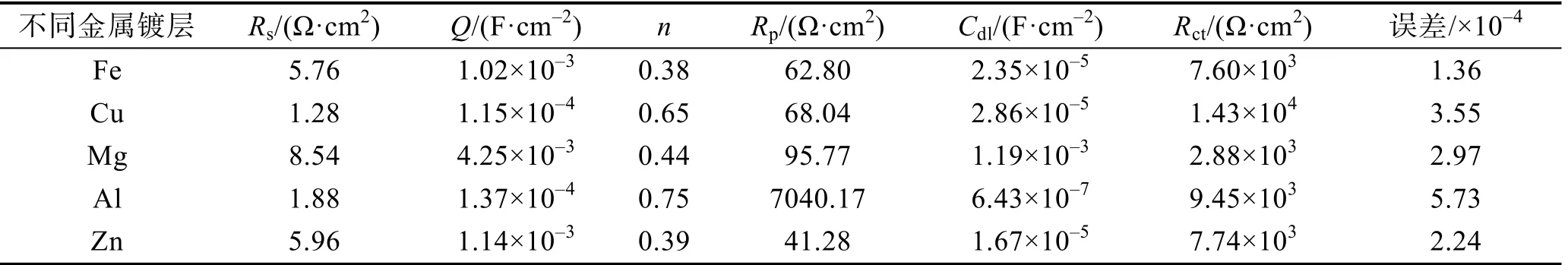
表3 等效电路拟合参数结果 Tab.3 Equivalent circuit fitting parameter results
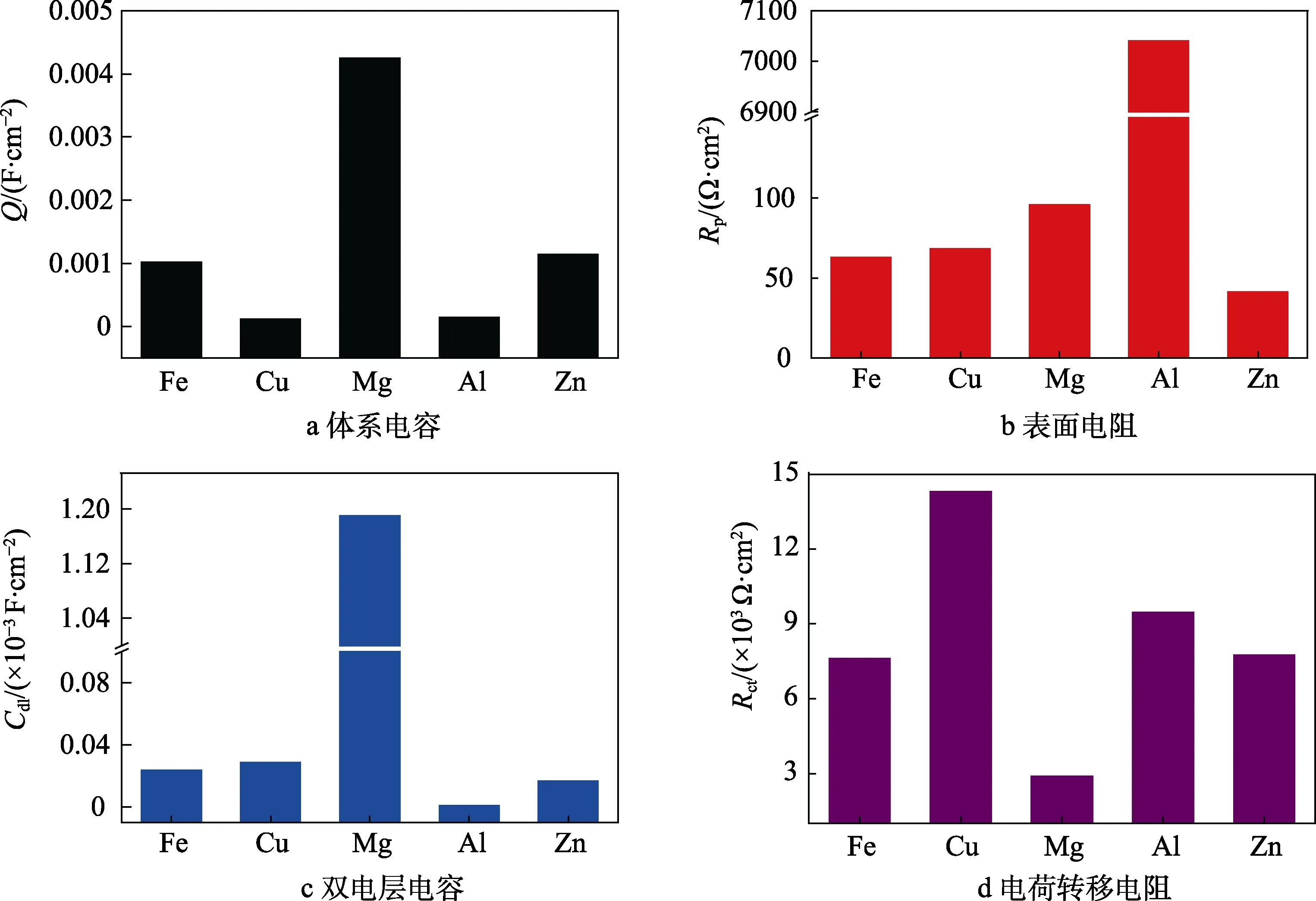
图4 不同金属镀层的试样的电化学阻抗拟合结果比较 Fig.4 Comparison of Fitted results of D32 steel with different metal coatings: a) system capacitance; b) surface resistance; c) double layer capacitance; d) charge transfer resistance
从不同金属镀层干湿交替试样的Bode图(lgf-φ曲线)中可以看出,不同金属镀层试样均表现为2个峰值,即存在2个时间常数,考虑到金属的电化学腐蚀过程,因此选择等效电路为Rs(Q(Rp(CdlRct))):Rs为溶液电阻,Q为体系电容,Rp为表面电阻,Cdl为双电层电容,Rct为电荷转移电阻。
在 Nyquist图中,容抗弧半径rAl>rCu>rZn≈rFe>rMg,同时镀Zn电极和纯Fe电极的Nyquist曲线基本重合,而镀Zn电极、纯Fe电极和镀Mg电极的高频区基本重合。从电化学阻抗拟合参数可以看出,镀Al电极的表面反应电阻最大(Rp=7040.17 Ω·cm2),而其电荷转移电阻远小于镀Cu电极,与镀Zn电极和纯Fe电极接近。这是因为虽然Al容易生成致密钝化膜(Rp较大),而干湿交替环境引发的点蚀也促进了金属本身的活化过程(Rct较小)[18]。在5种金属中,由于Mg的电化学活性最大,因此双电层电容最大(Cdl=1.19×10-3F/cm2),电荷转移电阻最小(Rct=2.88×103Ω·cm2),表面电阻(Rp=95.77Ω·cm2)远小于镀Al电极,而略大于其他3种电极。这是由于电化学反应较快,腐蚀产物在电极表面大量聚集造成的。从电化学反应过程来看,上述5种电极中,镀Cu电极的电荷转移电阻最大(Rct=1.43×104Ω·cm2),即腐蚀阻力最大。这是由于表面聚集的Cu腐蚀产物不导电,阻碍了电子的转移过程,因此抑制了腐蚀反应过程。
2.2 腐蚀速率及腐蚀图像分析
开展30 d的干湿循环试验,实验结束后,清除表面腐蚀产物,计算全面腐蚀速率;通过三维扫描显微镜测试最大蚀坑深度,计算点蚀速率,结果如图5所示。

图5 不同金属镀层的试样的全面腐蚀速率和点蚀速率 Fig.5 Total corrosion rate and pitting corrosion rate of D32 steel with different metal coatings
从全面腐蚀速率结果来看,镀Mg电极>纯Fe电极>镀Zn电极>镀Cu电极>镀Al电极。这是因为在5种金属中,Mg的腐蚀活性最高,因此其全面腐蚀速率最大,而Al由于钝化特性,表面致密腐蚀产物膜阻碍了全面腐蚀过程[19-20]。从点蚀速率来看,镀Al电极>镀Cu电极>镀Zn电极>纯Fe电极>镀Mg电极。这是因为镀Al电极表面形成了致密钝化膜,在干湿交替和低氯离子浓度下,发生了明显的点蚀行为,因此在5种电极中其点蚀速率最大。对于镀Cu电极来说,一方面,Cu的腐蚀产物表现为较好的电绝缘性,疏松腐蚀产物层容易吸收氯离子进入,由此引发了基体的点蚀现象。另一方面,镀层破损,由于Cu的电位较正,形成Cu-Fe电偶腐蚀促进了点蚀过程。对于Fe、Mg和Zn等3种金属,在干湿交替和氯离子环境下表现为活化腐蚀状态,因此3种电极在文中的实验条件下点蚀速率基本相等(Mg 0.96 mm/a,Zn 1.02 mm/a,Fe 1.00 mm/a)。
3 结论
文中分析了5种金属镀层在低氯离子和干湿交替环境下的腐蚀特征,确定海洋干湿交替环境下D32钢的最佳金属镀层,主要得到以下结论:
1)从电化学测试结果可以看出,在干湿交替(10 d,20个循环)和低氯离子浓度下(质量分数为2%)下,5种电极均表现为活化腐蚀状态,均为阳极控制状态。4种金属镀层腐蚀电位:镀Cu电极<镀Zn电极<镀Al电极<镀Mg电极;腐蚀电流密度:镀Zn电极<镀Cu电极<镀Mg电极<镀Al电极。同时,相比于镀Al电极和镀Mg电极来说,镀Cu电极表面腐蚀产物具有电绝缘性,镀Zn电极能够提供阴极保护的作用,可以优先考虑用于海洋干湿交替环境中。
2)通过60个干湿循环周期分析5种电极的腐蚀形态,全面腐蚀速率:镀Al电极<镀Cu电极<镀Zn电极<镀Mg电极;点蚀速率:镀Mg电极<镀Zn电极<镀Cu电极<镀Al电极。考虑到电极一旦发生点蚀,失效过程将大大加快,同时考虑到镀Zn电极的阴极保护作用,因此在海洋低盐度干湿交替环境下,D32钢可采用镀Zn方法来进行保护。
