一株强抑菌活性植物乳杆菌的分离及益生性能研究
2021-07-04曹海鹏徐兴娜文小飞
曹海鹏,徐兴娜,文小飞
(贵州师范大学 生命科学学院,贵州 贵阳 550001)
抗生素作为饲料添加剂曾为规模化养殖业的快速发展做出了巨大贡献。但由于抗生素的长期不合理使用,导致了一系列问题,如肉制品及排泄废水抗生素残留超标,严重危害人类及其他动物健康;致肠道菌群失调及产生细菌耐药性等,使动物机体免疫力下降,易引发内源性感染和一系列的公共安全问题。基于此,欧盟已于2006年规定全面禁止在动物饲料中添加任何抗生素,日本和美国在饲用抗生素种类及使用方面也做了极严格的限制[1]。此外,抗生素在肉制品中的残留,常被设为进出口贸易中的壁垒[1]。因此,在养殖业中急需寻找安全、有效的抗生素替代品。
益生菌能通过肠道占位、产生抑菌物质及整合肠道菌群等功能来维持肠道健康、减少疾病的发生,在预防及治疗细菌性疾病方面具有一定的优势[2]。乳酸菌是研究和应用最多的益生菌,其是人和动物肠道的优势菌群,具有抑制致病菌的生长、调节肠道菌群平衡、促进食物消化和营养吸收、刺激肠道黏膜免疫、佐剂效应等多种生理功能[3]。LHTEINEN T等[4]研究发现,使用乳酸杆菌饲喂仔猪,可有效地增加仔猪的体质量并改善仔猪的健康。屎肠球菌可增加母猪采食量,降低母猪哺乳期间的失重幅度,还可以降低仔猪因感染细菌性疾病导致的腹泻率与死亡率[5-6]。然而,目前大多数研究及应用的乳酸菌并非源自肠道,其在肠道内的定植及存活时间有待考究。为解决这一问题,国内一些学者试图从猪的粪便中分离出具有益生功能的乳酸菌,发现猪源乳酸菌在一定水平能促进仔猪的生长,并降低细菌性疾病的感染率和致死率[7]。然而,猪的肠道和粪便所处的生理环境不同,致其微生物菌群结构差异。此外,乳酸菌不耐高温,在饲料和食品添加中实际应用受限,而乳酸菌产生的细菌素具有分子质量低、耐高温、抑菌效果显著等特点。但是,细菌素通常更有利于抑制阳性菌,对大肠杆菌和沙门氏菌等肠道阴性菌的抑制效果较差[8]。因此,分离和筛选具有广谱抑菌效果的肠道源乳酸菌,并研究其益生功能及抑菌物质的稳定性仍具有重要的研究意义。
该研究拟从健康猪肠道黏膜中分离和筛选出具有较强广谱抑菌效果的乳酸菌,并研究其益生功能和抑菌物质的稳定性,旨在为微生态制剂以及抗菌素产品的开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
新鲜采取的健康成年黔北黑猪的猪肠道黏膜内容物:贵州省毕节市偏远山区散养猪。饲养期间从未饲喂过任何成品饲料、活菌制剂或抗生素。
1.1.2 指示菌
金黄色葡萄球菌(Staphylococcus aureus)ATCC6538、大肠埃希氏菌(Escherichia coli)ATCC25922和鼠伤寒沙门氏菌(Salmonella typhimurium)ATCC14028:上海鲁微科技有限公司。
1.1.3 试剂
2×脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶链反应(polymerase chain reaction,PCR)混合物、DNA显色剂Gold-ViewTM:全式金生物技术有限公司;药敏纸片:杭州微生物试剂有限公司;胃蛋白酶、胰蛋白酶、过氧化氢酶:都莱生物技术公司;其他化学试剂均为国产分析纯。
1.1.4 培养基
MRS液体培养基:蛋白胨10.0 g,酵母膏10 g,牛肉膏10 g,吐温80 1.0 mL,葡萄糖20.0 g,柠檬酸氢二铵2.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,七水硫酸镁0.58 g,硫酸锰0.25 g,蒸馏水1 000 mL,pH 6.2~6.6,121 ℃高压灭菌20 min。
改良MRS培养基:固体MRS培养基中加0.05%的碳酸钙,121 ℃高压灭菌20 min[9]。
液体LB培养基:蛋白胨10.0 g,酵母粉5.0 g,氯化钠10.0 g,水1 000 mL,121 ℃高压灭菌20 min[9]。
人工胃液:氯化钠0.2 g,胃蛋白酶1.0 g,用pH 2.0的100 mL盐酸水溶液稀释,充分溶解后,用微孔滤膜过滤除菌,4 ℃保存备用[10]。
人工肠液:磷酸二氢钾0.68 g,蒸馏水溶解,以浓度为0.1 mol/L的氢氧化钠溶液调pH至8.0,另取胰蛋白酶1.0 g加适量水使其溶解,将两液混合后加水定容至100 mL,用微孔过滤膜过滤除菌,4 ℃保存备用[10]。
固体培养基在液体培养基基础上加1.5%的琼脂。
1.2 仪器与设备
JA1003电子天平:唐山力辰科技有限公司;DH6000B电热恒温培养箱:天津市泰斯特仪器有限公司;XMTA-7000智能恒温干燥箱:上海景迈仪器设备有限公司;XSP-06光学显微镜:湖北省潜江市教学仪器厂;THZ-82A双数显旋转气浴振荡器、TGL-16A高速离心机:金坛市城东新瑞仪器厂;SW-CJ-1G单人净化工作台:上海苏净净化工作台;FE20 pH计:深圳市科力易翔仪器设备有限公司;WD-9402B/D非医用基因扩增仪:北京六一生物科技有限公司;HVE-50高压蒸汽灭菌锅:日本HIRAYAMA公司。
1.3 实验方法
1.3.1 菌株分离
分段取被宰杀猪的肠道,用消毒过的解剖剪剪开,小心剔除肠道内容物,并用酒精消毒过的解剖刀小心刮取肠道黏膜附属物,收集于5 mL的无菌离心管中。取1 g黏膜附属物样品于9 mL灭菌生理盐水中,充分振荡混匀,并取1 mL样品依次稀释至10-2、10-3、10-4、10-5、10-6及10-7等。分别取10-3、10-4、10-5、10-6及10-7等梯度样品各200 μL,均匀涂布于改良MRS平板中,并置于厌氧培养罐中(使用厌氧产气袋除氧),37 ℃静置培养48 h。从稀释度较高的两组平板中挑取40个具有乳白色、高圆隆、边缘整齐且溶钙圈较大等典型乳酸菌特征的菌落,进一步平板划线培养至分离出形态特征均一的单菌落。将各单菌落菌株转接于MRS斜面培养基中,编号、培养和镜检,筛选出接触酶阳性、过氧化氢酶阴性的革兰氏阳性菌,于4 ℃保藏备用[7,11-12]。
1.3.2 菌液制备
将上述分离的所有斜面菌株分别转接入10 mL MRS液体种子培养基中,37 ℃、150 r/min振荡培养24 h。取1 mL种子液转接于100 mL MRS液体培养基中,37 ℃、150 r/min振荡培养24 h。取50 mL发酵液,8 000 r/min离心5 min,收集上清液,并置于4 ℃备用。
取指示菌金黄色葡萄球菌ATCC6538、大肠埃希氏菌ATCC25922和鼠伤寒沙门氏菌ATCC14028的甘油种子,经固体LB平板活化后转接入液体LB种子培养基中,37 ℃、180 r/min培养24 h。取1 mL种子液转接于100 mL LB液体培养基中,37 ℃、180 r/min振荡过夜培养,菌液置于4 ℃备用。
1.3.3 抑菌性能筛选
取200 μL稀释100倍的各指示菌菌液,分别均匀涂布于15 mL LB固体平板(直径为9 cm)中。每皿等距离放入两只6 mm内径的牛津杯,杯中分别加入200 μL的乳酸菌发酵液和上清液,置于37 ℃恒温培养箱过夜培养。采用游标卡尺测量各菌抑菌圈直径,筛选出对三种指示菌抑菌效果最好的菌株做后续试验[11]。
1.3.4 16S rDNA鉴定
以平板划线分离的筛选菌株的单菌落为模板,细菌通用引物27F和1492R为引物,加入一定量的2×TaqPCR mix进行细菌16S rDNA PCR扩增。扩增条件为:98 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30次循环;72 ℃再延伸5 min。琼脂糖凝胶电泳验证后,PCR产物送至上海生工生物工程有限公司进行序列分析。将所测的16S rDNA序列经局部序列比对检索基本工具(basic local alignment search tool,BLAST)比对(http://www.ncbi.nlm.nih.gov/blast/)[13],并采用MEGA 7.0软件的邻近法(neighbor joining,NJ)构建系统发育树,分析并确定菌株种类。
1.3.5 抑菌性能与培养时间的关系
取上述筛选出的最佳抑菌菌株液体种子,按1%比例接入200 mL MRS液体培养基中,37 ℃、150 r/min振荡培养。期间分别取0 h、4 h、8 h、12 h、16 h、20 h、24 h的样品各5 mL,及剩余发酵液一并8 000 r/min离心5 min,收集上清液,检测各时间点上清液pH值,将剩余样品置于-20 ℃备用。参照1.3.3所述进行抑菌试验,结束后观察并统计各时间点发酵上清液的抑菌圈直径[11]。
1.3.6 高温对抑菌活性的影响
将上述制备的上清液分装5 mL至25 mL试管中,分别置于40 ℃、60 ℃、80 ℃、100 ℃、120 ℃下处理30 min,并用纯净水补足5 mL,各取200 μL处理液进行抑菌试验(参照1.3.3)。结束后观察并统计各时间点发酵上清液的抑菌圈直径及其随时间温度变化关系[14]。
1.3.7 过氧化氢酶、胃蛋白酶及胰蛋白酶对抑菌活性的影响
将发酵上清液分成四组,将其中两组pH调至7.0和8.0,分别加入1 mg/mL过氧化氢酶和胰蛋白酶;一组pH调至2.0,加入1 mg/mL胃蛋白酶,余下一组对照。四组均置于37 ℃下水浴处理60 min,再于80 ℃条件下水浴处理60 min对酶灭活。将pH 调回到原发酵液值,与对照组一同做抑菌试验[14]。
1.3.8 药敏试验
参照1.3.2制备分离菌株菌液,取200 μL菌液涂布于MRS平板中,小心放置氨苄西林、庆大霉素、头孢唑啉、四环素、丁胺卡那、环丙沙星、氯霉素、青霉素、复方新诺明、诺氟沙星及红霉素11种抗生素药敏纸片,每个纸片的间距不小于24 mm。其中,氨苄西林、庆大霉素、青霉素和诺氟沙星每片10 μg,头孢唑啉、四环素、丁胺卡那和氯霉素每片30 μg,环丙沙星每片5 μg,复方新诺明每片23.75 μg,红霉素15 μg。静置培养24 h后以测量并统计抑菌圈直径,分析其耐药性[11]。
1.3.9 耐酸、耐胆盐及模拟胃肠液试验
参照1.3.2制备分离菌株菌液,经pH 6.8磷酸盐缓冲液(phosphate balanced solution,PBS)清洗后重悬于等体积的PBS中,并分别取400 μL接种于8 mL pH 2.0、0.3%猪胆盐液体MRS培养基及模拟人工胃肠液中,37 ℃静置培养,取处理0 h、2 h、4 h、6 h的菌液稀释涂布于改良MRS平板,并置于厌氧培养罐中,37 ℃静置培养36 h。从稀释度较高的平板中统计菌落总数,计算存活率[10,15],其计算公式如下:

式中:R为存活率,%;B为处理之前的活菌数,CFU/mL;A为处理之后的活菌数,CFU/mL。
1.3.10 数据分析
以上数据采用Excel 2017文档进行分析、处理与制图。实验数据为3次重复均值。
2 结果与分析
2.1 菌株分类结果
分离菌株的菌落形态见图1。由图1可知,所有分离的40株菌的菌落特征均为乳白色、高隆起、边缘整齐,产酸能力强且有乳香味,革兰氏镜检结果为紫色阳性杆菌,且理化检测结果显示其均为接触酶阳性、过氧化氢酶阴性菌(为乳酸菌典型理化特征)。结合以上特征可以初步判断分离菌株为乳酸菌。
图1 分离菌株的菌落形态Fig.1 Colony morphology of isolated strains
2.2 具有抑菌性菌株的筛选结果
以培养24 h的乳酸菌发酵液和其离心上清液为研究对象,以金黄色葡萄球菌ATCC6538、大肠埃希氏菌ATCC25922和鼠伤寒沙门氏菌ATCC14028为指示菌进行抑菌试验,筛选出1株对3种指示菌均有最佳抑菌效果的乳酸菌,并将其编号为R-21,抑菌效果见图2。由图2可知,菌株R-21发酵液对3种指示菌的抑菌直径分别约为45.2 mm、23.1 mm和36.5 mm,其上清液对3种指示菌的抑菌直径分别约为44.7 mm、23.1 mm和31.8 mm。

图2 菌株R-21的抑菌效果Fig.2 Bacteriostatic effect of strain R-21
2.3 16S rDNA鉴定结果
将菌株R-21的PCR产物测序序列提交GenBank数据库中进行BLAST比对(http://www.ncbi.nlm.nih.gov/blast/),结果显示菌株R-21的16S rDNA序列与数据库中的Lactobacillus plantarumLPL24的同源率大于99%。选取同源性较高乳酸菌的16S rDNA序列,采用NJ法构建系统发育树,结果见图3。由图3可知,菌株R-21与植物乳杆菌(Lactobacillus plantarum)聚于一支,亲缘关系最近。结合菌株的菌落特征,鉴定该菌株为植物乳杆菌(Lactobacillus plantarum)。

图3 菌株R-21基于16S rDNA序列的系统发育树Fig.3 Phylogenetic tree of strain R-21 based on 16S rDNA sequences
2.4 抑菌性能与培养时间的关系
取植物乳杆菌R-21的液体种子,按照1%接种量接入MRS液体培养基中,分别取0 h、4 h、8 h、12 h、16 h、20 h、24 h的样品,离心后检测发酵上清液pH及抑菌活性,其pH及对金黄色葡萄球菌ATCC6538、大肠埃希氏菌ATCC25922和鼠伤寒沙门氏菌ATCC14028等指示菌的抑菌圈直径随培养时间变化关系见图4。

图4 植物乳杆菌R-21抑菌效果与发酵液pH随时间变化Fig.4 Change of bacteriostatic effect and pH during culture process of Lactobacillus plantarum R-21
由图4可知,植物乳杆菌R-21经过150 r/min振荡培养24 h,其发酵液的初始pH由5.4降至3.2(种子培养液的加入导致0 h培养基pH由6.4降至5.4),并有继续下降的趋势,说明其有较强的产酸能力;植物乳杆菌R-21培养至12~20 h时,其上清液对金黄色葡萄球菌ATCC6538抑菌活性最强,抑菌圈直径在43 mm以上,在16 h时抑菌圈直径最大,之后呈下降趋势,说明其抑菌能力强弱不完全取决于产酸性能,与酸性物质之外其他产物有关;对大肠埃希氏菌ATCC25922和鼠伤寒沙门氏菌ATCC14028的抑菌圈直径均随培养时间延长而增加,24 h时的最大值抑菌圈直径分别达22.7 mm和32.1 mm,之后仍有上升趋势,与pH变化对应,表明菌株R-21对大肠杆菌和沙门氏菌的抑菌能力可能主要取决于发酵过程中产生的酸性物质。
2.5 高温对抑菌活性的影响
将上述制备的培养24 h的植物乳杆菌R-21发酵上清液5 mL分别置于40 ℃、60 ℃、80 ℃、100 ℃及120 ℃下处理30 min,冷却后用纯净水补至原体积,各取200 μL处理液进行抑菌试验,其对上述三种指示菌的抑菌圈直径影响见图5。

图5 不同温度处理下植物乳杆菌R-21发酵上清液抑菌活性变化Fig.5 Change of bacteriostatic activity of supernatant fermented by Lactobacillus plantarum R-21 after treatment under different temperature
由图5可知,菌株R-21发酵上清液中的抑菌物质对高温有较强的抵抗力,120 ℃处理30 min,上清液对大肠埃希氏菌ATCC25922和鼠伤寒沙门氏菌ATCC14028的抑菌圈直径基本无变化(P>0.05),只对金黄色葡萄球菌ATCC6538的抑菌直径有所降低(由42.1 mm降至39.1 mm)。表明植物乳杆菌R-21发酵液物质具有极强的热稳定性,与路春波等[14]的研究结果一致,其发酵液抑菌物质适用于需高温处理的食品及饲料添加剂[16-17],具有较高的研究和应用潜力。
2.6 过氧化氢酶、胃蛋白酶及胰蛋白酶对抑菌活性的影响
乳酸菌发酵液的主要抑菌成分是有机酸、活性肽和过氧化氢,其中过氧化氢在一定条件下可以被过氧化氢酶分解,活性肽可被胃蛋白酶或胰蛋白酶分解而失去活性。为验证抑菌物质的成分属性,本研使用过氧化氢酶、胃蛋白酶及胰蛋白酶对发酵上清液处理1 h后,将其pH调回原发酵液值并将酶蛋白灭活后到进行抑菌试验,试验结果见图6。

图6 不同酶处理下植物乳杆菌R-21发酵上清液抑菌活性变化Fig.6 Change of bacteriostatic activity of supernatant fermented by Lactobacillus plantarum R-21 under different enzyme treatment
由图6可知,植物乳杆菌R-21发酵上清液中抑菌活性物质受过氧化氢酶和胃蛋白酶影响较小(P>0.05),主要受胰蛋白酶影响。经1 mg/L胰蛋白酶处理后,对金黄色葡萄球菌ATCC6538的抑菌效果影响最大,抑菌直径由42.4 mm降至28.2 mm;对大肠埃希氏菌ATCC25922和鼠伤寒沙门氏菌ATCC14028的抑菌效果也有一定影响,抑菌直径分别由21.8 mm和30.0 mm降至17.6 mm和25.7 mm。以上试验结果表明,抑菌物质主要成分是多肽类和有机酸,而非过氧化氢,其中活性肽可被胰蛋白酶分解而失去活性,进而降低上清液的抑菌效果[14,17-18]。而活性肽在防治多重抗生素耐药性细菌性疾病方面具有一定研究意义[19-20]。
2.7 药敏试验结果
使用氨苄西林、庆大霉素、头孢唑啉、四环素、丁胺卡那、环丙沙星、氯霉素、青霉素、复方新诺明、诺氟沙星及红霉素11种抗生素药敏纸片对植物乳杆菌R-21做抑菌试验,结果见图7。由图7可知,菌株R-21对头孢唑啉、环丙沙星、复方新诺明和诺氟沙星四种抗生素耐药,对氨苄西林、氯霉素和红霉素等最为敏感(药敏直径均>23 mm)。乳酸菌多重耐药机制普遍存在,从生物安全角度来说,这类菌存在耐药基因转移等风险,但耐药基因的存在也为研究乳酸菌在体内存在部位、数量、时间及定植等提供了便利[21-22]。
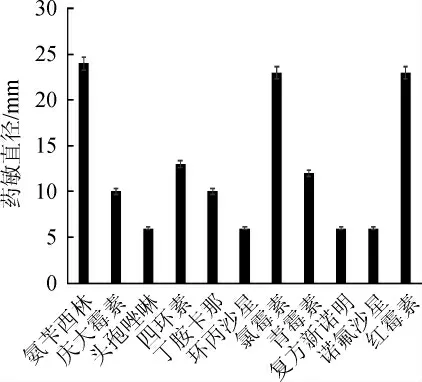
图7 植物乳杆菌R-21的药敏试验结果Fig.7 Susceptibility of Lactobacillus plantarum R-21 to antibiotics
2.8 耐酸、耐胆盐及模拟胃肠液试验结果
人和哺乳动物的胃消化道环境是酸性的,在空腹时胃消化液pH一般低于2.0,且含有多种消化酶,对细菌有一定杀灭和抑制作用;肠道内含有0.03%~0.3%胆盐和胰蛋白酶等,同样对经过的细菌具有抑制作用。乳酸菌作为肠道益生菌需要对低pH、胆盐及各种消化酶具有一定的抵抗力,以确保其能顺利通过酸性胃消化道,并进入肠道,在肠道内定植及发挥发挥益生功能[23]。本研究在对植物乳杆菌R-21进行耐酸性、耐胆盐试验之前曾做过预实验,发现其能在pH 3.0以上或0.2%猪胆盐浓度以下的培养基中增殖。因此,此处选择pH 2.0、0.3%猪胆盐浓度的MRS液体培养基,及相应的模拟胃、肠液进行处理,检测其在0、2 h、4 h及6 h时的残留活菌数,活菌数对数值如图8。

图8 植物乳杆菌R-21的耐酸、耐胆盐及模拟胃肠液试验结果Fig.8 Resistance results to acid,bile salt,and simulated gastrointestinal fluid of Lactobacillus plantarum R-21
由图8可知,植物乳杆菌R-21在pH 2.0下处理时的活菌数随时间逐渐下降,但在6 h时其对数值仍高达5.60,存活率为0.06%;经0.3%猪胆盐处理时,前4 h菌株活菌数对数值变化较小,4~6 h迅速下降,6 h时较初始值降低2.2(存活率为0.61%);经模拟胃液、肠液处理6 h时,菌株活菌数对数值变化较小,分别相较初始对数值仅减少0.40和0.59,存活率分别为40.80%和25.65%。表明菌株R-21对低pH强酸、猪胆盐的耐受性好,基本不受胃、肠消化酶的影响,具有较强的益生特性,为其经过胃肠消化道并在肠道定植、发挥益生活性提供了必要条件。
3 结论
本研究以未施用过抗生素的健康成年黔北黑猪的肠道黏膜内容物为原料,以金黄色葡萄球菌ATCC6538、大肠埃希氏菌ATCC25922和鼠伤寒沙门氏菌ATCC14028为指示菌,从中筛选出1株具有极强抑菌效果的乳酸菌,并对其进行分子鉴定,结果显示该分离菌株属于植物乳杆菌(Lactobacillus plantarum),并将其命名为植物乳杆菌R-21。其所产抑菌物质稳定性强,在酸性条件下120 ℃处理30 min后抑菌活性基本无变化,表明其适用于需高温处理的食品与饲料添加。酶蛋白处理时,过氧化氢酶与胃蛋白酶处理的发酵上清液抑菌活性基本无变化,而胰蛋白酶处理的活性明显减弱,说明主要抑菌物质不含过氧化氢,而含对胰蛋白酶敏感的活性多肽。耐受性试验中,植物乳杆菌R-21展示出对低pH、0.3%胆盐及模拟胃肠液有极强的抵抗力,连续处理6 h仍保持较高的存活率,有助于其顺利通过胃、肠消化道,利于菌株在肠道内存活、定植或增殖,进而发挥抑菌活性。该研究筛选出一株具有较强抑菌活性的植物乳杆菌R-21,其强酸、胆盐等具有良好的耐受性,在微生态制剂研究和应用方面具有较高的价值;其所产抑菌物具备耐高温性能,适用于需高温处理的食品及饲料加工等;抑菌物质对胰蛋白酶敏感,说明其含有活性肽成分。
