罗哌卡因纳米粒的制备及镇痛研究
2021-07-03刘江王艺娇赵健辉王雪梅刘占军华北理工大学药学院河北唐山06320唐山工人医院麻醉科河北唐山063000
刘江,王艺娇,赵健辉,王雪梅,刘占军*(.华北理工大学药学院,河北 唐山 06320;2.唐山工人医院麻醉科,河北 唐山 063000)
罗哌卡因(ropivacaine,RVC)是一种新型酰胺类局部麻醉药,广泛用于各种临床手术和其他急性和慢性疼痛。RVC皮下注射的镇痛作用时间一般为6 h,为了延长镇痛时间,必须持续给药,增加了不良反应发生率和给药负担,为此开发长效且安全的局部麻醉药十分重要。
海藻酸钠(sodium alginate,SA)是一种水溶性的天然多聚糖,无毒,可降解,无免疫反应,生物相容性好[1-4],适合应用为乳化增稠剂、稳定剂、乳化剂、抗原、酵素、微生物和基因的载体等[5]。SA具有较强的亲水性,但机械性能较差,载药量较低且存在药物突释,因此用作药用载体时需要对其进行修饰改性。
丙烯酸类均聚物和共聚物具有很好的生物相容性,广泛用作药用辅料,如肠溶包衣材料,缓释控释制剂中水凝胶型骨架材料和黏膜黏附片剂等[6]。聚甲基丙烯酸甲酯[poly(methyl methacrylate),PMMA]具有很强的疏水性,与疏水性药物具有亲和作用,在控释制剂或缓释制剂载体中适合用作疏水链段。SA与PMMA接枝纳米粒(nanoparticles,NP),可延长药物作用时间,促进药物吸收。
本研究拟采用RAFT法,在SA上接枝PMMA,然后负载RVC制备SA-g-PMMA纳米粒(RVC/SAg-PMMA NP),通过红外光谱、热稳定性及形态、粒径分布等考察其材料性能,研究载药、药物释放及在昆明小鼠体内的镇痛作用。
1 材料
1.1 试药
罗哌卡因盐酸盐(中国食品药品检定研究院,含量:94.5%,批号:100866-201302);甲基丙烯酸甲酯(MMA)(分析纯,天津致远化学试剂有限公司,重蒸后使用);SA(分析纯,天津市兴复精细化工研究所);偶氮二异丁腈(分析纯,北京化学试剂公司);N,N-二环己基碳二亚胺(DCC)、4-二甲氨基吡啶(DMAP,分析纯)(上海阿拉丁试剂有限公司);乙腈(色谱纯,国药集团化学试剂);三硫代碳酸二酯(根据文献自制[7]);其他化学试剂均为分析纯。
1.2 动物
昆明小鼠,雌雄各半,体质量(25±2)g [华阜康SCXK(京)2014-0004,华北理工大学动物实验中心购买],自由进食、饮水(净化水),喂小鼠专用饲料。
1.3 仪器
Nano ZS90激光粒度分析仪(英国马尔文仪器公司);EXSTAR series TG/DTA7200 热重分析仪(日本SII Nano Technology Inc 公司);H-7650型透射电镜(日本Hitachi公司);1100型高效液相色谱仪(美国Agilent公司);FTIR-8400S型傅里叶变换红外光谱仪(日本Shimadzu公司);MD10-14型透析袋(截留相对分子量1400)(北京瑞达恒辉科技发展有限公司)。
2 方法及结果
2.1 SA-g-PMMA NP的制备
NP及SA-g-PMMA NP的制备结合文献方法进行改进[7-8],基本步骤如下:SA按文献方法[9]降解,达到10~15 kDa。在反应器中依次加入1.6 g MMA,0.04 g三硫代碳酸二酯,0.003g偶氮二异丁腈和30 mL苯,通入N2除去反应器中的氧气,持续30 min,于70℃条件下反应20 h。于冰水混合物中冷却至室温,用丙酮沉淀出PMMA大分子链转移剂。以DCC为脱水剂,DMAP为催化剂,反应器中加入SA、大分子链转移剂、DMAP、DCC,在20 mL二氯甲烷中常温反应24 h。在丙酮中沉淀产物,干燥后得到SA-g-PMMA接枝共聚物。SA-g-PMMA接枝共聚物直接与适量纯净水混合,自组装成SA-g-PMMA NP。接近饱和的RVC盐酸盐中,在常温下,滴加氨水,直至稍过量,并不断搅拌,去离子水洗涤沉淀,在50℃恒温干燥,得到RVC游离碱。将SA-g-PMMA和RVC游离碱充分混合均匀,常温下溶于去离子水中,通过自组装得到RVC/SA-g-PMMA NP。
2.2 制剂的表征
2.2.1 红外光谱 采用KBr压片法:样品与光谱纯KBr研磨混合后,加压20 MPa,3 min后取出,室温条件下测定4000~400 cm-1光谱,结果见图1。SA-g-PMMA NPs出现特征吸收峰:1731.8 cm-1处为羰基C=O的伸缩振动吸收峰。在SA上3328.7 cm-1为-OH伸缩振动吸收峰,286.9 cm-1为C-H伸缩振动吸收峰,1602.4 cm-1和1425.1 cm-1分别为COO-不对称和对称伸缩振动吸收峰,1158.5 cm-1和1011.9 cm-1为C-O-C(环)骨架振动[10]。在形成接枝物后,SA-g-PMMA NP上的各吸收峰值,因化学环境的变化都稍有变化,证明了PMMA成功接枝到了SA上。图1c为RVC/SA-g-PMMA NP,-OH吸收峰明显变宽,是由于RVC上的-NH和=O与SA结合成氢键,其他吸收峰变化不大。
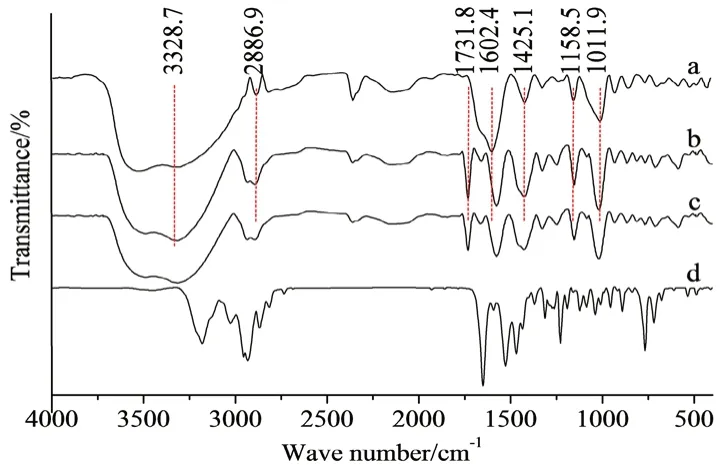
图1 红外光谱图Fig 1 FTIR spectra
2.2.2 热分析 样品的热重分析采用TGA仪器进行,样品从室温条件以10℃·min-1匀速升温至650℃,采用氮气保护。TGA曲线见图2。
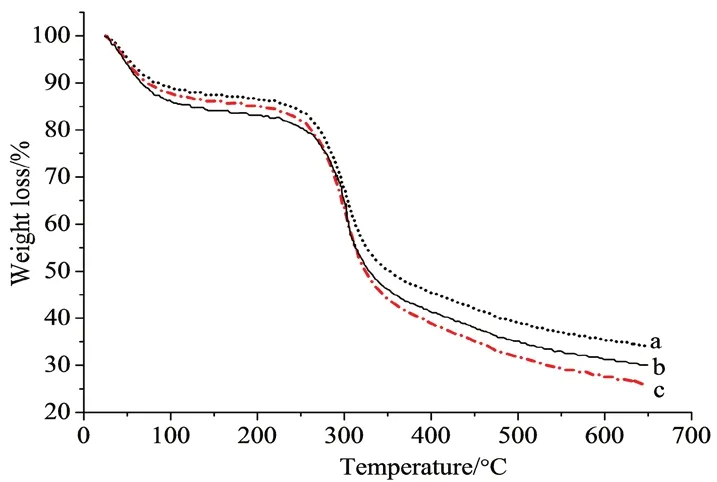
图2 热重分析图Fig 2 Thermal gravimetric analysis
由图2可知,SA涉及3个不同失重区,初始重量损失区为25~112℃,这是由于存在水分,加热后水分失去;第二个失重区为246~347℃,是由于COO-基团的降解及CO2损失(脱羧)所致;第三个失重区为347~650℃,是由于SA主链降解所致。SA-g-PMMA纳米粒第一个失重区SA比SA-g-PMMA重量降低要多些,这是由于样品中的水分较多,PMMA链段在受热过程中比较稳定,在整个加热失重过程中不会发生化学变化。而载药纳米粒(RVC/SA-g-PMMA NPs)在失重过程中,前两个失重区比较趋势变化不明显,在第三失重区明显有更多重量损失,主要是因为RVC在较高温度下分解所致。
2.2.3 形态学观察 分别取SA-g-PMMA和RVC/SA-g-PMMA混悬液,适当稀释后用铜网制样,用2%磷钨酸溶液负染,于透射电镜下进行观察。两种纳米形态如图3所示,均为类球形,载药后的规整程度下降,分布也更分散,SA-g-PMMA和RVC/SA-g-PMMA的平均粒径分别为(165.2±3.4)nm和(287.3±5.6)nm。

图3 透射电镜图(30 000×)Fig 3 Transmission electron micrograph(30 000×)
2.2.4 粒径分布 负载RVC的纳米粒与空白纳米粒配制成0.1%(W/V)的溶液,超声10 min,使溶液中纳米粒均匀分散,利用动态光散射法(条件:633 nm、25℃、4 mW、He-Ne)进行测定,结果见图4。
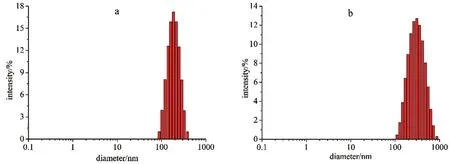
图4 空白纳米粒(a)及载药纳米粒(b)粒度分布Fig 4 Size of blank SA-g-PMMA NPs(a)and RVC/SA-g-PMMA NPs(b)
测得空白纳米粒的平均粒径为(183.7±3.7)nm,多分散系数(PDI)为(0.238±0.016),如图4a,分布较为均一,表明在制备过程中只有SAg-PMMA一种材料,生成纳米粒条件简单,容易得到分布窄的纳米粒。测得载药纳米粒的平均粒径为(309.1±9.3)nm,PDI为(0.392±0.081),如图4b。载药后粒径分布变宽,且粒径大幅度增加,与载药后体积增加及粒子间发生聚集有关。
2.3 RVC的含量测定
2.3.1 色谱条件[11]色谱柱:Zorbax Eclipse SDB-C18(150 mm×4.6 mm,5 μm);流动相:磷酸盐缓冲溶液(pH 7.4)-乙腈溶液(1∶1);等度洗脱,柱温:25℃;检测器:DAD(190~600 nm);检测波长:262 nm;流速:1 mL·min-1;进样量:20 μL。
2.3.2 标准曲线 精密配制RVC 8.98、13.47、44.9、67.35、112.25、134.7、168.38 μg·mL-1的对照品溶液。用0.45 μm微孔滤膜滤过,取续滤液进样,按照“2.3.1”项下色谱条件进行测定,以RVC质量浓度(C)对峰面积(A)进行线性回归,得到回归方程为:A=6.343C+5.391,r=0.9995,表明质量浓度与峰面积在线性范围内线性关系良好。
2.3.3 方法学验证 测得RVC的HPLC图见图5。溶剂和空白SA-g-PMMA对RVC含量的测定不产生干扰,证明该方法的专属性良好。日内精密度、日间精密度、加样回收率及稳定性均符合分析的要求(RSD值均小于5%)。
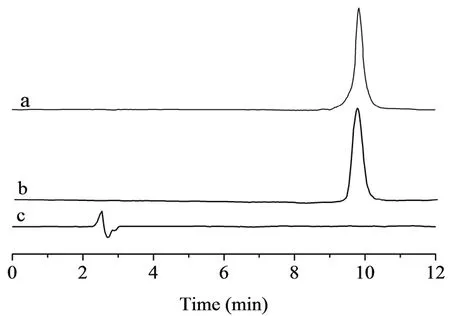
图5 RVC的HPLC色谱图Fig 5 HPLC of RVC
2.4 载药量和包封率的测定
精密称取适量的载药纳米粒,用乙腈溶解于25 mL量瓶中,超声3 min(超声时每隔5 s超声5 s)后,用有机滤膜(孔径:0.1 μm)过滤,RVC含量按“2.3”项下HPLC法测定。按下式计算RVC载药量和包封率。
RVC载药量(%)=(纳米粒中的RVC量/纳米粒的总质量×100)%;
RVC包封率(%)=(纳米粒中的RVC量/投料RVC的总质量×100)%。
不同药品与纳米粒质量比对于载药量和包封率的影响如表1所示,当质量比较低时具有较高的包封率,但载药量低,随着质量比的增加,载药量增加。但质量比过高时会导致载药纳米粒的粒径增大[12-13]。综合考虑选择质量比为0.6时较好,载药量为(3.59±0.16)%,包封率为(94.1±2.7),粒径为(309.1±9.3)nm。
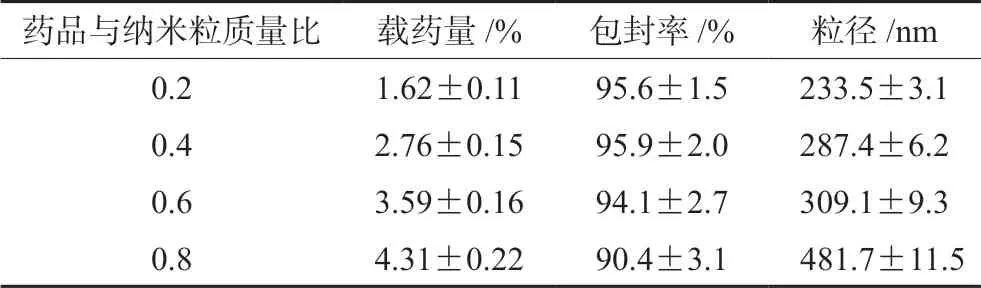
表1 载药量和包封率Tab 1 Loading capacity and encapsulation efficiency
2.5 体外药物释放的测定
使用透析袋法研究了RVC从SA-g-PMMA NPs的释放。准确称取载药SA-g-PMMA NPs和RVC各5 mg,分别加入pH为7.4的PBS缓冲液,配制成5 mL溶液,密封在透析袋中。将透析袋放入37℃恒温下装有0.5 L PBS(pH 7.4)的玻璃烧杯中,以100 r·min-1的速度搅拌。在预设的时间点,取出5 mL透析液,过滤,用HPLC测定RVC含量。同时,补充等体积的同温度的PBS缓冲液。结果如图6所示,纯RVC溶液中RVC的释放较快,在0.5 h内药物释放达80%以上。载药SA-g-PMMA NPs表现出持续释放行为,24 h释放药物不到50%,72 h接近80%。
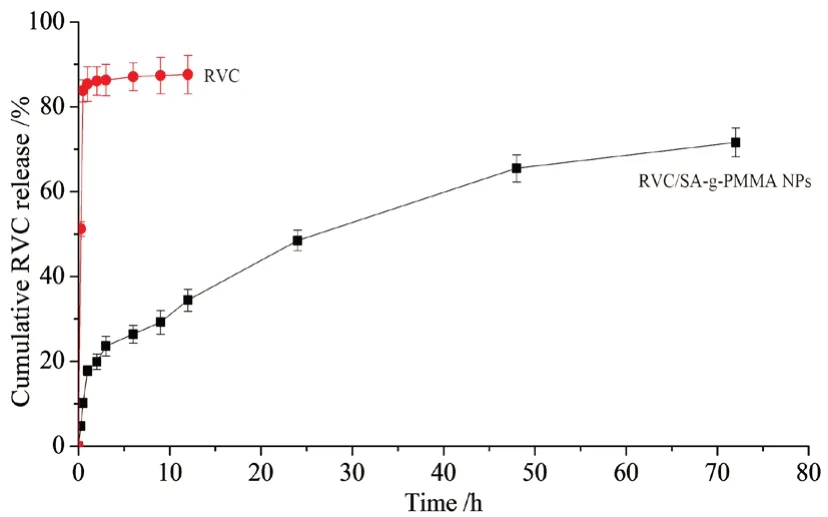
图6 体外药物释放曲线Fig 6 In vitro drug release profile
2.6 小鼠体内镇痛实验
体内镇痛实验使用电刺激法[14]进行。剃掉小鼠的腹部鼠毛,用20 V和15 V电压分别刺激小鼠的预注射部位,以小鼠对电刺激的反应发出的嘶叫次数作为痛觉阈值,筛选合格小鼠,随机均衡分组,每组8只。将RVC/SA-g-PMMA NPs、RVC溶液(均含2 mg RVC),分别皮下注射到小鼠腹部,然后分别在给药前及给药后固定时间电刺激小鼠腹部,记录电刺激达到痛觉阈值的次数。如果一组中的所有小鼠没有发出高于阈值嘶叫次数,则表明镇痛效果为100%;如果一组中有一半的小鼠对电刺激发声,则意味着有50%的镇痛作用。如果一组中的所有小鼠对电刺激都高于阈值嘶叫次数,则表示镇痛效果为0%,无镇痛作用。结果如图7所示,RVC溶液在2 h内就完全失去镇痛作用,而RVC/SA-g-PMMA NPs在20 h后仍然保持50%以上的镇痛作用。
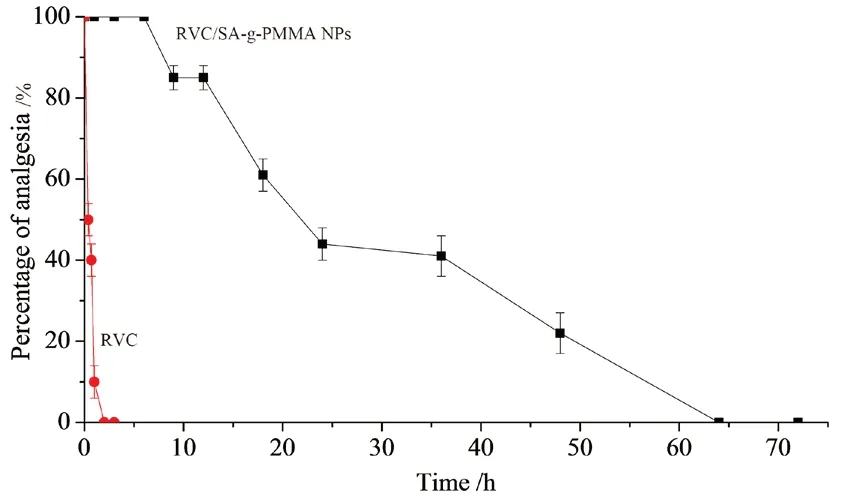
图7 小鼠体内镇痛时长曲线Fig 7 In vivo analgesia duration curve in mice
3 讨论
本实验采用RAFT法进行SA-g-PMMA NPs的制备,RAFT法最大的优点是可以根据分子设计需要改变接枝率的高低,相关的更深入研究还在进行中。纳米粒在自组装载药过程中,RVC进行碱化过程使其与疏水链段PMMA具有更好的亲和性能,在药物释放过程中达到缓释目的。本研究结果表明制备的纳米材料,具有较好的热稳定性,载药后能够达到延缓药物释放的目的,在小鼠体内能够延长镇痛时间。后期课题组还计划开展纳米接枝率对载药及缓释的影响,纳米材料的生物相容性等相关研究,以期为临床应用提供实验和理论基础。
