合成NaY型沸石的CO2吸附特性
2021-07-03王晨阳李小姗
孙 锋,王晨阳,罗 聪,李小姗,罗 童
(1.中国舰船研究设计中心,湖北 武汉 430064;2.华中科技大学 煤燃烧国家重点实验室,湖北 武汉 430074)
0 引 言
沸石[6]是一类由TO4四面体(T=Si或Al)周期性排列而成的多孔结晶铝硅酸盐,由于其独特的分子筛特性(选择性强、耐高温)以及稳定的吸附循环性能,在吸附分离领域得到了广泛应用。根据国际沸石协会(IZA)的索引,目前有170多种独特的分子筛拓扑结构[7]。但大多数沸石因为吸附容量和稳定性等原因并不适用于吸附分离领域,常用于吸附分离的主要是FAU(包含X和Y型)和LTA(A型)沸石。
目前,已有不少研究探索了不同沸石对CO2的吸附性能[8-11]。Dirar等[12]研究了13X和5A沸石对CO2的吸附过程,并研究了其饱和吸附容量、亨利常数和等量吸附热,以此来描述沸石对CO2的吸附原理。Joos等[13]通过分子模拟方式对13X在CO2和H2O的混合体系中的竞争吸附进行研究。Rodrigues等[11]研究了高压条件下沸石吸附剂对CO2的吸附过程,得到了13X型沸石在293、308和323 K三种不同温度下,在0~5 MPa压力范围内吸附CO2的能力。在一定压力下,温度升高,CO2的吸收率也会显著降低。13X的CO2吸附容量随着压力的增加而逐渐增加。Siriwardane等[14]研究发现在常温干燥条件下,沸石吸附剂对CO2的吸附容量比较大,但在较高温(120 ℃)和潮湿的情况下,其对CO2的吸附容量明显下降。与金属氧化物、水滑石等无机吸附剂相比,沸石具有良好的再生性能,即使经过多次吸附和脱附,其吸附能力也能恢复如初,且不发生明显的降解。
CO2在FAU型沸石吸附剂上的吸附以物理吸附为主,只有很小一部分是使CO2最终形成碳酸盐或羧酸盐的化学吸附。影响物理吸附的主要因素是孔隙内电荷平衡阳离子产生的电场以及与表面硅醇基团的氢键作用。研究表明,分子筛吸附CO2的能力受到铝含量的影响,因为铝含量决定了结构中电荷平衡阳离子的数量以及这些基团的类型。目前有一些研究对沸石的结构进行了调整,主要针对沸石的骨架元素Si和Al的不同比值进行调整。一般来说,Si含量越高的沸石,其稳定性越好,疏水性能越好。而Al含量越高,对酸性气体的吸附能力越好,对水的吸附效果也更好[15]。
此外,金属阳离子交换也是一种重要的沸石改性方法。从结构上看,沸石的基本单元分为骨架和阳离子,骨架一般以TO4四面体(T=Si、Al、P等)为基本结构单元,T原子之间通过特殊的键连接成特定的微孔结构或笼结构,阳离子居于骨架形成的环中。所以不同的阳离子对沸石的特性有很大影响。Walton等[16]研究发现,在对FAU型沸石吸附剂进行碱金属族阳离子交换时,碱金属阳离子的离子半径越小,改性的FAU型分子筛对CO2的吸附能力越高。
Y型沸石属于FAU型沸石,其结构为八面立方晶系。合成NaY型沸石已用于化工炼油的催化剂。合成的NaY型沸石具有较发达的孔道结构,存在大量的骨架外碱性Na+离子,且Na+离子具有较小的离子半径。因此,NaY型沸石可能对CO2具有较好的吸附性能。
但目前将NaY型沸石用于CO2吸附的研究较少,特别是NaY型沸石和其他沸石的性能对比、循环稳定性等仍未知。此外,NaBr改性通常可以提高粉末的孔隙,使得吸附剂具有更好的吸附效果。能否通过NaBr改性增强微孔沸石的CO2吸附性能值得进一步探索。为了研究NaY型沸石的CO2吸附性能,本文筛选了13X和4A两种典型的微孔沸石,合成了NaY型沸石,对比研究了其CO2吸附能力,得到了吸附性能较好的NaY型微孔沸石。并采用溴化钠浸渍改性NaY型沸石,进一步提高了吸附容量和循环稳定性。
该研究是对吉安(油田话)的单字调调值的第一次具体研究,通过所得的实验数据,得出结论:年青者(23岁)调类的基频整体上低于其他两位年长发音人的基频,年长者(68岁)的阳平尾端有明显的下降,不同于其他两位发音人,说明年龄差异影响到调类变化,历史上阳平有可能是个升降调,为了证明这一想法,笔者将会在另一论文中进行证明。因此,暂且认为油田方言总共有四个调类,阴平,阳平,上声和去声,入声归入阴平和去声。
1 试验方法
1.1 沸石材料及NaY型沸石合成方法
本文利用水热合成法制备了NaY型沸石,并选取了4A、13X沸石与其对比。其中4A沸石来源于国药集团化学试剂有限公司,球状,颗粒直径为3.2~4.7 mm。13X沸石来源于上海有新分子筛有限公司,纯度为99%。所用沸石吸附剂均经过筛分为相近粒径以排除粒径大小对吸附性能的影响。
NaY型沸石的合成原料来源于国药集团化学试剂,合成方法为水热合成法并按照文献[17]。为了加快合成速度和晶化速度,采用晶种为导向剂。晶种的作用是为沸石合成提供生长点以加快合成速度。整个制备过程分为2个阶段:① 晶种形成过程。晶种在凝胶中结晶并缓慢变大,直到达到一定值后停止生长。② 晶体生长过程。凝胶沿着晶种四周生长,直到凝胶中的物质反应完毕。形成晶种所用原料质量比为:m(水玻璃)∶m(NaAlO2)∶m(NaOH)∶m(H2O)=14.04∶1∶3.35∶9。形成凝胶所用原料的比例为:m(水玻璃)∶m(NaAlO2)∶m(NaOH)∶m(H2O)=13.8∶1∶0.11∶10.3;晶种与凝胶的质量比为5∶95。制备过程中先按照上述原料比例配置晶种,搅拌均匀后在60 ℃条件下密封静置6 h完成老化过程。老化完成后将晶种与凝胶混合搅拌,随后进行晶化过程,晶化温度为100 ℃,时间为10 h。产物最终经洗涤烘干后可以得到合成NaY型沸石粉末。整个合成过程的流程示意如图1所示。
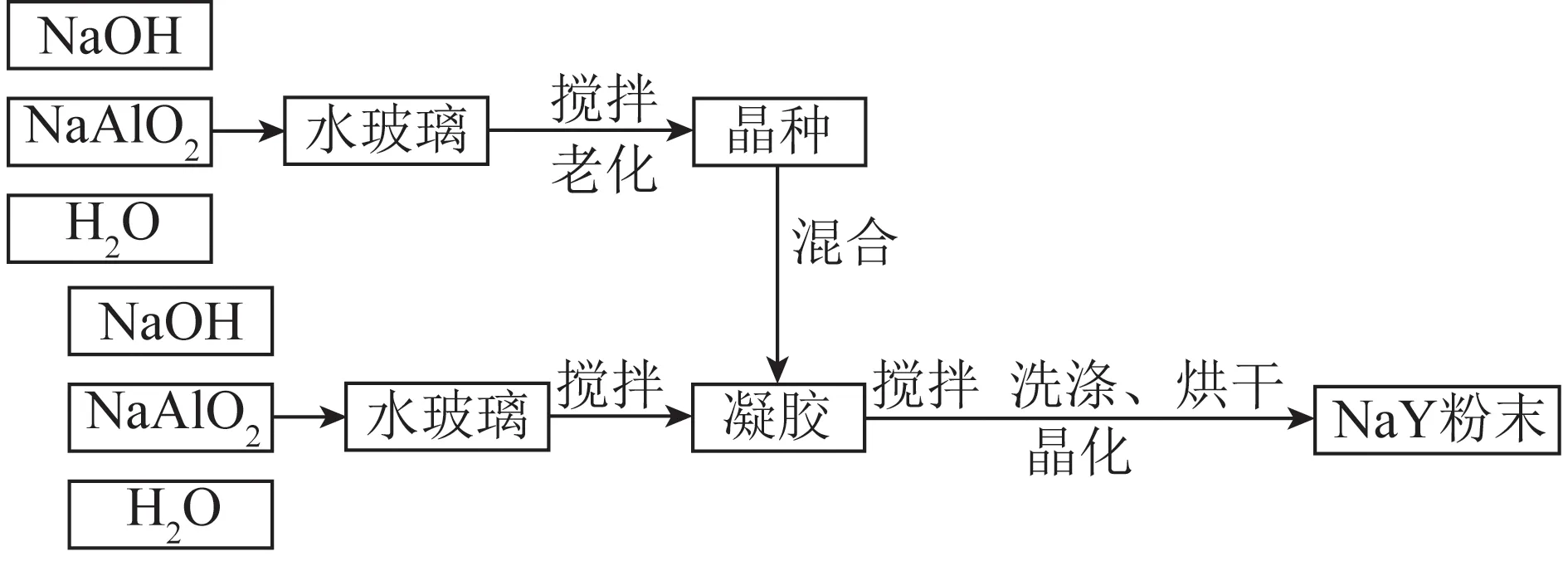
图1 NaY型沸石合成的流程Fig.1 Flow diagram of hydrothermal synthesis of NaY zeolite
1.2 NaY型沸石改性方法
本文溴化钠改性采用浸渍法。分别选取1.03、2.06、4.12 g溴化钠,将其放入装有200 mL水的烧杯中,搅拌5 min使其混合均匀,分别配成浓度为0.05、0.10、0.20 mol/L的溴化钠溶液,准备一个装有200 mL去离子水的烧杯作为空白对照。最后向4个烧杯中分别加入2 g的NaY型沸石粉末。完成上述过程后,将烧杯放到水浴锅上进行搅拌3 h,以保证其混合均匀。最后将得到的样品洗涤、离心、干燥得到改性的样品粉末。4种样品分别命名为YBr-0、YBr-0.05、YBr-0.1和YBr-0.2,分别对应溴化钠浓度为0、0.05、0.10、0.20 mol/L改性的NaY型沸石。
1.3 沸石材料的CO2吸附性能试验
本文沸石的CO2吸附容量测定所用仪器为3H-2000PS1/2型比表面积与孔隙分析仪改装后的CO2吸附仪,即将进气由N2改为CO2,并对相应程序进行调整。试验气体所用CO2和N2纯度为99.999%。
试验前,将沸石材料放入马弗炉内在400 ℃条件下煅烧10 h以排除空气等杂质气体干扰,然后放置在真空干燥箱内自然冷却到室温。称取500 mg左右经12 h干燥后的样品于已知质量的专用样品管中,之后固定于脱附位上进行抽真空操作,脱附过程温度为200 ℃,时间为180 min。脱附过程结束后,待样品管冷却至室温并再次称重,计算差值得到脱附后的样品质量。将样品管转移到吸附仪的吸附位上以进行吸附试验,所用气体为纯CO2。在样品CO2吸附量测量过程中,固定体积的CO2会逐步注入样品管中,当样品吸附了气体后,封闭空间内的气体会减少,直至达到吸附平衡。通过测定平衡时的压力和体积,从而计算得到样品的CO2吸附容量,通过改变进入样品管中的CO2气体体积,从而得到样品在不同压力时的CO2吸附容量。
CO2循环吸附稳定性的测定采用循环吸附-抽真空的方法进行试验。每个循环中的吸附过程和单次CO2吸附过程步骤一致,样品质量为500 mg,吸附试验在25 ℃下进行,吸附气体为纯CO2。约10 min样品和吸附气体会达到吸附平衡状态,此时吸附过程结束。脱附过程采用抽真空的方式进行,经吸附过程后的样品转移至脱附位,开始抽真空脱附,过程持续60 min,脱附气氛为氦气。脱附过程结束后即完成一个循环,后续的循环过程与上述操作步骤保持一致。每次循环后记录样品的CO2吸附容量。
2 试验结果与讨论
2.1 合成沸石的物相分析
首先对合成的沸石粉末进行了XRD测试,将得到的XRD谱图与国际沸石协会给出的标准八面体沸石NaY的XRD谱图进行了对比,结果如图2所示。
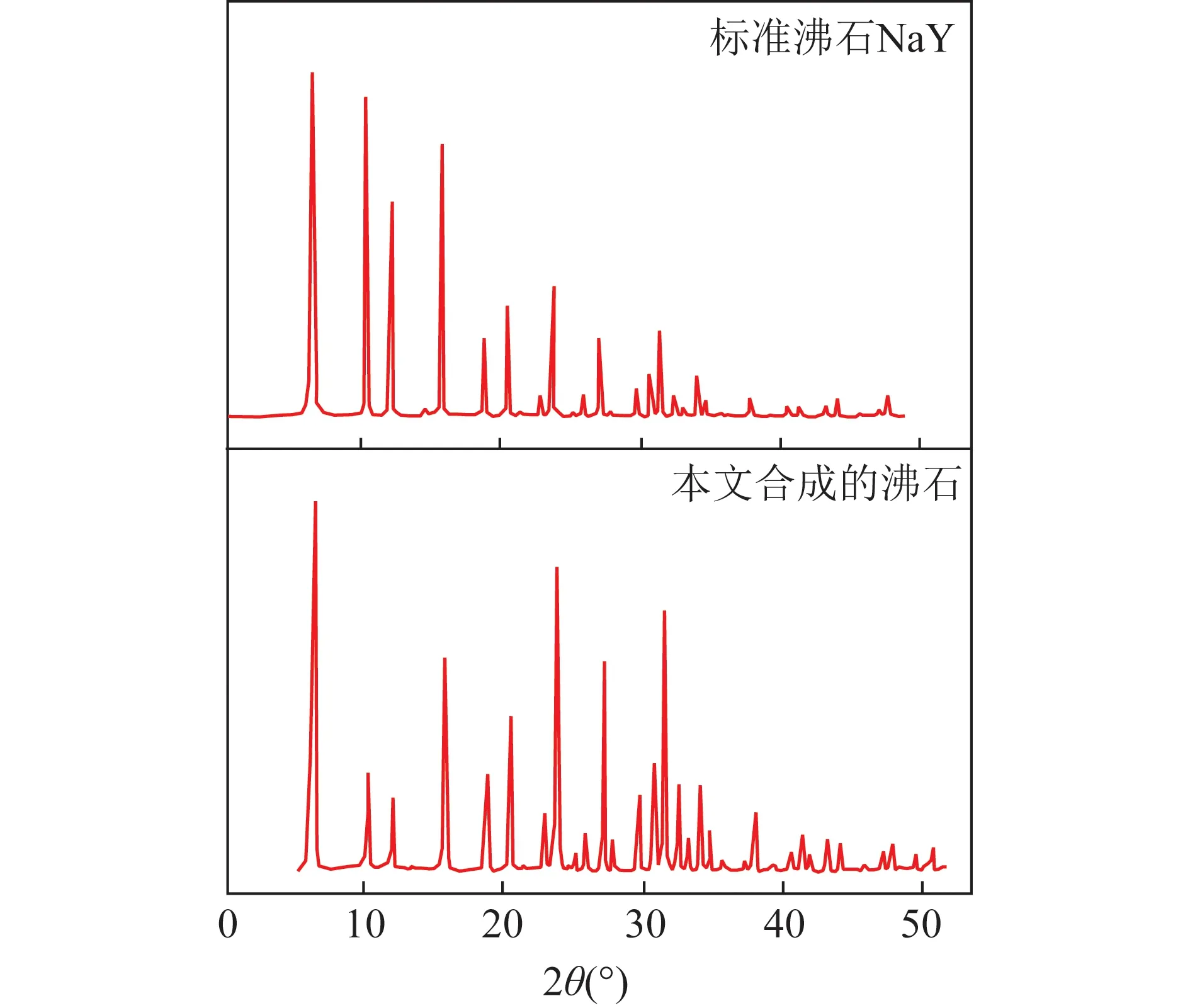
图2 NaY型沸石的XRD图谱Fig.2 XRD spectrum of NaY zeolite
由图2(a)可知,标准的NaY型沸石的XRD特征峰为:2θ=6.18°、10.10°、11.85°、15.59°、23.35°、26.93°、30.8°和33.95°。本文合成的NaY型分子筛的XRD谱图中特征峰位置为2θ=6.32°、10.26°、12.02°、15.79°、23.77°、27.17°、30.89°、34.21°。对比发现本文合成的沸石样品与标准NaY型沸石的主要特征峰吻合,而其他的非主要特征峰的强度很小。由此可知本文合成的沸石为NaY型沸石,且纯度较好。
2.2 不同沸石孔隙结构
利用3H-2000PS1/2型比表面积与孔隙分析仪通过N2吸附-脱附方法对3种沸石材料的比表面积及孔径参数进行分析。3种材料的N2吸附-脱附曲线如图3所示(实心曲线为吸附曲线,空心曲线为脱附曲线)。可知3种沸石的等温吸附曲线均属于第I型吸附曲线,3种沸石对N2的吸附容量随着压力的增加而迅速上升,最后达到了饱和状态。这是由于样品的外表面积远小于孔内的表面积,使得吸附容量主要受孔体积影响,开始的转折点就是3种沸石的孔被吸附质(N2)完全充满的点,这是微孔样品的普遍特点。而在吸附曲线尾端出现的吸附容量快速上升的部分,目前认为是微粒间存在缝隙,会发生类似大孔的吸附过程所致。3种沸石材料虽然均为微孔型沸石,但由于各自的孔径大小不同,所以各自的N2吸附容量也不同。
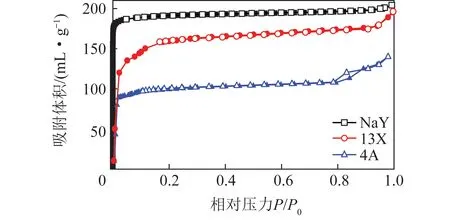
图3 不同沸石在77 K时的氮气吸附/脱附曲线Fig.3 N2 adsorption/desorption curves of different zeolite at 77 K
根据N2吸附/脱附曲线得出的3种沸石材料的孔径分布如图4所示。可知3种沸石的孔径分布都遵从正态分布,在一定范围内随着孔径增大,孔径分布范围相应增加,而后随着孔径继续增大,孔径分布逐渐减少。4A型沸石的孔径分布相对最窄,在0.36~0.48 nm,13X型的孔径主要分布在0.8~1.2 nm,而合成的NaY型沸石的孔径分布最宽,主要分布于1.1~1.8 nm,且孔隙最为丰富。

图4 3种沸石吸附剂的孔径分布Fig.4 Pore size distribution of three different zeolite adsorbents
3种沸石材料的结构参数见表1。由图3、4以及表1可知,3种沸石均为微孔沸石,主要吸附方式为物理吸附,按照对N2的吸附能力大小排序为NaY>13X>4A,三者比表面积大小排序为13X>NaY>4A,平均孔径大小排序为NaY>13X>4A。由此可知,3种微孔沸石的N2吸附容量与平均孔径以及孔容的相关性最大,且N2吸附容量随着孔径以及孔容的增大而增加。

表1 3种沸石的结构参数
2.3 CO2吸附性能
采用改装后的吸附仪对4A、13X、NaY三种沸石吸附剂进行CO2平衡吸附试验,测试了3组不同吸附平衡温度(25、30和35 ℃)。压力0~101 kPa时,等温吸附试验结果如图5所示。可知在固定温度下,3种沸石吸附剂对CO2的吸附容量随着压力的增加而上升。13X和4A型沸石的CO2吸附量随温度升高而下降。对于NaY型沸石,压力大于0.014 MPa时,随着吸附温度的升高,CO2吸附能力下降。这种情况符合物理吸附剂的气体吸附特点。
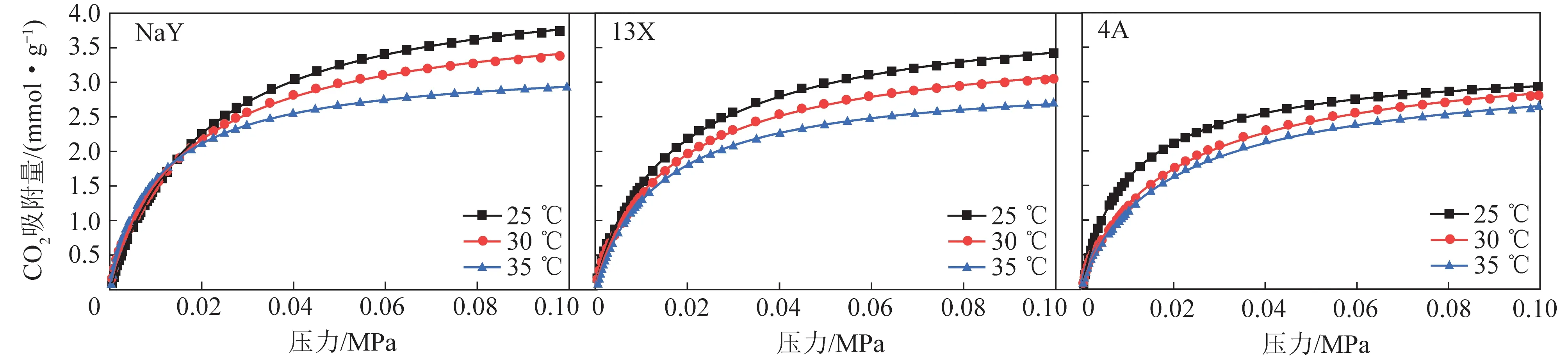
图5 3种吸附剂在不同温度下的CO2等温吸附曲线Fig.5 Isothermal CO2 adsorption curves of three kinds of adsorbents under different temperatures
对吸附平衡时的试验数据结果进行Langmuir模型的拟合以分析吸附结构和吸附容量的关系。Langmuir模型是Langmuir从动力学理论推导出的单分子层吸附等温式,该方程较好地描述了低、中压力范围的吸附等温线,但只适用于第Ⅰ类吸附曲线的拟合。模型为
(1)
式中,P为压力;θ为气体分子在吸附剂表面的单层覆盖率;b为吸附系数,其数值大小与固体吸附剂表面吸附能力的强弱有关。
图5中实线为根据Langmuir模型得到的拟合曲线。Langmuir模型假设均匀表面的单层吸附,因此与实际吸附情况会不同,但在中低压时与第I型等温吸附曲线的初始部分拟合良好。
由图5可知,Langmuir模型对3种沸石吸附剂的CO2吸附试验结果拟合效果良好,拟合优度较高。一般来说吸附系数b可以表现出不同吸附材料对CO2吸附能力的不同。3种沸石在不同温度下Langmuir模型拟合的吸附系数b和拟合优度见表2。可知3种吸附剂的吸附系数b在同一温度下排序为NaY>13X>4A。对比表1可知,吸附系数b会随着沸石孔径的增大而增大。此外3种沸石的吸附系数b随着温度的升高而下降。在25 ℃下3种沸石的b值达到最大,这与试验数据相符。
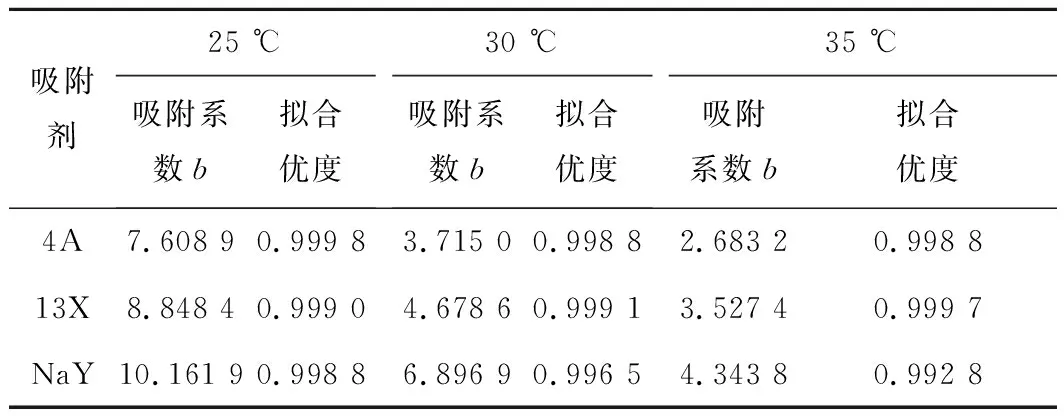
表2 不同沸石在不同温度下的b值和拟合优度
3种吸附剂在不同温度下的CO2吸附量如图6所示,可知25 ℃时3种吸附剂的CO2吸附容量大小为:NaY(3.74 mmol/g)>13X(3.35 mmol/g)>4A(2.93 mmol/g)。不同温度下,3种沸石中NaY型沸石的CO2吸附性能最好。3种沸石在25 ℃时CO2吸附容量最大。25~35 ℃,CO2吸附量下降最小的是4A(10.82%),最大的是NaY(22.17%)。虽然随温度升高NaY的CO2吸附容量下降较多,但其吸附容量在3种沸石材料中仍最大,可以选为下一步改性试验的对象样品。

图6 3种沸石在不同温度下的CO2吸附量Fig.6 CO2 adsorption capacity of three kindsof zeolites under different temperature
3种沸石在8次循环吸附试验中的CO2吸附容量如图7所示。结果表明,经过8次循环后3种沸石的CO2吸附容量下降率的排序为:NaY(2.50%)<13X(4.66%)<4A(8.96%)。可以看出NaY和13X型沸石的多循环吸附性能稳定性较好,4A的吸附循环稳定性能相对较差。可能是由于4A的孔径与CO2的分子直径(0.33 nm)非常相近,使得脱附过程中吸附质未脱附完全,造成后续循环的吸附性能下降。

图7 不同沸石的CO2循环吸附容量Fig.7 CO2 adsorption capacity of different kinds of zeolites
2.4 溴化钠改性NaY沸石的性能
首先在CO2吸附仪上对吸附剂进行CO2吸附试验,吸附温度为25 ℃,结果如图8所示(数据点为试验测得结果,实线为Langmuir模型拟合结果)。可以看出拟合结果基本符合试验结果。溴化钠浸渍改性后,吸附剂的主要吸附方式为物理吸附,在同一温度下,吸附容量随着压力的增加而增加。

图8 不同浓度溴化钠改性NaY沸石的CO2吸附曲线Fig.8 CO2 adsorption curves of NaY zeolite modifiedwith different concentration of sodium bromide
溴化钠浸渍改性后吸附剂的CO2吸附容量有小幅增加。YBr-0.05的CO2吸附容量(3.93 mmol/g)与YBr-0相比约增加了6.5%,而YBr-0.1的CO2吸附容量(4.05 mmol/g)较YBr-0增加约8.4%。YBr-0.2的CO2吸附容量(4.07 mmol/g)则与YBr-0.1相近。说明溴化钠浸渍改性对于NaY型沸石的CO2吸附容量提升有一定促进作用。而在一定范围内随着溴化钠浓度的提升,改性吸附剂的CO2吸附容量有所增加。但当溴化钠浓度超过0.1 mol/L时,溴化钠浸渍改性对于CO2吸附能力的提升效果有限。
不同浓度溴化钠改性NaY型沸石吸附剂的循环CO2吸附性能比较如图9所示。
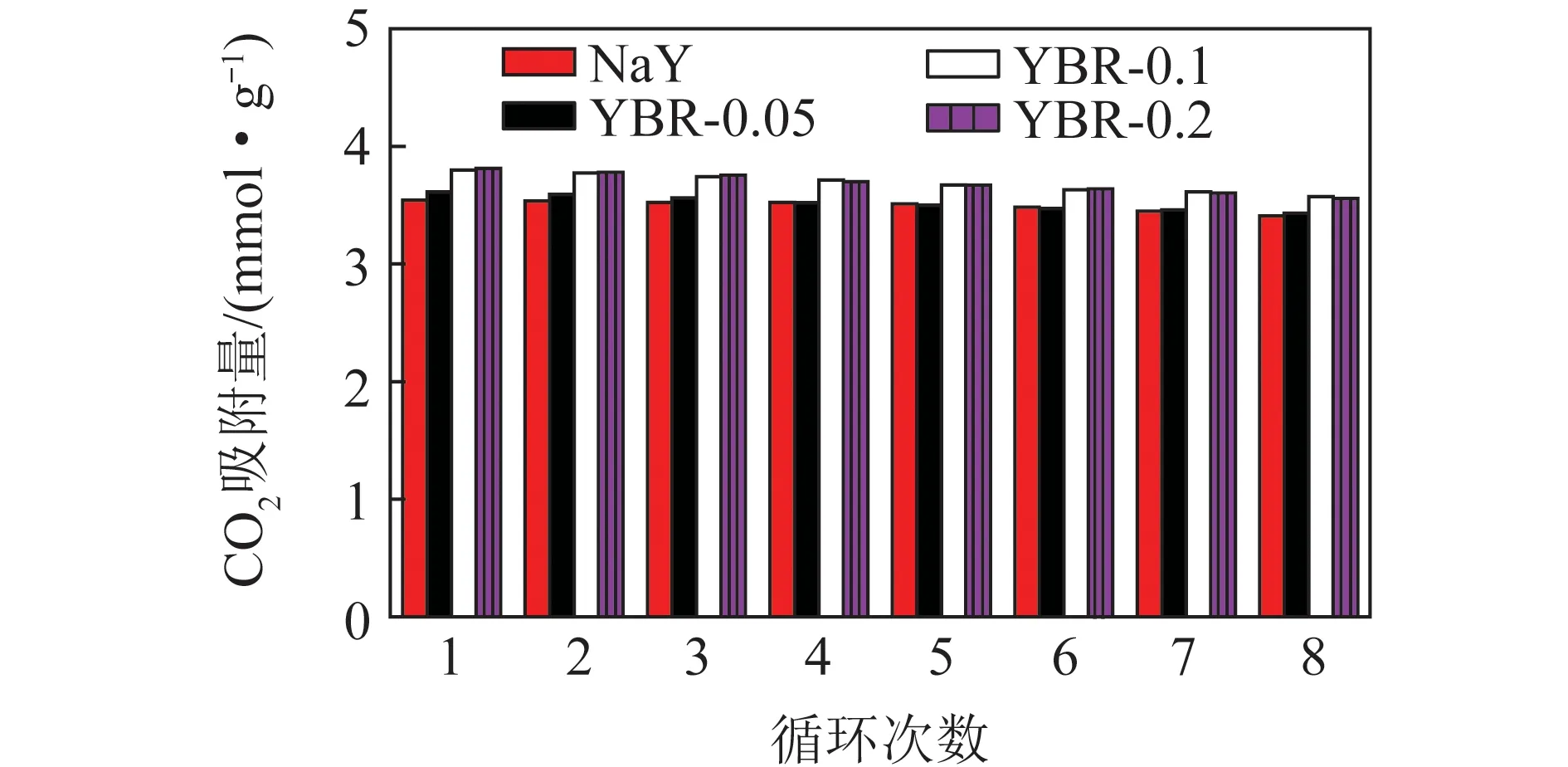
图9 不同浓度溴化钠改性NaY沸石的CO2循环吸附容量Fig.9 CO2 adsorption of NaY zeolite modified with different concentration of sodium bromide
由图9可知,以每个循环的吸附容量大小为标准可将4种吸附剂分为性能接近的2组,即NaY与YBr-0.05为一组,YBr-0.1与YBr-0.2为一组。每组吸附剂在每个循环中吸附容量接近,而第2组吸附剂的吸附容量优于第1组吸附剂。在8次循环后不同溴化钠浓度浸渍改性的NaY型沸石吸附容量的下降率分别3.7%、5.0%、6.0%、6.7%。结果表明,溴化钠浸渍后的NaY型沸石在8次吸附/脱附循环试验后的CO2吸附能力仍保持在较好的水准。且多次循环后溴化钠浸渍的NaY型沸石的CO2吸附能力要高于未改性的NaY型沸石。综合考虑吸附剂的性能以及循环稳定性,可知YBr-0.1为最佳的吸附剂,即溴化钠溶液浸渍改性NaY型沸石的最佳浓度为0.1 mol/L。
3 结 论
1)水热法制备的合成NaY型沸石吸附剂同13X与4A吸附剂均属于微孔吸附剂。Langmuir模型对于3种沸石的CO2吸附试验结果拟合效果良好,在不同温度下3种沸石的吸附系数b排序为:NaY>13X>4A。
2)合成NaY型沸石拥有3种吸附剂中最好的CO2吸附性能表现,25 ℃时CO2吸附容量为3.74 mmol/g;经历8次循环后吸附容量下降率为2.5%,循环性能稳定性高。
3)采用浸渍法改性NaY型沸石所用溴化钠溶液最佳改性浓度为0.1 mmol/g,改性后吸附剂的CO2吸附容量为4.05 mmol/g,相较于未改性的吸附剂性能提升了8.4%。在8次循环CO2吸附试验中其吸附容量衰减率为6%。
