煤气化渣基氨氮吸附剂的制备及吸附性能研究
2021-07-03樊盼盼严晓辉鲍卫仁常丽萍王建成
马 超,王 兵,樊盼盼,严晓辉,鲍卫仁,常丽萍,王建成
(1.太原理工大学 省部共建煤基能源清洁高效利用国家重点实验室,山西 太原 030024;2.太原理工大学煤科学与技术教育部重点实验室,山西 太原 030024;3国家能源投资集团有限责任公司,北京 100010)
0 引 言
煤气化是解决我国富煤、贫油、少气的重要手段之一,是实现煤炭综合利用和清洁高效利用的重要技术手段,煤气化过程会产生大量的固体废弃物——气化渣[1]。据统计,2019年我国年产气化渣约3 300万t(干基)。大量气化渣的填埋处理不仅占用了宝贵的土地资源,还造成了地表、水体等生态环境污染,严重制约了煤化工企业的绿色发展。
煤气化渣的成分为SiO2、Al2O3等矿物质和残炭[2],丰富的硅铝结构具有制备吸附剂的潜质。顾彧彦等[3]以煤气化渣为原料,通过KOH活化、表面改性,制备高比表面积吸附剂用于对溶液中Pb2+吸附。Wu[4]以煤气化渣为原料合成多孔材料,用于脱除废水中结晶紫。煤气化渣在水处理方面具有较为广泛的应用前景。我国废水排放量逐年增加。废水中氨氮含量过高,易导致“水华”、“赤潮”等现象。且氨氮在水中经过硝化细菌的硝化作用,会生成有毒的硝酸盐和亚硝酸盐[5]。生物硝化-反硝化、空气吹脱、离子交换等方法广泛用于降低废水中氨氮含量[6],但其较高的成本限制了其规模化应用。离子交换法较适用于中低浓度的氨氮,常用的材料为沸石。Chen等[7]通过碱熔融-水热合成的方法将粉煤灰合成高效的氨氮吸附剂,经碱熔融后水热合成,增加了吸附剂成本。气化渣中丰富的硅铝可制备成沸石结构,用于处理氨氮废水。利用气化渣基吸附材料处理氨氮废水,既可实现对煤气化渣的治理,又可得到廉价的高效氨氮吸附剂。
本文以宁夏煤业有限责任公司GSP干粉加压气化炉经水介旋流器分选后得到的富碳细渣(RCS)为原料,通过水热合成氨氮吸附剂。通过对吸附剂进行特性表征和静态吸附试验,探究其结构对氨氮吸附的影响,研究其吸附等温线及动力学,为气化渣的综合利用提供新思路。
1 试 验
1.1 试验原料
试验采用宁夏煤业有限责任公司GSP炉,经水介旋流器分选后得到的RCS,RCS主要矿物组成见表1,可见RCS中二氧化硅含量较高,超过60%。

表1 RCS的主要矿物质成分及质量分数
1.2 吸附剂的制备
采用水热合成法,取5 g NaOH、5 g RCS与1 g NaAlO2置于反应釜内衬中,加入50~60 mL去离子水,于室温下搅拌2 h。将搅拌均匀的混合物置于反应釜中,100 ℃晶化12 h。用过量去离子水洗涤、抽滤至滤液为中性,在烘箱中60 ℃干燥过夜,得到气化渣基氨氮吸附剂(简称吸附剂)。制备过程所用试剂均为分析纯。
1.3 试验方法
1.3.1静态吸附试验
以氯化铵为原料制备氨氮模拟废水,取50 mL氨氮模拟废水(质量浓度约为60 mg/L)于100 mL 锥形瓶中,投入0.5 g吸附剂,在初始pH=6.8条件下,1 min达到吸附平衡。用0.45 μm滤膜过滤,测定滤液氨氮浓度并计算氨氮吸附量。每组试验均做空白和3次平行试验,以保证结果的准确性。
氨氮吸附量和去除率计算方法如下:
qe=V(C0-Ce)/m,
(1)
η=(C0-Ce)/C0×100%,
(2)
式中,qe为平衡吸附容量,mg/g;C0为溶液中氨氮初始浓度;Ce为平衡时溶液中氨氮浓度,mg/L;V为废水体积,L;m为吸附剂质量,g;η为氨氮去除率,%。
1.3.2化学分析方法
氨氮测试采用国家标准《水质氨氮的测定 纳什试剂分光光度法》(HJ 535—2009)分析水中氨氮浓度,由标准曲线计算溶液中剩余氨氮浓度,比较不同试验条件下,吸附剂对氨氮吸附的影响。
1.4 吸附剂表征
1)傅里叶变换红外吸收光谱
采用德国布鲁克公司所产的VERTEX 70型傅里叶变换红外光谱仪,将光谱纯的KBr与样品混合压片(样品与KBr的质量比为1∶100),扫描范围为400~4 000 cm-1,分辨率为4 cm-1。
2)X射线衍射
利用日本理学生产的Rigaku Mini Flex 600型粉末X射线衍射仪测定吸附剂的晶体结构,Cu靶Kα射线(λ=0.154 056 nm),扫描步长为0.02°,扫描速度为5(°)/min,扫描范围为5°~50°,管电压为40 kV,管电流为15 mA。
3)扫描电子显微镜(SEM)
采用日本电子所JSM 79700F型SEM,加速电压为5.0 kV,工作距离10 mm,表征吸附剂形貌特征。
4)物理吸附
利用美国麦克默瑞提克公司ASAP 2460型多功能吸附仪测定吸附剂孔结构。采用Brunauer-Emmett-Teller模型计算吸附剂的总比表面积;采用t-plot模型计算吸附剂的中微孔比表面积;采用BJH模型计算吸附剂的孔体积和平均孔径。
2 结果与讨论
2.1 吸附剂的表征
2.1.1傅里叶变换红外吸收光谱表征
RCS与吸附剂的傅里叶变换红外吸收光谱如图1所示。RCS在1 053 cm-1(B处)有较强的吸收峰,为Si—O的反对称收缩振动[8]。吸附剂在1 000 cm-1(C处)附近出现新的化学吸收带,为T—O—Si键的不对称伸缩振动(T=Al或Si)[9-11];吸附剂在720 cm-1(D处)附近出现另一个新的低强度吸附带,为T—O—Si键的对称伸缩振动(T=Al和Si),与相关文献一致[7,12-13],这2个吸收带说明吸附剂生成了一定数量的沸石结构。RCS与吸附剂均在3 434 cm-1(A处)存在一个较明显的吸附峰,为—OH的振动,说明2者均为亲水材料,有利于与水溶液充分结合,对氨氮的去除起积极作用。

图1 RCS与吸附剂红外吸收光谱Fig.1 FT-IR absorption spectra of RCS and synthesized sorbent
2.1.2粉末X射线衍射表征
图2为吸附剂与RCS的XRD谱图,谱图呈宽衍散布,RCS有较强的石英特征峰与微弱的CaCO3峰,说明气化渣中无机矿物成分在煤气化过程中几乎完全融化,大部分SiO2为非晶态。新出现的峰为沸石材料特征峰,表明RCS在反应中生成了沸石结构。吸附剂晶相主要为A型沸石(Na96Al96Si96O384)和SAPO-20分子筛(Al0.47Si0.15P0.38O2)杂晶。NaOH在吸附剂生成过程中削弱了Al2O3与SiO2间的键合,破坏了石英的晶体结构,生成活性硅铝材料。XRD与FT-IR结果一致,说明RCS经水热反应生成了一定数量的沸石结构。

图2 RCS与吸附剂XRD谱图Fig.2 XRD pattern of RCS and sorbent
2.1.3扫描电子显微镜(SEM)表征
采用扫描电镜研究了气化渣与吸附剂的形貌特征,如图3所示。图3(a)中呈球状的区域为无机矿物质,呈絮状的区域为残炭,这与Zhao等[14]的结果相符。结合XRD表征可知,其中球状的主体为SiO2。球表面光滑,说明RCS中无机矿物质主要为非晶态[15]。此外,无机矿物质微球大小不同,尺寸相差较大。图3(b)中吸附剂表面生成了较规整的六棱台形貌,结合XRD可知,应为A型沸石,结晶产物分布良好,较细致,表现出较规整的立方结构和完整的晶体平面,有利于对氨氮离子的去除[16]。

图3 RCS与吸附剂SEM谱图Fig.3 SEM images of RCS and synthesized sorbent
2.1.4物理吸附表征
表2为RCS与吸附剂的氮气吸附数据。可以看出,RCS经水热合成后,其比表面积略增,由267 m2/g升至311 m2/g,主要是因为NaOH破坏了RCS中的SiO2结构,且形成了新的沸石结构,使吸附剂的比表面积略增[17];微孔比表面积占比由37.81%增至72.98%,说明材料中产生了较多的微孔结构。

表2 RCS与吸附剂的氮气吸附-解析
2.2 氨氮去除率的影响因素
2.2.1反应时间

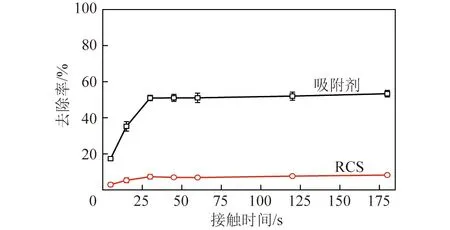
图4 RCS与吸附剂接触时间对氨氮去除率的影响Fig.4 Effect of contact time between RCS andsorbent on ammonia nitrogen removal rate
2.2.2初始pH值


图5 初始pH对氨氮去除率的影响Fig.5 Effect of initial pH on ammonia nitrogen removal rate
2.2.3初始浓度
吸附剂用量为10 g/L、废水pH=6.8、吸附时间为1 min,氨氮初始浓度对去除率及平衡吸附量的影响如图6所示。可知,随着氨氮初始浓度增大,吸附剂对氨氮的去除率逐渐降低,同时单位质量的吸附剂对氨氮的吸附容量逐渐增大。废水氨氮初始浓度为20 mg/L时,吸附剂对氨氮的去除率达79.73%,平衡吸附量为1.37 mg/g;废水氨氮初始浓度为100 mg/L时,吸附剂对氨氮的去除率仅为43.26%,平衡吸附量为4.34 mg/g,其原因是氨氮初始浓度是克服固相和液相之间传质阻力的主要推动力,因此氨氮初始浓度的升高有助于提高吸附剂对氨氮的平衡吸附容量[18]。但吸附剂对氨氮的吸附达到一定量时,溶液中的氨氮和已吸附在沸石表面上的氨氮产生排斥,使吸附剂对氨氮的吸附作用逐渐减弱[19],导致随着氨氮浓度增加,去除率逐渐降低。因此,综合考虑选择氨氮初始浓度为60 mg/L。

图6 初始浓度对氨氮去除率的影响Fig.6 Effect of initial concentration onremoval rate of ammonia nitrogen
2.2.4固液比
废水pH=6.8、吸附时间1 min、氨氮初始浓度为60 mg/L,固液比对吸附剂去除率及平衡吸附容量的影响如图7所示。可以看出,固液比由1 g/L增到40 g/L时,氨氮去除率由13.29%增至82.32%,吸附剂的平衡吸附量由9.54 mg/g降到1.44 mg/g,说明废水中氨氮含量一定时,增加吸附剂的固液比会增大氨氮的去除率。但氨氮去除率达到一定数值时,继续增加吸附剂的固液比,对氨氮的去除效果减弱。吸附剂用量为40 g/L时,氨氮剩余浓度为10.61 mg/L,达到国家间接排放标准(GB 31571—2015)。

图7 固液比对氨氮去除率的影响Fig.7 Effect of solid-liquid ratio on removal rate of ammonianitrogen
表3为不同吸附材料对氨氮的吸附效果,对比文献制备的核桃壳炭、Cu2+负载活性炭、HNO3改性焦粉,本文的气化渣基氨氮吸附剂制备成本低、氨氮去除率较好,且达到平衡的时间较短,具有较好的发展前景。

表3 不同吸附材料对氨氮的吸附效果
2.2.5吸附等温线
Langmuir吸附等温模型假设固体表面是均匀的,各吸附位置对吸附质均具有相同的亲合力,且认为一个吸附位置只能吸附一个分子,形成单分子吸附层。若表面被单一的一层覆盖,表面力即达到化学饱和,无法再发生吸附,被吸附的分子间不发生相互作用[23]。Langmuir吸附等温式可表示为
(3)
其中,qm为吸附剂饱和吸附量,mg/g;KL为Langmuir等温吸附方程式常数。在不同的初始氨氮浓度下,以Ce/qe为纵坐标,以平衡浓度Ce为横坐标,作图得Langmuir吸附等温线,如图8(a)所示。
Freundlich吸附等温式认为,固体表面是不均匀的或吸附位吸附粒子后相互作用的表面吸附过程是经验公式,其表达式为
(4)
其中,KF、n为Freundlich等温吸附方程式常数。以平衡浓度lnCe为横坐标,lnqe为纵坐标作图得Freundlich吸附等温线,如图8(b)所示。Langmuir 与Freundlich 吸附等温线模型参数见表4。
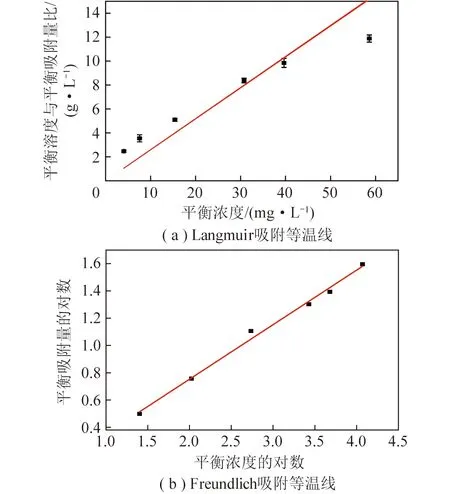
图8 Langmuir吸附等温线与Freundlich吸附等温线Fig.8 Langmuir adsorption isotherm and Freundlich adsorptionisotherm
由表4可知,Freundlich方程R2比Langmuir方程更高,且Langmuir模型拟合计算的最大吸附量与试验结果(4.93 mg/L)差别较大,说明Freundlich方程能更准确地描述氨氮在吸附剂上的吸附特征,吸附剂对氨氮以表面为主要吸附位,并不是均匀的单层吸附。Freundlich方程中n表征吸附强度,n<0.5时,表示吸附难以进行[24]。本文n=2.50≫0.5,说明吸附剂对氨氮具有良好的吸附性能。

表4 Langmuir与Freundlich等温线模型参数
2.2.6吸附动力学
吸附动力学主要研究吸附剂与吸附质之间的反应速率以及影响反应速率的主要因素。准一级动力学模型假设吸附由吸附质扩散步骤控制,吸附速率与溶液中剩余离子数量成正比,吸附剂的吸附速率和平衡吸附量与任意时刻吸附量的差成正比[25]。准一级动力学模型方程为
ln(qe-qt)=lnqe-k1t,
(5)
其中,k1为准一级速率常数,s-1;t为接触时间,s;qt为t时刻吸附剂对氨氮的吸附量,mg/g。以ln(qe-qt)为纵坐标、t为横坐标,对试验数据以准一级动力学方程进行拟合,拟合结果如图9(a)所示。
准二级动力学模型假设吸附由化学吸附步骤控制,吸附速率与反应物浓度的二次方成正比[26]。准二级动力学模型方程为
(6)
其中,k2为准二级速率常数,g/(mg·s)。以t/qt为纵坐标,以t为横坐标,进行准二级动力学方程拟合,结果如图9(b)所示,准一级和二级吸附速率方程回归参数见表5。准一级动力学与准二级动力学方程线性拟合相关系数分别为0.92、-0.25,可知准一级动力学可更好地拟合吸附过程,且准一级动力学计算的平衡吸附量为3.94 mg/g,与试验结果接近;准二级动力学计算的平衡吸附量为2.71 mg/g,故准一级模型可有效解释吸附过程,即吸附剂对氨氮的吸附为物理吸附,且主要是被吸附剂表面吸附,验证了吸附等温线的拟合结果。

图9 准一级动力学与准二级动力学拟合Fig.9 Quasi-first-order dynamic and quasi-second-orderdynamic fitting

表5 准一级和二级吸附速率方程回归参数
3 结 论
1)以RCS为原料,添加NaAlO2补充Al源,NaOH提供碱性环境,水热合成氨氮吸附剂。相比RCS,吸附剂比表面积由267 m2/g升至311 m2/g,微孔比表面积占比由37.81%增至72.98%。吸附剂表面形成了较为规整的A型沸石和SAPO-20分子筛杂晶,有利于对氨氮的吸附。
2)在最佳试验条件下(吸附剂用量10 g/L,氨氮废水的初始浓度60 mg/L,初始pH=6.8,接触时间1 min),吸附剂对氨氮平衡吸附量可达3.5 mg/g,氨氮去除率为51.01%。
3)Freundlich方程可较好地描述氨氮在吸附剂上的被吸附行为,说明吸附剂对氨氮主要为多分子层吸附;Freundlich等温吸附方程式常数n=2.50,说明吸附剂对氨氮有较好的吸附性能。
4)吸附剂对氨氮的吸附符合准一级动力学方程,说明吸附剂对氨氮的吸附主要为物理吸附,且计算的平衡吸附量为3.94 mg/L,与试验结果接近。
