未成年患者经心内膜植入永久起搏器的病因分析及随访观察
2021-07-02林小花张建成张彦
林小花 张建成 张彦
心脏起搏是指暂时或长期(永久)地周期性发放低能量电脉冲刺激心脏,使之发生激动,以治疗窦性停搏、窦性心动过缓、房室阻滞等严重心动过缓。 目前未成年人植入起搏器的比例不到起搏器植入总数的 1%[1]。 本研究共收集了我院 17例经心内膜植入永久起搏器的未成年患者基本信息、病因、临床表现、心电图、心脏彩超、胸部正侧位片等相关数据,分析起搏器植入术前、术中及术后相关数据,评估起搏模式和起搏部位对心脏结构及功能的影响。
1 资料和方法
1.1 一般资料
纳入 2002年 1 月 30 日至 2017年 10 月 5 日在福建省立医院住院且需经心内膜植入永久起搏器的未成年患者 17例。 其中,男 8例、女 9例,年龄 5 个月~18(9.61 ±5.85)岁,身高 70~175 (131.35 ±33.97)cm,体重 5.0~62.5 (31.75 ±18.94)kg。 植入起搏器的原因(病因)中,7例为病毒性心肌炎后遗留的三度房室阻滞,6例为复杂先天性心脏病术后出现的三度房室阻滞,2例为不明原因所致的三度房室阻滞,2例为不明原因所致的病窦综合征伴扩张型心肌病。 先天性心脏病手术类型:室间隔缺损修补术2例,室间隔合并房间隔缺损修补术2例,法洛四联症矫治术2例。
1.2 研究方法
收集全部患者植入起搏器前后的心电图检查结果、心脏彩超检查结果、植入起搏器的类型、术后随访资料(包括心电图、心脏正侧位片、心脏彩超及起搏参数等)。
1.3 统计学处理
用SPSS 21.0 软件进行统计分析。 计数资料采用例数和百分比(%)表示,计量资料以表示;服从正态分布的计量资料组内前后自身对照采用配对样本t检验,组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 术前心电图特点
17例患者术前心房率 34~107(67.12 ±22.53)次/min,心室率 34~ 75(48.82 ± 11.30) 次/min。15例(88.2%)患者提示三度房室阻滞;QRSε波时限≥120 ms患者2例(图1);QRSε波时限 <120 ms 患者13例,其平均心房率(70.60 ±21.51) 次/min,平均心室率(49.87 ±11.37)次/min。 2例患者(11.8%)提示窦性停搏,24 h 心电图提示最长间歇分别为11.4 s(图2)、8.3 s,最慢心率依次为 12、25 次/min。

图1 1例三度房室阻滞(QRSε波时限≥120 ms)患者术前体表心电图Fig.1 Preoperative surface ECG of a patient with third-degree atrioventricular block(QRS duration≥120 ms)
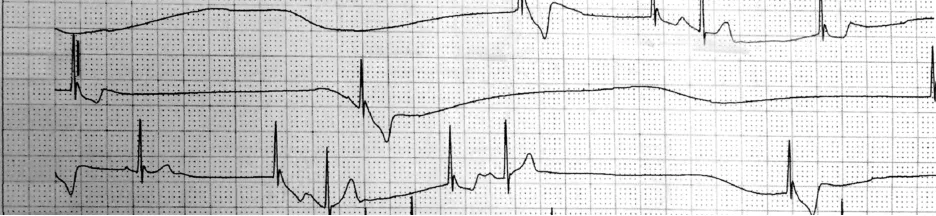
图2 1例窦性停搏最长间歇11.4 s 患者术前CH1 导联动态心电图Fig.2 Preoperative ambulatory electrocardiography in lead CH1 of a patient with the longest sinus arrest interval of 11.4 s
2.2 术前心脏彩超特点
2例(11.8%)全心扩大,室壁运动欠佳,伴二尖瓣及三尖瓣中度反流;3例(17.6%)左室轻度扩大,其中伴左心房轻度扩大1例;2例(11.8%)右心扩大;10例(58.8%)心脏未见扩大,其中轻度二尖瓣伴三尖瓣反流3例,二尖瓣轻到中度反流1例,无反流6例。
2.3 永久起搏器植入类型及手术情况
起搏方式:10例(58.8%)VVI(R)起搏,7例(41.2%)DDD(R)起搏,DDD(R)起搏中VAT 起搏1例。 17例患者中,1例患者术中因原发病死亡,另16例患者起搏频率60~110(75.13 ±13.98)次/min。VVI(R)起搏患者中,主动固定于右室心尖部5例,主动固定于右室间隔部5例。 DDD(R)起搏患者中,主动固定于右心耳+右室心尖部2例,主动固定于右心耳+右室流出道间隔部1例,主动固定于右房间隔部+右室间隔部1例,被动固定高位右房+主动右室间隔部1例,主动固定于右心耳+右室间隔部1例,主动固定于左心耳+右室间隔部1例。
2.4 术后随访情况
术后对13例患者定期进行门诊起搏器程控随诊,随访时间3 个月~15年(平均3.1年)。 术后13例患者活动耐量均较术前明显改善,心电图提示起搏感知带动良好,均未见起搏器囊袋感染、出血以及电极导线脱位等并发症。
随访病例中术后1年、 2年、 3年右室起搏阈值、阻抗、灵敏度均无变化。 2例患者分别于术后7年及14年因起搏器电池耗竭行起搏器电池置换术,余随访患者均暂未更换。
术后随访的13例患者中,全心扩大1例、左心增大2例、左室增大1例,余心腔大小均恢复正常,左室射血分数(LVEF)大致同术前,未见明显心功能恶化。
13例患者中,7例为VVI(R)起搏模式,6例为DDD(R)起搏模式。 心脏彩超检测数据显示,采用VVI(R)起搏模式的病例术后右心房内径(RAD)和左心室内径(RVD)均明显扩大(P均<0.05);其余各项心脏指标术后与术前间的差异均无统计学意义。 见表 1。
心室心尖部(5例)与室间隔(8例)两个部位起搏对心脏左室舒张末期内径(LVED)、RVD 及LVEF均无显著影响。 见表2。
术后胸片检查显示起搏器电极均在位,起搏器功能正常。 起搏电极导线均预留了一定长度,以适应未成年人身体生长的需求。 见图3。
表1 不同起搏模式患者植入术前后的心脏彩超指标对比 Tab.1 Comparison of preoperative and postoperative echocardiographic indexes in patients with different pacing modes

表1 不同起搏模式患者植入术前后的心脏彩超指标对比 Tab.1 Comparison of preoperative and postoperative echocardiographic indexes in patients with different pacing modes
VVI(R)起搏(n=7)超声指标DDD(R)起搏(n=6)术前 术后 t 值 P 值 术前 术后 t 值 P 值LAD/mm 2.23 ± 0.10 2.44 ± 0.12 -1.603 0.16 3.30 ± 0.74 3.39 ± 0.31 -0.311 0.76 LVED/mm 3.64 ± 0.27 3.56 ± 0.26 0.427 0.84 4.71 ± 0.52 4.92 ± 0.58 -0.829 0.45 RAD/mm 2.61 ± 0.21 2.93 ± 0.19 0.207 0.02 3.42 ± 0.79 3.56 ± 0.46 -0.562 0.60 RVD/mm 2.50 ± 0.18 2.86 ± 0.20 -3.036 0.03 3.43 ± 0.70 3.53 ± 0.39 -0.482 0.65 LVEF(%) 62.32 ± 4.01 62.14 ± 3.08 0.033 0.97 62.08 ± 5.97 61.15 ± 5.15 0.742 0.49
表2 心尖部起搏与室间隔起搏术前及术后心脏彩超相关指标对比 Tab.2 Comparison of preoperative and postoperative echocardiographic indexes in apical pacing and septal pacing

表2 心尖部起搏与室间隔起搏术前及术后心脏彩超相关指标对比 Tab.2 Comparison of preoperative and postoperative echocardiographic indexes in apical pacing and septal pacing
心尖部起搏(n=5)指标室间隔起搏(n=8)术前 术后 t 值 P 值 术前 术后 t 值 P 值LVED/mm 3.99 ± 0.20 3.89 ± 0.38 0.194 0.86 4.22 ± 1.01 4.36 ± 0.98 -0.701 0.51 RVD/mm 2.75 ± 0.23 2.97 ± 0.28 -2.219 0.91 3.05 ± 0.87 3.32 ± 0.54 -1.390 0.21 LVEF(%) 61.16 ± 5.07 60.00 ± 3.91 0.159 0.88 62.88 ± 6.88 62.26 ± 5.17 0.251 0.81

图3 1例未成年患者经心内膜植入VVI(R)起搏器术后1 d与术后4年心脏正侧位片Fig.3 Heart anterolateral radiographs of a minor patient one day and 4 years after endocardial VVI(R)pacemaker implantation
3 讨论
本组资料显示,未成年患者永久起搏器植入的主要病因为病毒性心肌炎导致的三度房室阻滞、复杂先天性心脏病术后出现的三度房室阻滞,而病窦综合征罕见。 流行病学研究表明,在病毒流行期病毒性心肌炎发病率约为5%,新生儿、儿童中的发病率约为0.36%,其导致的高度及三度房室阻滞经治疗后部分患者仍不可恢复,需植入永久起搏器,为未成年人起搏器植入的首要原因[2]。 而复杂先天性心脏病术后发生的高度房室阻滞则为未成年人起搏器植入的另一个主要病因。 导致阻滞的先天性心脏病,主要为室间隔缺损,其次为矫正性大动脉转位[3]。 先天性完全性房室阻滞则更为罕见,有研究表明,新生儿中的发病率仅在(1/15 000)~(1/22 000)[4]。 本研究中先天性心脏病术后致房室阻滞患者中,66.7%为室间隔缺损修补术后,而33.3%为法洛四联症矫治术后。 本研究中11.8%为不明原因高度房室阻滞患者,目前暂不能排除先天性因素所致;病窦综合征患儿(11.8%)病因尚不清楚,可能原因为隐匿性病毒性心肌炎累及的窦房结病变或先天性的窦房结发育异常,有待进一步明确。
永久起搏器有经心内膜和经心外膜两种植入途径。 心内膜起搏具有创伤小、导线不易磨损、起搏阈值低、使用寿命长等优势。 近年来,随着心内膜起搏器应用研究的不断进展,对患者年龄(婴幼儿)、体重( <10 kg)的限制不断被打破[5]。 本研究中17例患者起搏器植入途径均为经静脉心内膜永久起搏,手术成功的患者中年龄最小的仅2 周岁,体重12.5 kg,术后未发生起搏器相关并发症。
目前最常用的两种起搏模式是DDD(R)起搏和VVI(R)起搏。 研究发现DDD(R)起搏影响心脏射血分数,使射血分数下降,从而影响心功能。 汪汉等[6]研究表明,DDD(R)起搏比 VVI(R)起搏更能降低房颤的发生率,同时更能缩小左房直径及LVEDD,但两类起搏方式的远期生存率无明显差异[7]。 本 研 究 使 用 VVI (R) 模 式 起 搏 10例(58.8%),DDD(R)模式起搏 7例(41.2%)。 VVI(R)组手术前后的RAD、RVD 间的差异有统计学意义(P<0.05),但 LVEF、LAD 及 LVED 间的差异则无统计学意义,心功能未见恶化。 一方面,与接近心脏生理性起搏的房室同步性DDD(R)起搏比较,VVI(R)起搏方式房室起搏不同步,更易导致血流动力学改变,引起右室重构,使右室及右房内径增大。 另一方面,未成年人仍处于生长发育阶段,随着年龄的增长,心腔内径会发生生理性增大。 未成年人,尤其是年龄较小的患儿,心腔狭窄、静脉管腔细小,易导致静脉血管栓塞,造成DDD(R)起搏两根电极导线难以通过。 因此,对于年龄较小的患儿,多数植入单电极导线起搏器VVI(R)。 随着更适合用于儿童的细导线的出现,近年来未成年人双腔起搏器植入逐渐趋于低龄化。 使用单腔起搏器的患儿待身体发育成熟,时机恰当时可升级更换成双腔起搏器,从而减少心血管栓塞并发症。
有研究表明,心脏永久起搏器植入术后并发症的发生率在 8.2%~ 17.4%[8],而未成年人的发生率更高,主要包括电极导线、囊袋、手术操作相关等并发症。 Welisch 等[5]的研究显示,植入永久起搏器的患儿电极相关并发症发生率为18%,早期心脏穿孔的发生率为5%~7%。 囊袋相关并发症临床上最常见,主要表现为囊袋的积血、感染以及破裂。手术操作相关并发症包括误穿刺锁骨下动脉、气胸、冠状静脉口夹层及冠状静脉注入气泡。 Lalu等[9]研究发现,气胸的发生与锁骨下静脉穿刺相关,发生率为0.66%~1.8%。 本组患者起搏器植入时导线均预留了适当长度,多采用主动电极固定,82.3%的患者选择在胸大肌下制作囊袋,随访至今均尚未发生囊袋、电极导线等相关并发症,术后程控起搏参数均良好。
