苦豆子不同器官浸提液、干粉对伽师瓜种子萌发及幼苗、植株生长的影响
2021-07-01麦麦提艾则孜·穆合塔尔王东刘艳全
麦麦提艾则孜·穆合塔尔 王东 刘艳全


摘要:为探讨苦豆子对伽师瓜种子萌发和植株生长的作用,采用培养皿滤纸法和盆栽法,通过形态和生理生化指标测定,分析了苦豆子叶片、茎秆、豆荚和种子分别对伽师瓜种子萌发及幼苗、植株生长的影响。结果表明,苦豆子叶片、茎秆、豆荚和种子浸提液对伽师瓜种子萌发均具有抑制作用,其中豆荚浸提液的抑制作用最强,叶片浸提液的抑制作用最弱。苦豆子叶片、茎秆、豆荚和种子浸提液对伽师瓜幼苗的生长均具有促进作用,其中茎秆浸提液具有较大的促进作用。此外,苦豆子叶片、茎秆、豆荚和种子干粉对伽师瓜植株高度、粗度、叶片总面积、干物质积累量(干质量)以及叶绿素含量等均具有促进作用,其中叶片干粉和种子干粉的促进作用强于茎秆干粉和豆荚干粉。
关键词:伽师瓜;苦豆子;种子萌发;植株生长;南疆
中图分类号: S652.901 文献标志码: A 文章编号:1002-1302(2021)09-0100-07
伽师瓜(Cucumis melo)因产地在新疆喀什地区伽师县而得名,是瓜果珍品之一[1-2]。作为特色瓜类作物,对当地经济社会发展和农业增收具有重要的现实意义[3-4]。苦豆子(Sophora alopecuroides)作为豆科槐属多年生草本植物,广泛分布于我国新疆、青海、宁夏等地区,是一种非常重要的绿肥植物[5-6]。虽然目前有关整株苦豆子对伽师瓜植株生长、产量、品质的影响有少量研究报道[7-9],但有关苦豆子植株不同部位,例如苦豆子叶片、豆荚、种子等对伽师瓜种子萌发、幼苗和植株生长的影响鲜有报道。闰兴富等研究表明,整株苦豆子(包含根、茎、叶和种子)的甲醇浸提物对沙棘种子萌发有促进作用,萌发率比对照高95.6%,而对枸杞种子萌发没有显著影响[10]。陈波浪等研究发现,伽师瓜在伸蔓期,施用有机肥,同时将鲜草苦豆子地上部分作为绿肥施用,能够有效提高土壤中氮(N)、磷(P)的含量[11]。党艳青等研究发现,苦豆子浸提物能提高伽师瓜幼苗叶片中蔗糖合成酶的活性[7]。齐晓晨等研究发现,盆栽种植伽师瓜时,添加一定量的有机肥,同时施用整株苦豆子作为绿肥,可以提高伽师瓜的果实平均质量、果实纵径和横径、蒸腾速率、水分利用率和光合作用[8-9]。苦豆子在我国分布广泛,是一种非常有开發前景的野生豆科绿肥植物。本试验以伽师瓜为供试作物,以南疆地区的野生苦豆子植株作为材料,通过测定伽师瓜种子的萌发率、发芽势和发芽指数,分析苦豆子叶片、茎秆、豆荚和种子对伽师瓜种子萌发的影响。此外,通过测定伽师瓜植株形态、生长和生理指标,研究苦豆子叶片、茎秆、豆荚和种子对伽师瓜幼苗和植株生长的影响,以期为伽师瓜种植和苦豆子资源的保护利用提供依据。
1 材料与方法
试验于2019—2020年在喀什大学生命与地理科学学院新疆帕米尔高原生物资源与生态重点实验室完成。
1.1 材料
伽师瓜(常规种)购自国家瓜类工程技术研究中心新疆西域种业股份有限公司,苦豆子植株采自新疆喀什市。种植伽师瓜的营养土购自广州绿源园艺植材植料场。
所用仪器:紫外分光光度计(T6系列,北京普析通用仪器有限责任有限公司)、高速万能粉碎机(FW-80型,北京市永明医疗仪器有限公司)、灭菌锅(YXQ-LS-50A型,上海博迅医疗生物仪器股份有限公司)、游标卡尺、电子天平(LE2002E型,梅特勒-托利多仪器有限公司)、电热恒温鼓风干燥箱(DHG-9240A型,上海齐欣科学仪器有限公司)、空气浴恒温摇床(KW-1000DB型,金坛市亿通电子有限公司)。
1.2 苦豆子干粉以及浸提液的制备
将采集的苦豆子植株在室内自然风干,之后从风干的苦豆子植株上分别采集叶片、豆荚、茎秆、种子。用粉碎机分别将叶片、豆荚、茎秆、种子彻底粉碎,将干粉装入瓶中备用。选取4个 250 mL 三角瓶,用电子天平分别称取5 g叶片、豆荚、茎秆、种子干粉,分别装入4个三角瓶中,之后每个三角瓶中装入100 mL经高温高压灭菌的无菌蒸馏水,混匀之后在空气浴恒温摇床中于27 ℃、50 r/min 条件下恒温恒速摇匀12 h,然后分别用3层纱布过滤,以获得叶片、豆荚、茎秆、种子浸提液备用。
1.3 伽师瓜种子萌发试验以及测定指标
选取25个直径为9 cm的玻璃培养皿,经高温高压灭菌后备用。本试验共设置4个处理:苦豆子豆荚浸提液处理(T1)、苦豆子茎秆浸提液处理(T2)、苦豆子叶片浸提液处理(T3)、苦豆子种子浸提液处理(T4),同时以无菌蒸馏水作为对照处理(CK),每个处理设置5个重复。选取籽粒饱满、均匀一致的伽师瓜种子放置在铺有双层滤纸的玻璃培养皿中,首先向每个培养皿中均匀放置伽师瓜种子,之后向每个处理的5个培养皿中分别加入5 mL相应处理的浸提液,对照处理的5个培养皿分别加入5 mL无菌蒸馏水,之后置于20~25 ℃、12 h/12 h光/暗交替、光照度为4 200 lx的植物培养室中进行培养,每天向每个培养皿中加入1 mL无菌蒸馏水,共培养7 d,每天观察记录种子萌发与生长情况。
根据文献报道,以胚根伸出种子一半长度(大约2 mm)作为种子萌发标准。每天在固定时间点观察记录种子的萌发情况,7 d后按以下公式计算种子的萌发率、发芽势以及发芽指数等指标[12-13]:
萌发率=(7 d内萌发的所有种子数/供试总种子数)×100%;发芽势=(前4 d萌发的所有种子数/供试总种子数)×100%;发芽指数=∑ti=1Gt/Dt(Gt表示t日内的发芽数,Dt表示相应的发芽天数)。
1.4 伽师瓜幼苗生长试验以及测定指标
在伽师瓜种子萌发试验7 d后,培养皿中萌发的伽师瓜种子已生长成为两片子叶期的幼苗,通过观察并计算各个处理幼苗的侧根数、主根长度、胚轴长度、鲜质量、干物质积累量(干质量)等指标,从而分析苦豆子不同部位浸提液对伽师瓜幼苗生长的影响。
侧根数指主根上的侧根数,可直接通过观测获得,随后计算出各处理每个幼苗的平均侧根数。使用游标卡尺测量幼苗的主根长度(根系中最长的根)和胚轴长度(幼苗子叶与根之间的长度),计算出每个处理中每个幼苗的平均主根长度和平均胚轴长度。称量幼苗鲜质量时,首先用滤纸将幼苗上的水分吸干,然后使用电子天平称量幼苗鲜质量,计算出每个处理中每个幼苗的平均鲜质量。称量鲜质量后,将幼苗放入电热恒温鼓风干燥箱彻底烘干至恒质量为止,使用电子天平称量幼苗的干物质积累量(干质量),计算出每个处理中每个幼苗的平均干质量。
1.5 伽师瓜植株生长试验以及测定指标
选取25个大小和颜色完全一致的花盆(15 cm×11 cm×9 cm)备用。本试验共设置5个处理,分别为苦豆子豆荚干粉处理(T1′)、苦豆子茎秆干粉处理(T2′)、苦豆子叶片干粉处理(T3′)、苦豆子种子干粉处理(T4′)以及对照处理(CK),每个处理设置5个重复。
苦豆子干粉处理步骤:使用电子天平准确称取营养土和干粉;向25个花盆中分别装入128 g 干燥的营养土;分别向每个处理的每个花盆中加入10 g相应的干粉和50 mL清水后混合均匀;每盆播种8粒籽粒饱满、大小一致的伽师瓜种子,播种深度为1.5 cm;同时以在营养土中直接播种作为对照处理,对照处理的其他方面与干粉处理保持完全一致。播种完成后每盆浇清水250 mL,然后在室外自然光照条件下进行培养;待幼苗长至两片子叶完全展开时,根据幼苗生长情况,每盆中选留4株生长一致的健康伽师瓜幼苗作为试验用苗,其余幼苗拔除。定苗之后测定指标及测量方法如下:
1.5.1 伽师瓜植株高度的测量 定苗之后每6 d使用游标卡尺测量1次植株高度。本试验中测定的植株高度指植株茎基部到植株顶端生长点的长度。通过测量每株伽师瓜植株的高度,分别计算出每个处理的伽师瓜植株的平均高度。植株生长期间共测定7次并计算植株的平均高度。
1.5.2 伽师瓜植株粗度的测量 定苗之后每6 d使用游标卡尺测量1次植株粗度。本试验中测定的植株粗度指幼苗子叶下方2 cm处的茎粗。通过测量每株伽师瓜植株的粗度,分别计算出每个处理的伽师瓜植株的平均粗度。植株生长期间共测定7次并计算平均植株粗度。
1.5.3 伽师瓜植株叶片面积的测量 定苗之后每6 d测量1次植株叶片面积。采用透明方格法测量叶片面积[14]。通过测量每株伽师瓜植株上所有叶片的总面积,分别计算出每个处理的每株伽师瓜叶片的平均总面积。植株生长期间共测量7次并计算叶片平均总面积。
1.5.4 伽师瓜植株干质量的测量 将每盆中的伽师瓜植株根部连同土壤一起倒入清水中,通过多次漂洗,将每株伽师瓜的根部清洗干净,然后使用干净的刀片切割植株的茎基部,将伽师瓜植株的地上部分和地下部分分开。用干净滤纸将水分吸干后放入电热恒温鼓风干燥箱彻底烘干至恒质量为止,使用电子天平分别称量地上部分和地下部分的干质量。将地上部分和地下部分的干物质积累量相加获得植株总干质量。
1.5.5 伽师瓜植株叶片叶绿素含量的测定 在同一时间针对每个处理的5个重复,从每盆的4株伽师瓜中任选1株取0.5 g生长点下第2片完全展开的真叶,采用Arnon乙醇提取法[15]测定叶绿素含量,计算各处理的平均叶绿素含量。
1.6 数据处理
运用Excel和SPSS 25.0对测定数据进行处理与分析,试验结果用平均值±标准差来表示。利用OriginPro 2018软件对测定数据进行绘图。
2 结果与分析
2.1 苦豆子浸提液对伽师瓜种子萌发的影响
由表1可知,对照组(CK)的伽師瓜种子萌发率、发芽势和发芽指数均大于处理组,因此苦豆子叶片、茎秆、豆荚和种子浸提液对伽师瓜种子萌发均具有抑制作用。T1、T2、T3、T4处理的萌发率和发芽指数均显著低于CK(P<0.05)。从发芽势统计结果来看,除了T3处理与对照组CK无显著差异外,T1、T2、T4处理的发芽势均显著低于对照组CK。与其他处理组相比,T1处理的萌发率、发芽势和发芽指数大体上均最小,这表明苦豆子豆荚浸提液对伽师瓜种子萌发的抑制性最强,而T3处理的萌发率、发芽势和发芽指数均最大,这表明苦豆子叶片浸提液对伽师瓜种子萌发的抑制性最弱。
2.2 苦豆子浸提液对伽师瓜幼苗生长的影响
由表2可知,CK每株伽师瓜幼苗的胚轴长度、主根长度、侧根数目、鲜质量和干质量均小于处理组,因此苦豆子叶片、茎秆、豆荚和种子浸提液对伽师瓜幼苗的生长均具有促进作用。T2除了干质量小于T1之外,其胚轴长度、主根长度、侧根数目以及鲜质量均大于其他处理。所有处理的干质量与CK均无显著差异,而所有处理的鲜质量均显著高于CK。此外,除了鲜质量以外,苦豆子种子浸提液(T4)处理的胚轴长度、主根长度、侧根数目和干质量与对照组CK间均无显著差异。综合来看,苦豆子茎秆浸提液对伽师瓜幼苗的生长具有较大的促进作用。
2.3 苦豆子干粉对伽师瓜植株生长的影响
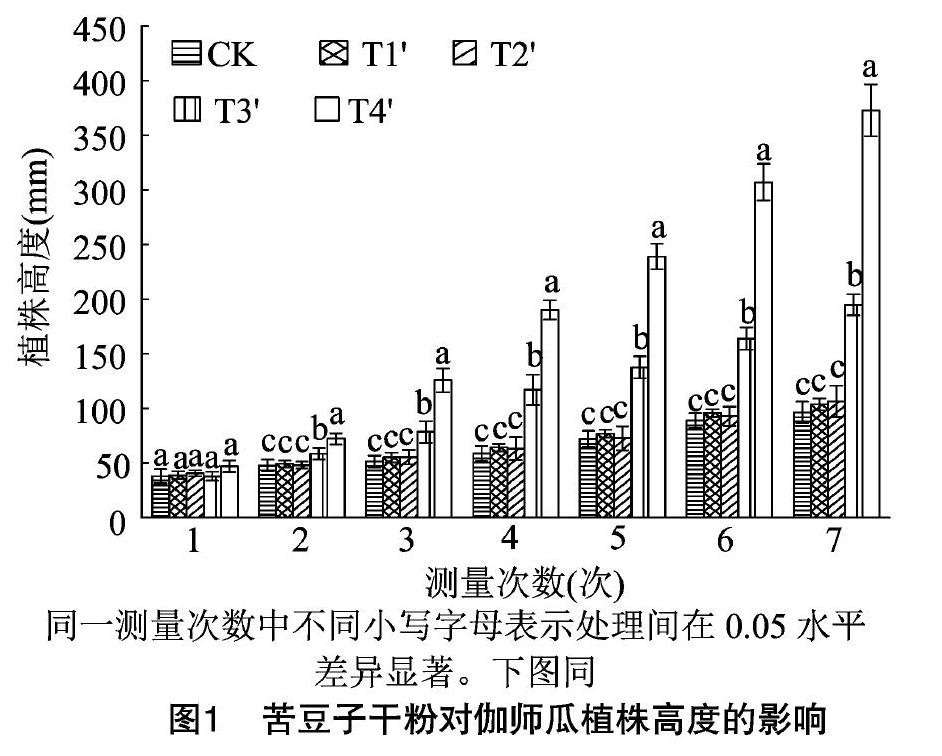
2.3.1 苦豆子干粉对伽师瓜植株高度的影响 由图1和图2可知,苦豆子叶片、茎秆、豆荚和种子干粉对伽师瓜植株均具有增高作用。T3′和T4′处理对伽师瓜植株的增高作用明显强于T1′和T2′处理,而且随着时间的延长,T3′和T4′处理的增高作用越来越明显。第1次测量时,所有处理组与对照组CK均无显著差异,但从第2次测量开始,T3′、T4′处理植物株高均与CK有显著差异。此外,T4′处理对伽师瓜植株的增高作用又明显强于T3′处理,从第2次测量开始,T4′处理的植株高度显著高于T3′处理。因此,苦豆子叶片干粉和种子干粉对伽师瓜植株具有显著的增高作用,其中苦豆子种子干粉的增高作用更强。
2.3.2 苦豆子干粉对伽师瓜植株粗度的影响 由图3可知,苦豆子叶片、茎秆、豆荚和种子干粉对伽师瓜植株均具有增粗作用。T3′和T4′处理对伽师瓜植株的增粗作用明显强于T1′和T2′处理,而且随着时间的延长,T3′和T4′处理的增粗作用越来越明显。从第2次测量开始,T3′、T4′处理的植株粗度均显著大于CK 。此外,T4′处理对伽师瓜植株的增粗作用又明显强于T3′处理,从第2次测量开始,T4′的植株粗度均显著大于T3′处理。因此,苦豆子叶片干粉和种子干粉对伽师瓜植株具有显著的增粗作用,其中苦豆子种子干粉的增粗作用更强。
2.3.3 苦豆子干粉对伽师瓜植株叶片总面积的影响 由图4可知,苦豆子叶片、茎秆、豆荚和种子干粉对伽师瓜植株叶片面积均具有增大作用。T3′和T4′处理对伽师瓜植株叶片面积的增大作用明显强于T1′和T2′处理,而且随着时间的延长,T3′和T4′处理的增大作用越来越明显。从第2次测量开始,T3′和T4′处理的叶片总面积均显著大于CK 。其中,T4′处理对伽师瓜植株叶片面积的增大作用明显强于T3′处理,从第2次测量开始,T4′处理的叶片总面积均显著大于T3′。因此,苦豆子叶片干粉和种子干粉对伽师瓜植株叶片面积具有显著的增大作用,其中苦豆子种子干粉的增大作用更强。
2.3.4 苦豆子干粉对伽师瓜植株干质量的影响 由表3、图2和图5可以看出,苦豆子叶片、茎秆、豆荚和种子干粉对伽师瓜植株地上部分干质量、地下部分干质量和总干质量均具有增大作用。T3′和T4′处理对伽师瓜植株干质量的增大作用均显著强于CK、T1′、T2′处理,T4′植株各部分及总干质量均显著高于T3′处理,而T1′、T2′处理与CK均无显著差异。因此,苦豆子叶片干粉和种子干粉对伽师瓜植株干质量具有显著的增大作用,其中苦豆子种子干粉的增大作用更强。
2.3.5 苦豆子干粉对伽师瓜植株叶片叶绿素含量的影响 由表4可知,苦豆子叶片、茎秆、豆荚和种子干粉对伽师瓜植株叶片叶绿素含量均具有增高作用(T2′除外)。T3′和T4′处理伽师瓜植株叶片叶绿素含量显著高于CK、T1′、T2′处理,其中T4′处理植株叶片叶绿素含量最高,显著高于T3′,而T1′和T2′处理与对照组CK均无显著差异。因此,苦豆子叶片干粉和种子干粉对伽师瓜植株叶片叶绿素含量具有显著的增高作用,其中苦豆子种子干粉的增高作用更强。
3 讨论与结论
目前有关苦豆子植株及其不同部位浸提液能否影响伽师瓜种子的萌发研究鲜有报道。周立彪等研究表明,苦豆子甲醇、乙醇、丙酮和蒸馏水浸提液对老瓜头种子的萌发均具有抑制作用,其中蒸馏水浸提液的抑制作用最强[16]。闫兴富等研究表明,苦豆子甲醇、乙醇、丙酮和去离子水浸提液对向日葵种子的萌发具有抑制作用,其中去离子水浸提液的抑制作用最强[17]。吕笃康等研究表明,苦豆子种子蒸馏水浸提液对高羊茅种子萌发具有一定的抑制作用[18]。这些研究表明,苦豆子浸提液对植物种子萌发普遍具有抑制作用,本研究结果与之一致。但闫兴富等研究表明,苦豆子甲醇和乙醇浸提液对沙棘种子萌发具有促进作用,而苦豆子丙酮和蒸馏水浸提液对沙棘种子萌发具有抑制作用[10]。此外,苦豆子乙醇、丙酮和蒸馏水浸提液对枸杞种子萌发具有促进作用,而苦豆子甲醇浸提液对枸杞种子萌发具有抑制作用。该研究表明苦豆子浸提液对某些植物种子萌发也具有一定的促进作用,但值得注意的是,苦豆子蒸馏水浸提液对沙棘和枸杞种子萌发均具有抑制作用。综上所述,苦豆子蒸馏水浸提液对各类植物种子的萌发都具有抑制作用。本研究结果表明,苦豆子叶片、茎秆、豆荚和种子蒸馏水浸提液对伽师瓜种子萌发均具有抑制作用,其中苦豆子豆荚蒸馏水浸提液对伽师瓜种子萌发的抑制性最强,苦豆子叶片蒸馏水浸提液的抑制性最弱。植物可通过挥发、腐烂分解、分泌和淋溶等途径释放化感物质,这些化感物质可影响周围环境中其他植物种子的萌发,降低其他植物种子的萌发率并延迟萌发时间[19-21]。多数植物的化感物质随着浓度降低,抑制其他植物种子萌发的作用也减弱[22],甚至有些化感物质在低浓度时可以促进其他植物种子的萌发[23-24]。本研究中并没有观察到苦豆子浸提液促进伽师瓜种子萌发的作用,这可能是由于本研究所使用的苦豆子浸提液中化感物质有效浓度远大于促进种子萌发的浓度范围,也可能与南疆苦豆子中所含有的化感物质种类以及伽师瓜种子对化感物质的敏感性不同有关,具体原因有待进一步深入研究。
此外,有报道表明,植株不同部位对种子萌发的化感效应存在较大差异,植物叶片水浸提液对种子萌发的化感作用更强[25-26]。苦豆子中的化感物质可能是生物碱,相比于叶片等其他部位,苦豆子种子中总生物碱含量最高[27-28]。据此推断,苦豆子种子浸提液对伽师瓜种子萌发的抑制作用应该最强,但本研究结果显示苦豆子豆荚浸提液对伽师瓜种子萌发的抑制性强于种子(表1),推测可能有两方面原因,一方面可能是由于生长在南疆地区的苦豆子所含有的生物碱种类以及在植株体内的分布与其他地区的苦豆子有差异,或者植株体内产生物碱的内生真菌与其他地区有所差异[29-30],另一方面可能是长期生存在南疆地区的伽师瓜的种子萌发对苦豆子生物碱的敏感性与其他作物有所不同。因此,应该在测定南疆苦豆子植株生物碱的种类、含量以及在植株体内分布的基础上,进一步揭示苦豆子生物碱对伽师瓜种子萌发的影响。
本研究结果表明,苦豆子叶片、茎秆、豆荚、种子浸提液对伽师瓜种子萌发均具有抑制作用,因此,不建议苦豆子作为底肥在伽师瓜播种之前施用。而苦豆子叶片、茎秆、豆荚和种子浸提液对伽师瓜幼苗和植株的生长均具有促进作用,建议苦豆子在伽师瓜种子萌发之后作为追肥施用。在苦豆子叶片、茎秆、豆荚、种子浸提液对伽师瓜植株生长影响的盆栽试验中也发现,苦豆子植株不同部位浸提液处理组的种子萌发率均低于对照组,这进一步表明苦豆子对伽师瓜种子的萌发具有抑制作用。苦豆子含有丰富的生物碱,生物碱不但是一种重要的化感物质,在开发植物绿肥中具有应用价值,而且还具有药理活性,可用于医药研发和农作物病虫害防控[31-37]。本研究结果显示,苦豆子种子干粉对伽师瓜植株生长的促进作用强于叶片、茎秆和豆荚。这可能是因为,相比于叶片等其他部位,苦豆子种子中总生物堿的含量最高[27-28]。熊鑫等研究表明,苦豆子生物碱在营养期能促进番茄的生长,在生殖期能促进果实增产,对番茄果实的品质无不利影响[38]。有关苦豆子种子干粉能有效促进伽师瓜植株生长的具体原因有待下一步详细研究。此外,目前尚无有关苦豆子生物碱对伽师瓜产量和品质影响的研究报道,有关这方面的研究也需要进一步开展。
参考文献:
[1]玛尔哈巴·帕尔哈提,白羽嘉,李 梦,等. 贮前光照处理对伽师瓜贮藏品质及部分防御酶活性影响[J]. 食品工业科技,2019,40(2):271-275,281.
[2]阿依仙木古丽·阿布来提,海米提·斯拉木,仙米西努尔·克里木,等. 喀什地区发展伽师瓜产业的气候条件分析[J]. 农业灾害研究,2018,8(1):51-52.
[3]陈波浪,吴海华,罗 佳,等. 土壤速效磷浓度对立架甜瓜生物量和磷素累积特征的影响[J]. 干旱地区农业研究,2016,34(4):153-158.
[4]李锦虎. 土壤条件对伽师瓜品质和产量的影响研究[J]. 农业与技术,2018,38(11):89-90.
[5]史芳芸,邱明宁,李国中,等. 苦豆子资源现状、化学成分、毒性及其开发利用研究进展[J]. 黑龙江畜牧兽医,2019(13):34-38.
[6]于 蕾,张连芳,东 方,等. 苦豆子中主要生物碱药理作用的研究进展[J]. 北京联合大学学报(自然科学版),2015,29(2):61-66.
[7]党艳青,刘琛璠,叶 林. 苦豆子浸提物对伽师瓜蔗糖合成酶和酸性转化酶活性的影响[J]. 北方园艺,2017(9):24-29.
[8]齐晓晨,赵 库,叶祖鹏,等. 苦豆子绿肥对甜瓜生长及营养特性的影响[J]. 中国农业科技导报,2018,20(6):104-112.
[9]齐晓晨,叶祖鹏,赵库,等. 苦豆子绿肥对甜瓜光合性能日变化及品质的影响[J]. 中国土壤与肥料,2019(4):178-186.
[10]闫兴富,方 苏,杜茜,等. 苦豆子浸提物對沙棘和枸杞种子萌发的化感效应[J]. 中国种业,2011(3):30-32.
[11]陈波浪,柴仲平,吴海华,等. 施用绿肥(苦豆子鲜草)对立架甜瓜土壤速效养分与产量的影响[J]. 中国土壤与肥料,2015(5):94-98.
[12]臧全宇,马二磊,黄芸萍,等. 甜瓜不同材料种子萌芽期耐低温性评价研究[J]. 宁波农业科技,2019(3):9-12.
[13]王玉萍,王映霞,白向利,等. 硅对NaCl胁迫下甜瓜种子萌发及幼苗生长的影响[J]. 草业学报,2015,24(5):108-116.
[14]乔宝营,黄海帆,张信栓,等. 草莓叶面积简易测定方法[J]. 果树学报,2004,21(6):621-623.
[15]闫 震,聂继云,程 杨,等. 水果、蔬菜及其制品中叶绿素含量的测定[J]. 中国果树,2018(2):59-62,72.
[16]周立彪,闫兴富,石 淳,等. 苦豆子浸提物对老瓜头种子萌发的化感作用[J]. 江苏农业科学,2011,39(5):499-501.
[17]闫兴富,周立彪,方 苏,等. 苦豆子对向日葵种子萌发的化感作用[J]. 湖北农业科学,2011,50(16):3334-3337.
[18]吕笃康,巴音山,刘 影,等. 苦豆子浸出液对高羊茅种子萌发及幼苗生长的影响[J]. 新疆农业科学,2012,49(8):1477-1482.
[19]Wei M,Wang S,Wu B D,et al. Combined allelopathy of Canada goldenrod and horseweed on the seed germination and seedling growth performance of lettuce[J]. Landscape and Ecological Engineering,2020,16:299-306.
[20]Paulo J F,Patríciada C Z,Alfredo J P A,et al. Conyza sumatrensis allelopathy effect on Bidens pilosa (Asteraceae) seed germination[J]. Botanical Sciences,2020,98(2):348-354.
[21]Shekoofa A,Safikhan S,Raper T B,et al. Allelopathic impacts of cover crop species and termination timing on cotton germination and seedling growth[J]. Agronomy,2020,10(5):1-5.
[22]方 芳,郭水良,黄 华,等. 开花期加拿大一枝黄花水浸提液对3种作物种子萌发和幼苗生长的影响[J]. 植物研究,2007,27(5):569-573.
[23]李 夏,周宝利,陈绍莉,等. 茄子自毒物质对辣椒种子萌发及枯萎菌的化感效应[J]. 生态学报,2009,29(2):960-965.
[24]王广印,孙晓娜,谢玉会,等. 辣椒植株水浸液对4种蔬菜种子萌发的化感效应[J]. 农业现代化研究,2008,29(6):761-764.
[25]闫兴富,杜 茜,方 苏,等. 火炬树水浸提液对玉米种子萌发的化感效应[J]. 种子,2010,29(3):15-18.
[26]王广印,韩世栋,谢玉会,等. 辣椒植株水浸液对辣椒和番茄种子萌发的自毒作用[J]. 华北农学报,2009,24(3):123-127.
[27]李春英,胡永强. 苦豆子中生物碱的分布及其在生长期内的含量变化[J]. 植物生理学通讯,2009,45(9):910-912.
[28]秦学功,元英进. 苦豆子种子中生物碱的冷浸提取实验研究[J]. 中草药,2001,32(7):604-606.
[29]余永涛,何生虎,赵清梅. 宁夏苦豆子中产苦参碱内生真菌的分离与鉴定[J]. 中国农业科学,2013,46(13):2643-2654.
[30]Turbat A,Rakk D,Vigneshwari A,et al. Characterization of the plant growth-promoting activities of endophytic fungi isolated from Sophora flavescens[J]. Microorganisms,2020,8(5):1-15.
[31]Ma T,Shi X L,Ma S J,et al. Evaluation of physiological and biochemical effects of two Sophora alopecuroides alkaloids on pea aphids Acyrthosiphon pisum[J]. Pest Management Science,2020,76(12):4000-4008.
[32]Zhang Y B,Zhang X L,Chen N H,et al. Four matrine-based alkaloids with antiviral activities against HBV from the seeds of Sophora alopecuroides[J]. Organic Letters,2017,19(2):424-427.
[33]Jia F,Sun M Y,Zhng X J,et al. Total alkaloids of Sophora alopecuroides-and matrine-induced reactive oxygen species impair biofilm formation of Staphylococcus epidermidis and increase bacterial susceptibility to ciprofloxacin[J]. Chinese Herbal Medicines,2020,12(4):390-398.
[34]張 涓,李晓会,冯学玲,等. 苦豆子生物碱抗烟曲霉、须癣毛癣菌和新生隐球菌的作用研究[J]. 中国真菌学杂志,2020,15(2):72-77.
[35]Tsolmon M,Oyundari G,Yu O,et al. Establishment of callus and cell suspension culture of Sophora alopecuroides Linn. for the production of oxymatrine[J]. Journal of Phytology,2020(12):35-39.
[36]Wang R Z,Deng X X,Gao Q X,et al. Sophora alopecuroides L.:an ethnopharmacological,phytochemical,and pharmacological review[J]. Journal of Ethnopharmacology,2019,248,112172.
[37]Wang X F,Zhu Z,Hao T T,et al. Alopecines A-E,five chloro-containing matrine-type alkaloids with immunosuppressive activities from the seeds of Sophora alopecuroides[J]. Bioorganic Chemistry,2020,99:103812.
[38]熊 鑫,郭树奇,李 琳,等. 苦豆子生物碱对番茄生长及果实品质的影响[J]. 中国农业科学,2015,48(9):1737-1746.
