超高效液相色谱-串联质谱法同时测定土壤中30种抗生素
2021-07-01朱青青胡立刚廖春阳
胡 钰, 朱青青, 胡立刚,3, 廖春阳,3*
(1. 中国科学院生态环境研究中心, 环境化学与生态毒理学国家重点实验室, 北京 100085; 2. 中国科学院大学资源与环境学院, 北京 100049; 3. 国科大杭州高等研究院环境学院, 浙江 杭州 310000)
抗生素不仅可以作为药物治疗和预防感染病,还可以作为生长促进剂广泛应用于禽畜养殖业和水产养殖业[1]。然而当前抗生素过量使用严重,据统计,每年全球范围内抗生素的使用量在100 000至200 000吨之间[2]。研究表明,人类和动物摄入的抗生素会以母体或活性代谢产物的形式随粪便和尿液排出体外,并在医院、污水处理厂和禽畜养殖场的废水和污泥中富集,最终被排放到水和土壤等环境介质中[1]。源源不断进入环境中的抗生素可促进耐药性细菌的增殖,对人类健康造成潜在风险[3]。因此,欧盟、美国、澳大利亚和中国均已采取措施限制抗生素的使用,并限定动物肌肉中抗生素的最大残留限量,如欧盟规定动物肌肉中林可霉素的最大残留限量为100 μg/kg[4]。《中华人民共和国农业农村部公告第194号》规定自2020年起,停止生产、进口、经营、使用包括抗生素在内的促生长类药物饲料添加剂[5]。
建立土壤中多种类多残留抗生素的分析方法可为土壤中抗生素的监测和风险评估提供方法学基础。土壤基质复杂,土壤中抗生素残留种类繁多,且多在痕量水平,高灵敏度的仪器方法、有效的净化和富集方法、多种类抗生素的同时检测是土壤中抗生素检测的重点和难点。抗生素的仪器分析方法包括毛细管电泳法、酶联免疫法、高效液相色谱(HPLC)-紫外/荧光法和高效液相色谱-串联质谱法(MS/MS)等[6-11],其中HPLC-MS/MS因其特异性强和灵敏度高等特点,更适合用于土壤中多种类抗生素的痕量分析。土壤中抗生素的净化富集方法包括串联固相萃取、固相萃取(SPE)和QuEChERS(quick, easy, cheap, effective, rugged and safe)等[10-12]。李晓晶等[10]采用SAX-HLB串联固相萃取-超高效液相色谱-MS/MS测定土壤中大环内酯类、氟喹诺酮类和林可酰胺类抗生素,9种目标化合物的定量限为0.80~9.67 μg/kg,加标回收率为65.2%~106%。李兴华等[11]利用SPE-高效毛细管电泳法测定土壤中3类(磺胺类、酰胺醇类和β-内酰胺类)13种抗生素,定量限为1.33~3.33 μg/kg,加标回收率为78.5%~107%。孟明辉等[12]采用QuEChERS-HPLC-MS/MS测定土壤中磺胺类和大环内酯类抗生素,20种目标化合物的定量限为2.0~5.0 μg/kg,加标回收率为61.4%~119%。上述方法定量限低,加标回收率在可接受范围内,但只能同时检测少数几类抗生素。
本研究建立了SPE-UHPLC-MS/MS检测方法,用于土壤中痕量水平的7类(磺胺类、氟喹诺酮类、四环素类、大环内酯类、β-内酰胺类、酰胺醇类和林可酰胺类)30种抗生素的同时测定。
1 实验方法
1.1 仪器、试剂与材料
Exion LC AD超高效液相色谱-串联Triple QUADTM5500三重四极杆质谱仪(美国AB Sciex公司); Vortex-Genie 2涡旋振荡器(美国Scientific Industries公司); HS 501 digital摇床(德国IKA公司); 5810 R冷冻离心机(德国Eppendorf公司);氮吹仪(美国Organomation公司); Oasis HLB固相萃取小柱(3 mL,美国Waters公司);固相萃取仪(美国Supelco公司);超纯水仪(美国Millipore公司)。
甲醇和乙腈(色谱纯,美国Thermo Fisher公司);甲酸(分析纯,美国Sigma-Aldrich公司);乙二胺四乙酸二钠(分析纯,上海麦克林生化科技有限公司)、柠檬酸酐(分析纯,阿法埃莎(中国)化学有限公司)、十二水合磷酸氢二钠(分析纯,上海沪试化工有限公司)。
将34.7 g十二水合磷酸氢二钠、18.6 g乙二胺四乙酸二钠和6.5 g柠檬酸酐溶解于500 mL超纯水中,配制得到pH为4.0的Na2EDTA-McIlvaine缓冲液。
抗生素标准品:(1)磺胺类(SAs):磺胺嘧啶(SDZ)、磺胺二甲嘧啶(SMZ)、磺胺甲噁唑(SMX)、磺胺甲噻二唑(SMTZ)、磺胺氯哒嗪(SCP)、磺胺对甲氧嘧啶(SFM)、磺胺间甲氧嘧啶(SMM)、磺胺喹噁啉(SQX)、甲氧苄啶(TMP); (2)氟喹诺酮类(FQs):诺氟沙星(NOR)、环丙沙星(CIP)、氧氟沙星(OFL)、洛美沙星(LOM)、恩诺沙星(ENR)、氟罗沙星(FLE)、培氟沙星(PEF)、双氟沙星(DIF); (3)四环素类(TCs):土霉素(OTC)、四环素(TC)、金霉素(CTC)、多西环素(DC); (4)大环内酯类(MLs):克拉霉素(CTM)、罗红霉素(RTM)、脱水红霉素(ETM-H2O)、泰乐菌素(TYL); (5)β-内酰胺类(BLs):阿莫西林(AMX)、青霉素(PCN-G); (6)酰胺醇类(APHs):氟苯尼考(FF)、氯霉素(CAP); (7)林可酰胺类(LAs):林可霉素(LCM)。磺胺嘧啶、磺胺二甲嘧啶、磺胺甲噁唑、磺胺甲噻二唑、磺胺对甲氧嘧啶、磺胺间甲氧嘧啶、磺胺喹噁啉、甲氧苄啶、诺氟沙星、氧氟沙星、恩诺沙星、克拉霉素、罗红霉素、青霉素、氟苯尼考和氯霉素购自德国DRE公司;磺胺氯哒嗪、洛美沙星、氟罗沙星、培氟沙星、双氟沙星、土霉素、四环素、金霉素、多西环素、脱水红霉素、泰乐菌素、阿莫西林和林可霉素购自加拿大TRC公司;环丙沙星购自中国曼哈格公司;甲氧苄啶-d3购自加拿大CDN公司,环丙沙星-d8购自德国Witega公司,四环素-d6、罗红霉素-d7和氯霉素-d5购自加拿大TRC公司。
1.2 标准溶液的配制
以甲醇为溶剂,将30种抗生素标准品配制成1 000 mg/L或100 mg/L的标准储备液,于-20 ℃条件下储存。其中磺胺嘧啶、诺氟沙星、环丙沙星、氧氟沙星、氟罗沙星和培氟沙星需溶解于含0.5%(v/v)的1 mol/L的NaOH溶液的甲醇溶液中,NaOH可与微溶于甲醇的弱酸性物质发生中和反应,促进其溶解。
用甲醇将以上标准储备液稀释配制成4 mg/L的30种抗生素的混合标准溶液,于-20 ℃条件下保存备用。使用前,以10%甲醇水溶液为溶剂,将4 mg/L的30种抗生素的混合标准溶液逐级稀释成200、100、50、20、10、5、2、1、0.5、0.2、0.1、0.05、0.02和0.01 μg/L的系列混合标准溶液。
1.3 样品前处理
1.3.1样品采集
采集表层土壤样品,挑除石子等异物,并进行风干处理,风干后充分研磨和过筛(20目),于-20 ℃条件下保存。
1.3.2提取和净化
准确称取2.50 g土壤样品,置于15 mL聚丙烯离心管中,加入25 ng抗生素内标混合物(甲氧苄啶-d3、环丙沙星-d8、四环素-d6、罗红霉素-d7和氯霉素-d5),涡旋混匀。萃取剂为10 mL乙腈和Na2EDTA-McIlvaine缓冲液的混合溶液(1∶1, v/v),振荡30 min,超声15 min,提取3次,4 ℃下离心10 min,转速为4 000 r/min,移取合并上清液,氮吹浓缩至9 mL,加水稀释至15 mL,调节溶液pH为8.0。
先用6 mL甲醇和6 mL超纯水活化HLB小柱,然后将样品溶液滴加入小柱中。上样后,用10 mL超纯水淋洗,弃去淋洗液,负压抽干20 min,再用10 mL甲醇-乙腈(1∶1, v/v)溶液洗脱。洗脱液氮吹浓缩至干,再用10%(v/v)甲醇水溶液复溶至1 mL,待UHPLC-MS/MS分析。
1.4 分析条件
色谱柱:ACQUITY BEH-C18色谱柱(100 mm×2.1 mm, 1.7 μm;美国Waters公司),配有预柱ACQUITY BEH-C18色谱柱(5 mm×2.1 mm, 1.7 μm;美国Waters公司);柱温:40 ℃;流动相:A相为0.1%(v/v)甲酸水溶液,B相为0.1%(v/v)甲酸甲醇溶液;流速:0.4 mL/min。正离子模式下流动相洗脱梯度:0~2.5 min, 10%B~15%B; 2.5~5.5 min, 15%B~60%B; 5.5~6.0 min, 60%B~95%B; 6.0~8.0 min, 95%B; 8.0~8.1 min, 95%B~10%B; 8.1~9.0 min, 10%B。负离子模式下流动相洗脱梯度:0~1.0 min, 10%B~15%B; 1.0~3.0 min, 15%B~60%B; 3.0~4.0 min, 60%B; 4.0~4.5 min, 60%B~95%B; 4.5~6.0 min, 95%B; 6.0~6.1 min, 95%B~10%B; 6.1~7.0 min, 10%B。
离子源:电喷雾电离源(ESI);多反应离子检测模式(MRM)。正离子模式下,离子源温度500 ℃,离子喷雾电压5 500 V,气帘气压力35.0 kPa,碰撞气压力7 kPa,喷雾气压力40.0 kPa,辅助加热气压力60.0 kPa。负离子模式下,离子源温度550 ℃,离子喷雾电压-4 500 V,气帘气压力40.0 kPa,碰撞气压力9 kPa,喷雾气压力50.0 kPa,辅助加热气压力50.0 kPa。30种抗生素的其他质谱参数见表1。
2 结果与讨论
2.1 分析条件的优化
2.1.1质谱条件的优化
根据7类抗生素的分子结构特征,并参考相关文献[13,14],酰胺醇类的氟苯尼考和氯霉素在ESI-模式下进行质谱分析,其他28种抗生素均在ESI+模式下进行质谱分析。采用针泵注射器,将30种100 μg/L的标准溶液分别注入离子源,流速为7 μL/min。
对单个抗生素进行质谱条件优化,首先进行全扫描和子离子扫描,参考化合物信息,选取合适的母离子和子离子作为目标化合物的定量、定性离子对,然后在MRM模式下,对目标化合物的定量、定性离子对进行CE、DP等质谱参数的优化。最终30种抗生素的质谱优化参数见表1。
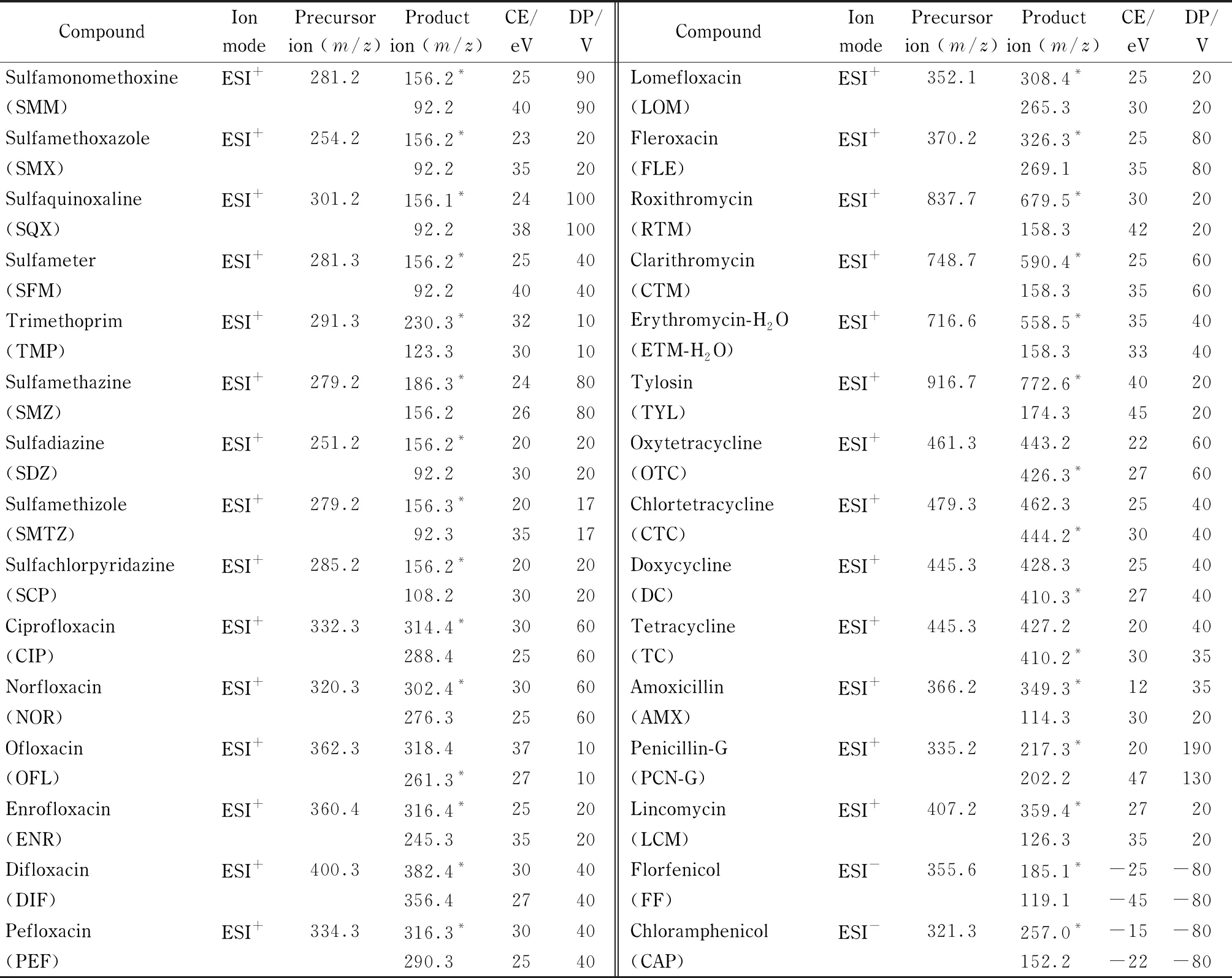
表 1 30种抗生素的质谱分析参数
2.1.2色谱条件的优化
由于7类抗生素的分子结构差异较大,本实验选择了具有广谱性和化学稳定性的BEH-C18色谱柱。比较了分别以甲醇-水、甲醇-0.1%(v/v)甲酸水溶液、甲醇-0.2%(v/v)甲酸水溶液、甲醇-含2 mmol/L醋酸铵的0.2%(v/v)甲酸水溶液、0.1%(v/v)甲酸甲醇溶液-0.1%(v/v)甲酸水溶液和0.1%(v/v)甲酸乙腈溶液-0.1%(v/v)甲酸水溶液作为流动相时的色谱分离效果。结果表明,以甲醇-水为流动相时,大环内酯类抗生素未出峰,在其他的流动相条件下,各类抗生素均有出峰。此外,四环素类抗生素的响应在含醋酸铵的流动相条件下有所降低,青霉素的响应在0.1%(v/v)甲酸乙腈溶液作为有机相的条件下较0.1%(v/v)甲酸甲醇溶液低了2个数量级。综合考虑,选取0.1%(v/v)甲酸甲醇溶液-0.1%(v/v)甲酸水溶液作为流动相。
此外,纯甲醇作为进样溶剂时,溶剂效应显著,阿莫西林未出峰。当有机溶剂的比例降低时,各类抗生素的峰形及响应均有所改善,各类抗生素的响应在以10%(v/v)甲醇水溶液作为进样溶剂时较50%(v/v)甲醇水溶液高2~10倍。因此选取10%甲醇水溶液作为进样溶剂。30种抗生素(100 μg/L)的总离子流色谱图见图1。
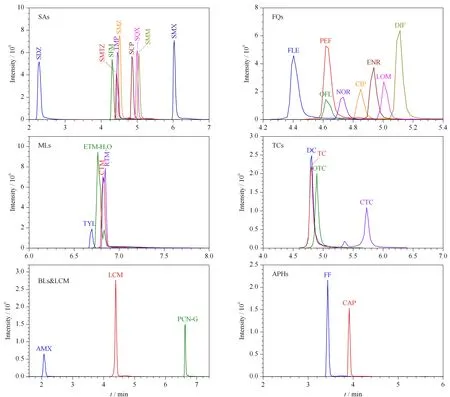
图 1 30种抗生素(100 μg/L)的提取离子流色谱图Fig. 1 Extracted ion chromatograms of the 30 antibiotics (100 μg/L)SAs: sulfonamides; FQs: fluoroquinolones; MLs: macrolides; TCs: tetracyclines; BLs: β-lactams; APHs: amphenicols.
2.2 提取条件的优化
采用振荡加超声的方式对土壤样品中的抗生素进行提取,考察不同种类(甲醇-Na2EDTA-McIlvaine缓冲液(1∶1, v/v)和乙腈-Na2EDTA-McIlvaine缓冲液(1∶1, v/v))和不同体积(5、7.5和10 mL)的萃取剂对目标化合物提取效果的影响。结果表明,与甲醇-Na2EDTA-McIlvaine缓冲液相比,乙腈-Na2EDTA-McIlvaine缓冲液对氟喹诺酮类抗生素有更好的提取效果,这可能是因为氟喹诺酮类抗生素极性较大(logKow: -1.03~0.89)。以乙腈-Na2EDTA-McIlvaine缓冲液作为萃取剂,萃取剂的体积由5 mL提升至10 mL时,氟喹诺酮类抗生素的回收率由15.0%~44.0%提升至48.0%~84.0%,部分磺胺类和大环内酯类抗生素的回收率也有10.0%~20.0%的提升。每次使用10 mL萃取剂对土壤样品进行提取,经3次提取后,第4次的提取液中未检测到目标化合物。因此,最终选择采用乙腈-Na2EDTA-McIlvaine缓冲液(1∶1, v/v)对土壤样品提取3次,每次10 mL。
2.3 净化条件的优化
2.3.1萃取液pH值的选择
未经调节的萃取液(乙腈-Na2EDTA-McIlvaine缓冲液(1∶1, v/v))pH约为4.0,在此条件下进行固相萃取,β-内酰胺类抗生素中的阿莫西林回收率仅为10.3%,可能是酸性条件下阿莫西林易降解[15]。探究中性到碱性的3个pH条件(pH 7.0、8.0、9.0)对各类抗生素回收率的影响。结果表明,萃取液pH的变化对林可霉素、氟喹诺酮类和酰胺醇类抗生素的回收率影响不大,而pH 8.0为磺胺类、大环内酯类、四环素类及β-内酰胺类抗生素的最佳萃取液pH值,该条件下4类抗生素的回收率范围在30.0%~132%(见图2)。最终确定萃取液pH调节为8.0。
2.3.2淋洗液有机溶剂比例的选择
为了保留目标化合物并最大化地去除杂质,选取10 mL超纯水、5 mL超纯水+5 mL 5%(v/v)甲醇水溶液和5 mL超纯水+5 mL 10%(v/v)甲醇水溶液作为淋洗液,以确定最佳的淋洗液有机溶剂的比例。结果表明,随着淋洗液中有机溶剂比例的增加,大多数抗生素回收率无明显变化,但是磺胺嘧啶和阿莫西林的回收率分别由76.6%和47.0%降低至19.5%和4.10%。甲醇是磺胺嘧啶和阿莫西林最常用的洗脱溶剂[6,14],磺胺嘧啶具有一定的亲水性(logKow: -0.09),阿莫西林是一种强极性化合物,这可能导致它们弱吸附于反相固相萃取小柱填料,并且在含有少量甲醇的淋洗液中即可被洗脱。此结果与目标化合物在反相BEH-C18色谱柱上的洗脱情况一致,磺胺嘧啶和阿莫西林的保留时间分别为2.16 min和1.86 min,是所有目标化合物中出峰时间最早的两种抗生素。因此,确定将10 mL超纯水作为固相萃取的淋洗液。这与Zhou等[14]的研究结果一致。
2.3.3洗脱液种类及体积的选择
甲醇是最常被报道的抗生素的洗脱溶剂[14,16],由于目标抗生素的极性普遍较大(logKow: -4.10~4.34),分别选取甲醇、乙腈和甲醇-乙腈(1∶1, v/v)混合溶液作为洗脱液,以考察不同洗脱液对抗生素洗脱效果的影响。结果显示,甲醇-乙腈(1∶1, v/v)混合溶液作为洗脱液时,各类抗生素的洗脱效果最佳,回收率范围为34.5%~177%。
考察不同体积的洗脱液(6、10、12 mL)对抗生素洗脱效果的影响。结果显示,对于酰胺醇类和部分磺胺类、氟喹诺酮类抗生素,6 mL洗脱液达不到理想的洗脱效果,而各类抗生素的回收率在用12 mL洗脱液洗脱的情况下较10 mL并没有得到明显提高。由此可见,10 mL洗脱液足以将固相萃取柱上的抗生素洗脱完全。更大的体积不仅浪费试剂,增加前处理时间,还可能带来基质效应。因此,最终确定洗脱液体积为10 mL。
2.4 方法学评价
2.4.1线性范围与方法检出限
经UHPLC-MS/MS检测系列混合标准溶液后,以抗生素的质量浓度为横坐标(x, μg/L),峰面积为纵坐标(y),绘制标准曲线。结果表明,所有抗生素的标准曲线的相关系数(r)均大于0.99(见表2)。分别以3倍和10倍信噪比计算方法检出限和定量限,30种抗生素的方法检出限和定量限分别为0.013~1.21和0.043~4.04 μg/kg。在低(2 μg/L)、中(20 μg/L)和高浓度(100 μg/L)条件下测定日内和日间精密度,30种抗生素的日内和日间精密度分别为0.238%~14.1%和0.507%~14.5%,均小于15%,证实了方法的重复性。

表 2 30种抗生素的方法检出限、定量限、线性范围及在3个浓度水平下的日内和日间精密度
2.4.2回收率与基质效应
称量0.25 g土壤样品,添加抗生素标准品,使得加标水平分别为20、100和200 μg/kg,每个浓度水平设4组平行。结果见表3,可以看出,仅有个别目标化合物(磺胺喹噁啉、阿莫西林和青霉素)的回收率为27.1%~31.5%,其他27种抗生素的加标回收率均在44.8%~164%之间,并且30种抗生素的相对标准偏差为0.700%~14.8%,均<15%,说明该分析方法性能良好。
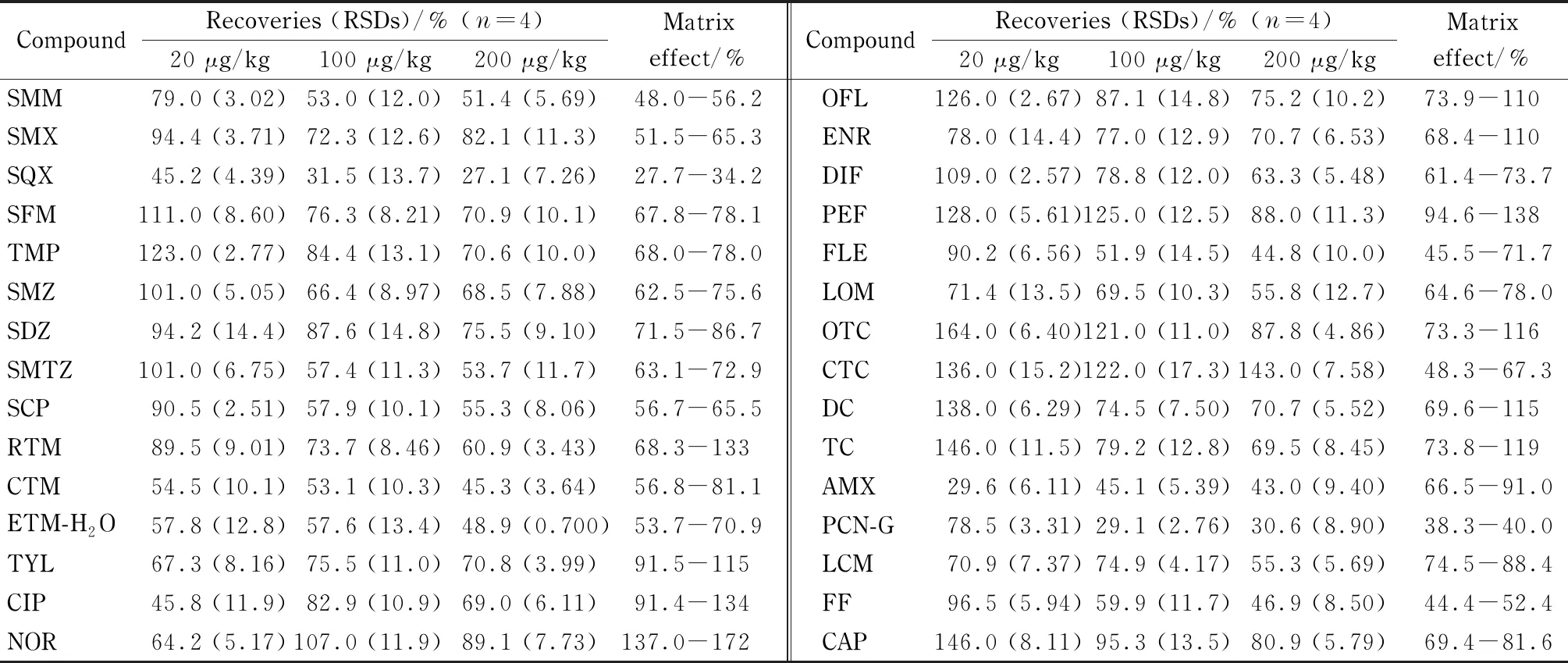
表 3 30种抗生素在土壤样品中的加标回收率和基质效应
磺胺喹噁啉、阿莫西林和青霉素的化学结构和理化性质与其他27种抗生素相比有一定差异。磺胺喹噁啉的logKow为1.68,亲水性远小于其他7种磺胺类抗生素(logKow: -0.09~0.91)。阿莫西林和青霉素属于β-内酰胺类抗生素,在β-内酰胺环的环张力和羰基碳的亲核能力作用下,这类抗生素具有高度的化学反应活性[17]。由于理化性质的差异,在30种抗生素同时分析测定的过程中,这3种抗生素可能存在一定的过程损失或较强的基质抑制作用,从而导致回收率偏低。
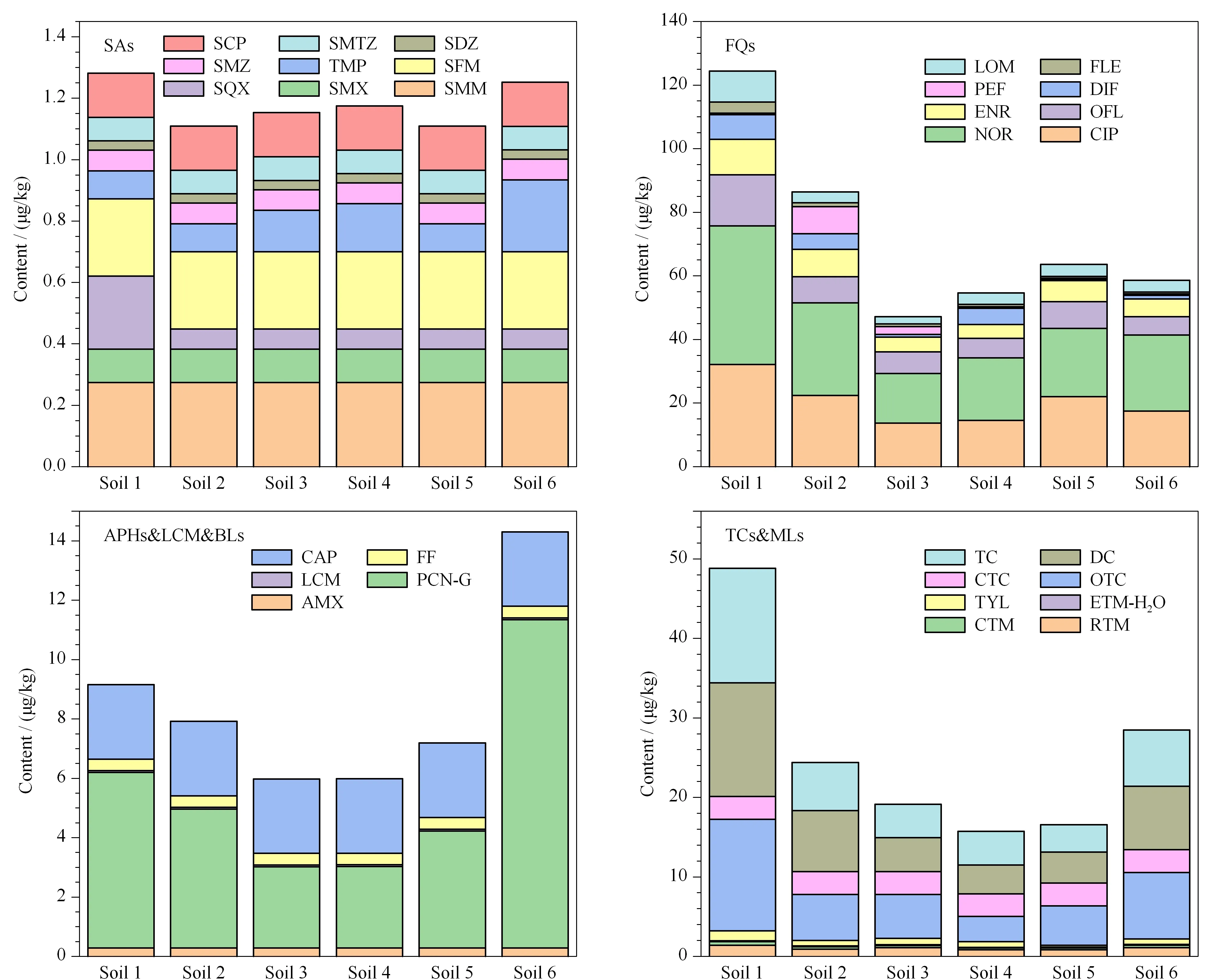
在20、100和200 μg/kg的添加浓度下,比较基质提取液和纯溶剂中30种抗生素的响应值,以评估基质效应(ME),结果见表3。ME<100%为基质抑制作用,ME>100%为基质增强作用。ME<50%或>150%为强基质作用,50%≤ME≤80%或120%≤ME≤150%为中等基质作用,80% 不同地区的土壤性质各异,针对每个地区的土壤样品制备基质匹配标准曲线的工作量巨大,不能满足简单快速进行定量分析的要求;此外,多种抗生素在土壤中的检出率基本为100%,难以获得空白基质制备基质匹配标准曲线。因此,本工作使用溶剂标准曲线进行定量。 2.4.3方法学比较 与其他已有文献数据比较(见表4),该方法的萃取溶剂用量少,且涉及的抗生素种类广、数量多,能用于土壤样品中痕量水平7类30种抗生素的同时分析检测。其中磺胺类、氟喹诺酮类、四环素类、大环内酯类、林可酰胺类和酰胺醇类共27种抗生素的加标回收率范围为44.8%~164%。本研究中磺胺喹噁啉(27.1%~45.2%)、阿莫西林(29.6%~45.1%)和青霉素(29.1%~78.5%)的回收率较低,与其他研究[6,19,20]报道一致。如Guo等[20]采用QuEChERS-HPLC-MS/MS测定粪便中25种抗生素,其中磺胺喹噁啉的回收率最低(55.7%~56.8%); Cha等[19]利用固相萃取-HPLC-MS/MS检测粪便中β-内酰胺类抗生素,阿莫西林的回收率只有15%左右。 表 4 本文方法与其他文献方法的比较 2.4.4实际土壤样品的测定 分别采集来自郑州、河池、聊城、衡阳、莱州和白银6个地区的6个农田表层土壤样品,使用建立的方法对土壤样品中30种抗生素残留进行分析,统计结果见表5,具体的浓度信息见图3。共检出30种抗生素中的17种,在每个样品中的总含量为73.4~184 μg/kg,其余抗生素均未检出。罗红霉素、克拉霉素、环丙沙星、诺氟沙星、氧氟沙星、恩诺沙星、氟罗沙星、洛美沙星、土霉素、多西环素、四环素和青霉素的检出率均为100%,其中环丙沙星和诺氟沙星是每个土壤样品中含量最高的两种抗生素(见图3),它们的含量分别是13.7~32.1和15.6~43.6 μg/kg,罗红霉素、克拉霉素、氧氟沙星、恩诺沙星、氟罗沙星、洛美沙星、土霉素、多西环素、四环素和青霉素的含量分别是0.824~1.41、0.255~0.496、5.83~16.1、4.37~11.1、0.503~3.49、2.27~9.80、3.14~14.0、3.63~14.3、3.45~14.4和2.74~11.1 μg/kg。磺胺喹噁啉、甲氧苄啶、泰乐菌素、双氟沙星和培氟沙星分别在1、3、4、4和2个土样中被检出,它们的含量分别为nd~0.238、nd~0.235、nd~1.23、nd~7.75和nd~8.51 μg/kg。主要抗生素的检出率和浓度水平情况与之前研究报道的结果[21-29]基本一致。如Sun等[27]对中国长三角地区农田土壤中13 种抗生素残留水平(磺胺类、四环素类和氟喹诺酮类)进行了分析,其中环丙沙星含量为未检出~1 030 μg/kg,其均值在所有抗生素中最高,为27.7 μg/kg; Gao等[22]测定了北京和上海城市土壤中的22种抗生素(磺胺类、氟喹诺酮类和大环内酯类),其中诺氟沙星在所有样本中检出率最高(98%),含量为未检出~2 160 μg/kg,均值为94.6 μg/kg。这说明环丙沙星和诺氟沙星广泛而大量存在于我国土壤环境中。 表 5 6个实际土壤样品中30种抗生素的含量统计 图 3 6个实际土壤样品中30种抗生素的含量及分布情况Fig. 3 Contents and distributions of the 30 antibiotics in six real soil samples 本研究建立了固相萃取-超高效液相色谱-串联质谱同时测定土壤中痕量水平的7类30种抗生素的方法。该方法的线性范围、检出限、回收率及精密度等方法学指标均可满足土壤中抗生素的定性定量分析要求,且方法简单快速、溶剂用量少、抗生素检测的种类广、数量多,可望为土壤中抗生素的监测和风险评估提供方法学基础。

3 结论
