猪ATP6V0A4基因启动子核心区的筛选与分析
2021-07-01李忠秋唐晓东张海峰张冬杰
汪 亮,李忠秋,唐晓东,张海峰,刘 娣,张冬杰
(1.黑龙江省农业科学院,黑龙江 哈尔滨 150086;2.农业农村部种养结合重点实验室,黑龙江 哈尔滨 150086)
V-ATP酶最早是在酵母细胞的液泡膜上发现的,其主要功能是利用水解ATP产生的能量实现氢离子的跨膜运输,在水解ATP、调节pH值和产生电势梯度等方面具有重要作用[1]。在进化上高度保守,主要存在于不同生物的细胞膜或细胞器膜上。V-ATP酶是一种复杂的异聚体蛋白,包括2个结构复合体V1和V0,V1存在于膜表面,属于催化区域,负责ATP的水解;V0包埋在膜内,属于质子传导区域,负责质子的转运。V1由8个亚基组成(A、B、C、D、E、F、G、H),V0由6个亚基组成(a、c、c′、c″、d、e)[2]。随着研究的深入,人们发现V-ATP酶除了可以转运H+,调节细胞器内的pH值外,还参与许多其他的生物学过程。比如,在植物中,可以调节细胞膨压,促进细胞伸长以及帮助植物适应干旱、盐碱、低温等非生物逆境胁迫[3]。在昆虫中,可调节烟草天蛾、东亚飞蝗等的蜕皮活动,参与柑橘小实蝇雄虫的生殖过程,在家蚕丝腺细胞中建立电势差,利于细胞的胞吐作用以及后续丝胶蛋白的分泌[4]。
ATP6V0A4编码V-ATP酶的a4亚基,被认为是遗传性远端肾小管性酸中毒的致病基因,该疾病因远端肾小管泌氢障碍,使得可滴定酸及尿NH4+排出减少,从而导致一系列的临床表现[5]。ATP6V0A4基因缺失小鼠到断奶时,表现出严重的代谢性酸中毒,低血钾和早起肾钙化,听力严重受损。除非碱化,否则它们会快速死亡[6]。民猪资源研究与利用课题组在前期研究中发现,民猪在遭受冷应激后,其背部皮下脂肪内的ATP6V0A4基因的转录水平会显著升高(P<0.05)。目前,还未见该基因与脂肪代谢或体温调节相关的报道,但其作为编码V-ATP酶亚基的一个基因,参与细胞内的跨膜转运质子活动,这种活动对于pH值的稳定和膜电位的产生至关重要,而膜电位是细胞代谢的驱动力[7]。为了后续探讨ATP6V0A4基因在冷应激过程中的生物学功能,本研究对其启动子区的核心序列进行了筛选和分析,从分子水平探讨其可能存在的转录调控机制。
1 材料和方法
1.1 试验材料
1头12月龄的雌性民猪基因组DNA由黑龙江省家畜育种重点实验室-20 ℃保存,内切酶KpnⅠ、Hind Ⅲ和pMD18-T Vector购自TaKaRa,双荧光素酶报告载体购自Promega。
1.2 试验方法
1.2.1 引物设计与PCR扩增 根据NCBI已有的猪ATP6V0A4基因组序列设计引物(GenBank登录号:NC_010460),扩增-1 504~-1 bp序列(将起始密码子“A”的位置定义为1),引物序列见表1。
以猪的基因组DNA为模板进行PCR扩增,反应体系为模板DNA 1 μL(50 ng/μL);2×PCR Mix 10 μL;上下游引物(10 μmol/L)各0.5 μL;ddH2O补齐至20 μL。反应条件为95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃终延伸5 min;4 ℃保存。
1.2.2 克隆测序 参照TransGen Biotech胶回收试剂盒(EG101-02)说明书操作。将回收后的PCR产物连入pMD18-T载体,构建pMD18-T-ATP6V0A4质粒并转入DH5α感受态细胞。应用限制性内切酶KpnⅠ和Hind Ⅲ进行双酶切鉴定。双酶切体系为KpnⅠ和Hind Ⅲ各0.5 μL(10 U/μL),10×Buffer 1.0 μL,质粒 4.0 μL;ddH2O 4.0 μL。反应条件为37 ℃酶切15 min。1.0%琼脂糖凝胶电泳鉴定后选取阳性克隆菌落送至北京华大基因科技有限公司测序。应用DNAMAN软件对测序结果进行分析。
1.2.3 荧光素酶报告基因质粒构建 将测序正确的克隆载体与pGL3-Basic空载体分别使用KpnⅠ和Hind Ⅲ双酶切处理,回收目的片段后,将带有黏性末端的目的片段与线性化的pGL3-Basic载体相连接,转化至大肠杆菌DH5α细胞中,筛选阳性重组质粒,经菌液PCR、双酶切、测序验证后,提取无内毒素质粒(提取方法严格按照天根无内毒素质粒提取试剂盒说明书操作),-20 ℃保存备用。
1.2.4 转染与荧光素酶活性检测 将报告基因重组质粒与pRL-TK质粒共转染至猪PK15细胞,转染前一天以4×105~8×105细胞/皿的密度铺至24孔板中,使第2天转染时的细胞达到80%~90%汇合,转染过程严格按照LipofectamineTM2000 (Invitrogen)说明书操作。每孔加入总质量为0.5 μg的质粒和2 μL转染试剂,转染后4~6 h换液,24 h后进行荧光素酶活性检测。检测时按照Promega产品说明书操作。
1.2.5ATP6V0A4基因启动子核心区鉴定 以克隆测序后的1 504序列为参考序列,设计一系列截短型上游引物,5′端引入KpnⅠ酶切位点,它们共用1条下游引物1504A(表1),组成8对引物。以pMD18-T-ATP6V0A4质粒为模板,分别进行PCR扩增,回收目的片段后分别连入pMD18-T载体,测序验证后将正确的质粒连入双荧光素酶报告基因载体,转染入细胞,进行双荧光素酶活性检测。
1.2.6ATP6V0A4基因启动子区调控元件鉴定 为了保证预测的准确性,在3个不同网站对ATP6V0A4基因的启动子区进行调控元件的预测(http://www.gene-regulation.com/pub/programs/alibaba2/index.html、http://jaspar.genereg.net、http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3和http://www.ifti. org)。

表1 扩增截短型启动子所用引物Tab.1 Primers for amplification of truncated promoter
依据不同片段荧光素酶活性的测定结果,同时结合软件的预测结果应用重叠延伸PCR对部分元件进行缺失突变,缺失突变用引物序列见表2。PCR反应分2轮进行,第1轮反应利用含有缺失序列的引物与原有引物进行配对扩增,在相互重叠的PCR产物末端突变目的序列,第2轮反应以第1轮反应获得的2个片段为模板,利用原有引物进行拼接扩增,将缺失突变引入产物内部。质粒的构建与荧光素酶活性的测定同上。
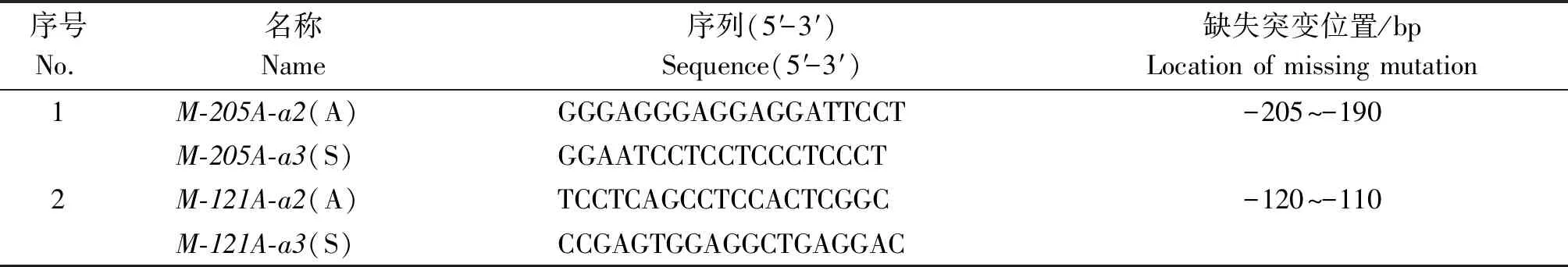
表2 突变调控元件结合位点所用引物信息Tab.2 Primer information for binding sites of mutation regulatory elements
2 结果与 分析
2.1 ATP6V0A4基因启动子区的扩增与鉴定
利用引物1504S和1504A进行PCR扩增,琼脂糖凝胶电泳检测后在1 500 bp左右发现清晰明亮的条带(图1),经双酶切鉴定及测序验证后,证明所扩增的片段为猪的ATP6V0A4基因启动子区。
2.2 荧光素酶报告基因质粒构建
利用限制性内切酶KpnⅠ和Hind Ⅲ对构建成功的克隆载体及pGL3-Basic空载体进行双酶切处理,纯化目的片段及线性化的载体。经连接、转化后得到重组质粒。对重组质粒进行双酶切、测序鉴定。结果表明,成功地将NoxⅠ基因启动子区连入了pGL3-Basic载体。
2.3 荧光素酶活性检测
将提取的pGL3-Basic-1504无内毒素质粒转染至PK15细胞中,24 h后检测荧光素酶活性。结果显示-1504~-1 bp(图2)片段含有启动子活性。
2.4 ATP6V0A4基因启动子区系列截短序列载体的构建
以1504片段为模板,利用8条截短序列的上游引物与1504A配对,共扩增出8条长度不同的ATP6V0A4启动子区片段。将PCR扩增出的目的片段与pMD18-T载体相连,经转化,挑取单克隆菌落扩大培养后提取质粒,经双酶切(图3)、测序验证后,分别连入pGL3-Basic载体,构建8个报告基因重组载体,分别为pGL3-Basic-1124、pGL3-Basic-813、pGL3-Basic-581、pGL3-Basic-468、pGL3-Basic-368、pGL3-Basic-265、pGL3-Basic-185和pGL3-Basic-107(数字代表插入片段的长度)。
2.5 荧光素酶活性分析
第1轮荧光素酶活性分析主要是从1 504 bp片段至265 bp片段,区间间隔大约为300 bp长度。因此,共检测了4个片段的荧光素酶活性,以空载体pGL3-Basic作为阴性对照,以pGL3-Basic-1504作为阳性对照,具体检测结果见图4。由图可知,1504截短至1124、813、581后,启动子活性无显著变化,说明-1 504--581 bp区域内没有重要的转录调控位点。将581位置截短至265后,启动子活性显著升高(P<0.05),说明-581--265 bp区域内存在负调控元件,-265--1 bp区域内存在正调控元件。
第2轮缺失以发生显著变化的区间-581--1 bp为基础,将此区间进一步分割,结果发现-265--185 bp区域内存在正调控元件(图5)。
2.6 ATP6V0A4基因转录调控元件的预测与鉴定
2.6.1 生物信息学预测结果 根据前期双荧光素酶测定结果,同时综合3个在线转录因子预测软件的分析结果,在-205--190 bp区间预测到8个转录因子结合位点,分别为E2F3、SP2、EGR1、E2F6、CTCFL、E2F1、SP1和ETF;在-120--110 bp区间预测到4个转录因子结合位点,分别为HNF4G、HNF4A、NR2F1和SP1。
2.6.2 转录因子结合位点的验证 利用重叠延伸PCR法对预测的ATP6V0A4基因潜在的转录因子结合位点-205--190 bp和-120--110 bp进行缺失突变,经酶切测序验证后,与pGL3-Basic载体相连构成转录因子结合位点缺失的报告基因质粒pGL3-Basic-205和pGL3-Basic-121(数字表示突变位点)。
以pGL3-Basic-265和pGL3-Basic-185为参照,将构建的缺失突变体进行双荧光素酶活性检测。结果显示缺失-205--190 bp区域,双荧光素酶活性显著降低,说明该区域存在正调控转录因子;缺失-121--110 bp区域,双荧光素酶活性不降反而有上升趋势,说明这个区域可能含有转录负调控转录因子(图6)。
3 讨论
目前,关于ATP6V0A4基因的研究几乎全部集中在人类的原发性远端肾小管酸中毒(dRTA)疾病上,dRTA是一种罕见的遗传性疾病,其特征是远端肾单位的尿液酸化过程受损,导致碱性尿的产生[8]。其致病机理还不清楚,但ATP6V0A4的突变与dRTA显著相关[9]。此外,ATP6V0A4还与乳腺癌的内脏转移相关,发生内脏转移的乳腺癌患者该基因显著高表达[10]。ATP6V0A4为组织特异性表达基因,在肾脏、内耳、嗅觉上皮和雄性生殖道的质膜、雌性的子宫、胚胎内脏卵黄囊等组织表达[11],说明该基因具有广泛的生物学功能。
河北省植物生理及分子病理学重点实验室在前期研究中发现,民猪在遭受冷应激刺激后,其背部脂肪内的ATP6V0A4基因转录水平显著上升,上升倍数可达8.42倍,但在正常情况下,脂肪型的民猪与瘦肉型的大白猪相比,大白猪背脂内的ATP6V0A4基因转录水平比民猪的高8.83倍[12]。据此,笔者推测该基因可能与猪的脂肪代谢相关,并且受冷应激诱导,但目前还未见相关的研究报道。只知其最后的聚合产物V-ATP酶的组装和活性会受到葡萄糖饥饿的诱导[13],而冷应激也会通过胰岛素依赖途径增强葡萄糖氧化,进而刺激外周组织中的葡萄糖的摄取[14]。为了开展ATP6V0A4基因后续的功能分析,本研究在分子水平上对该基因启动子区的正调控转录因子结合位点进行了筛选与分析,发现-581--265 bp区域内存在负调控元件,-205--190 bp区域内存在正调控元件,利用在线软件预测后发现-205--190 bp 区域内存在E2F3、SP2、EGR1、E2F6、CTCFL、E2F1、SP1和ETF共计8个转录因子的识别序列。
E2F3、E2F6和E2F1都属于E2F转录因子家族,它们通过调节控制细胞DNA合成及与细胞增殖有关的基因表达而起作用,同时本身的活性也受到其他在细胞周期进程中有重要作用的蛋白所调控[15]。如高迁移率族蛋白B1(HMGB1)可通过上调E2F3促进卵巢癌细胞增殖和侵袭能力[16]。SP1和SP2同属于Sp样转录因子家族,该家族共有8个成员,广泛参与细胞增殖、分化、凋亡、胚胎发育、肿瘤发生等多种生理病理过程,调控作用广泛[17]。而EGR1、CTCFL和ETF这3个转录因子的研究报道较少,多集中在癌症的相关研究上[18-20]。本研究中,确定了正、负调控元件的结合区域,但具体哪个转录因子会结合到ATP6V0A4基因的启动子区正调控/负调控该基因的转录,还需要后续的定点缺失试验验证。
