临床指标联合MRI评估胎盘植入高危患者术中子宫切除风险
2021-07-01钟淑媛丁志广徐坚民胡根文苏放明成志强
钟淑媛,丁志广,徐坚民*,胡根文,苏放明,成志强
胎盘植入谱系疾病(placenta accreta spectrum,PAS)是产科的危急重症,是导致产妇子宫切除的重要原因之一[1]。术前预判子宫切除较术中判断更有利于规避产妇及新生儿不良结局[2]。目前MRI 在PAS 产前诊断的应用已日趋广泛,大量文献多集中于MRI对PAS 的诊断效能[3],对PAS 高危患者子宫切除或保留的预测价值缺乏相应研究。笔者回顾性分析本院251 例妊娠晚期PAS 高危孕妇的MR 图像,并联合临床指标,探索PAS 高危患者子宫切除的独立危险因素,构建预测模型,以期为产前评估PAS高危患者子宫切除或保留提供依据。
1 材料与方法
1.1 一般资料
本院2010年7月至2020年3月共268名具有PAS高危因素[4]、临床或超声怀疑PAS 孕妇于妊娠晚期(32周以上)行胎盘磁共振检查,因图像质量差或扫描序列不同或合并子宫畸形各排除2 例,另6 例外院分娩无临床或病理结果及5 例因发生羊水栓塞于术中或二次手术切除子宫亦除外,最终251名孕妇纳入研究。所有患者于MRI 检查后6 周内由具有20 年以上丰富经验的产科医生行剖宫产手术。PAS 诊断标准采用术中所见、诊断及术后病理相结合,根据术中所见胎盘侵袭程度及镜下绒毛组织侵入深度分为胎盘粘连、胎盘植入、胎盘穿透三型[5]。经病历系统收集患者临床资料包括:年龄、剖宫产次数、宫腔操作史、孕周、孕次、前置胎盘(包括完全性、部分性及边缘性前置胎盘)、产程出血量、PAS 类型。本研究为回顾性研究,经过本单位医学伦理委员会批准(批准文号:KY-LL-2021004-01),免除受试者知情同意。
1.2 检查方法
采用Simens Avanto 1.5 T MRI 扫描仪进行扫描,相控阵线圈。孕妇取仰卧位,头先进。所有患者均行横断位、矢状位、冠状位三个方位扫描,扫描序列及参数:(1) T2WI 半傅立叶采集单次激发快速自旋回波(T2-weighted half-Fourier acquisition single-shot turbo spin echo,T2-Haste)序列,TR 1000 ms,TE 82~87 ms,翻转角度150°;(2) T2WI真稳态进动快速成像(T2-weighted true fast imaging with steady-state precession,T2-True FISP)序列,TR 3.2~3.8 ms,TE 1.3~1.9 ms,翻转角度60°;(3) T1WI 快速小角度激发(fast low angle shot,FLASH)序列,TR 125 ms,TE 2.43 ms,翻转角度70°,屏气扫描。各序列层厚4~6 mm,层间距1.2~1.8 mm,视野370~400 mm,矩阵256×224。
1.3 图像分析
在进行MR 图像分析前,由1 名具有29 年MRI 诊断经验的放射科医生参考既往文献报道[6-7]对2 名分别具有1 年及2 年经验的放射科医生进行培训2 个月。2 名医生在不知道患者的超声检查、临床及病理结果的情况下,独立对251 例PAS 高危晚孕患者MRI征象进行评价,0分为征象不存在或不确定,1分为征象存在。2 名医生出现意见分歧时,与高年资医生进行讨论并最终达成一致意见。MRI 征象(图1)包括:(1) T2WI 胎盘内暗带:在T2-Haste 和T2-True FISP序列中,从胎盘-子宫肌层交界面延伸至胎盘内的条状低信号带,粗细不均,最大直径大于2 cm;(2)胎盘膨出:指胎盘局部膨出进入子宫肌层,可合并子宫肌层连续性中断及子宫外轮廓变形;(3)胎盘-子宫交界面低信号线消失或中断;(4)子宫肌层变薄或消失:子宫肌层变薄小于1 mm,肌层渐近性消失;(5)膀胱壁T2WI低信号中断;(6)局部外突性肿块:胎盘穿透子宫壁,呈膀胱内或宫旁肿块影;(7)子宫浆膜面异常血管:子宫下段胎盘附着处子宫浆膜面密集排列的流空血管。

图1 PAS 相关MRI征象。A:T2-Haste 序列上见从胎盘-子宫肌层交界面延伸至胎盘内的低信号条带(星),局部膀胱壁低信号带连续性中断(箭);B:子宫前下壁胎盘向外膨出进入子宫肌层(箭),正常胎盘-子宫交界面低信号线中断,子宫下段肌层变薄;C:胎盘穿透子宫肌层形成宫旁肿块(箭);D:子宫浆膜下见密集排列的流空血管(箭)Fig. 1 MRI features of PAS.A:The T2-Haste sequence demonstrates the low signal band (star) extended from the uteroplacental interface to intraplacental region and disruption of low-T2 bladder wall(arrow).B:The placenta of the anterior inferior wall of the uterus bulges outward into the myometrium (arrow),with the loss of uteroplacental interface and myometrial thinning. C: The placenta protrudings through the uterine wall and presents as a parauterine mass (arrow). D: The T2-Haste sequence shows the intensive flow-void vessls along the uterine serosa(arrow).
1.4 统计学分析
采用SPSS 22.0、Medcale 18.2.1 软件进行统计分析。P<0.05 认为差异有统计学意义。二位阅片者对MRI 征象判读的一致性采用Kappa 检验。对临床指标和MRI 征象与子宫切除的相关性进行单因素和多因素分析,单因素分析符合正态分布计量资料采用两独立样本的t检验,不符合正态分布数据采用Wilcoxon-Mann-Whitney 秩和检验,计数资料采用χ2检验。多因素分析采用Logistic 回归,并构建风险预测模型,采用ROC 曲线及Hosmer-Lemeshow 拟合优度检验评价模型区分度及校准度,AUC 比较采用DeLong检验。
2 结果
2.1 一般情况
本研究共纳入251 例患者,子宫切除组64 例,切除原因包括胎盘广泛植入、胎盘剥离非常困难甚至无法剥离或剥离胎盘时出现不可控制大出血;子宫保留组187 例。入组患者年龄(32.80±4.59)岁,生产孕周(36.90±1.16)周,孕次1~11 次,既往有1 次剖宫产史188 例,有2 次及以上剖宫产史29 例。根据诊断标准,无PAS 70 例,胎盘粘连91 例,胎盘植入与胎盘穿透各45 例;子宫切除组平均出血量(2472.66±268.65) mL,子宫保留组平均出血量(873.42±53.73) mL。
2.2 一致性分析
2 名影像医师对PAS 高危患者MRI 征象的判读Kappa 值均大于0.4,局部外突性肿块一致性好(表1)。

表1 2名阅片者MRI征象判读一致性比较Tab.1 Inter-observer agreement for MRI features
2.3 单因素分析
由于两组患者均约有75%患者既往有1 次剖宫产史,两组剖宫产次数中位数及上下四分位数相同,但子宫保留组16.6%患者既往无剖宫产史,子宫切除组20.3%患者有2 次以上的剖宫产史,两组剖宫产次数差异有统计学意义。此外,两组之间,前置胎盘、T2WI 胎盘内暗带、胎盘膨出、子宫肌层变薄或消失、膀胱壁T2WI 低信号中断、局部外突性肿块和子宫浆膜面异常血管差异亦均有统计学意义(均P<0.01)。胎盘-子宫交界面低信号线消失或中断、年龄、孕周、孕次和宫腔操作史两组差异均无统计学意义(均P>0.05);所有出现膀胱壁T2WI 低信号中断及局部外突性肿块患者均切除子宫(表2)。

表2 临床指标及MRI征象与PAS高危患者子宫切除的关系Tab.2 Clinical characteristics and MRI features of patients with high risk of PAS
2.4 多因素分析
对单因素分析差异有统计学意义的产前临床指标剖宫产次数、前置胎盘及MRI 征象进行多因素分析,结果显示,剖宫产次数(X1)、T2WI 胎盘内暗带(X2)、胎盘膨出(X3)、子宫浆膜面异常血管(X4)为PAS高危患者子宫切除的独立危险因素(表3),各独立危险因素对PAS 患者子宫切除的预测效能见表4。使用Logistic 回归构建风险预测模型,Logistic(P)=-4.713+0.960X1+1.477X2+1.569X3+1.901X4,绘制该模型ROC 曲线(图2),AUC 为0.915 (95%CI:0.873~0.946),与各独立危险因素的AUC 相比,差异具有统计学意义(P<0.05),模型敏感度、特异度、阳性预测值及阴性预测值分别为87.50%、81.82%、62.2%、95.0%。Hosmer-Lemeshow 拟合优度检验示χ2=1.994,P=0.920;校准曲线图(图3)显示校准曲线接近45°理想曲线,模型校准能力好。
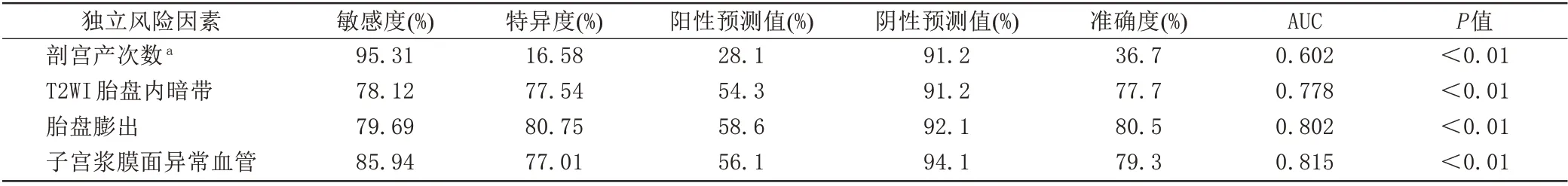
表4 各独立危险因素对PAS高危患者子宫切除的诊断效能Tab.4 Predictive performance of risk factors for hysterectomy in patients with high risk of PAS

图2 风险预测模型及各危险因素ROC曲线 图3 校准曲线Fig. 2 ROC curve of the combined risk model and each risk factor for intraoperative hysterectomy. Fig. 3 Calibration curve for the combined risk model.

表3 PAS高危患者子宫切除多因素分析Tab.3 Multivariate analysis of hysterectomy in patients with high risk of PAS
3 讨论
3.1 MRI在PAS高危患者中的应用现状
PAS 的最佳治疗方法仍未明确,2018 年美国妇产科医师协会建议视术中情况决定保留或切除子宫[8]。术前预测保留子宫的可能性,组织多学科团队对希望继续生育的产妇有重要的临床意义。近来,将MRI应用转化为相关临床决策或与临床指标结合也初见报道,Bourgioti 等[9]报道了根据MRI 征象数目预测子宫切除、术中出血和新生儿不良结局等,Chen等[10]联合临床指标与MRI征象构建评分系统预测术中大出血。
PAS 高危患者MRI 检查推荐时间为24~30 周[11],文献报道多达17 个MRI 征象与PAS 相关[12],且多集中在对胎盘植入深度的研究,对征象判断的一致性和诊断效能仍存在较大的差异和不同观点[13],尤其是32周以上。本研究参照2020年腹部放射学学会和欧洲泌尿生殖放射学学会推荐的PAS 征象[6],由2 名经过培训的低年资住院医师进行评估,平均检查孕周(35.52±1.84)周,结果表明医生间MRI 征象评估一致性中等至好。
3.2 临床指标及MRI 征象与PAS 高危患者子宫切除的相关性
本研究针对晚孕期PAS 的MRI 征象联合临床指标评估手术切除子宫风险,结果表明剖宫产次数、前置胎盘、T2WI 胎盘内暗带、胎盘膨出、子宫肌层变薄或消失、膀胱壁T2WI低信号中断、局部外突性肿块和子宫浆膜面异常血管与PAS 高危患者术中子宫切除有关,其中,剖宫产次数、T2WI 胎盘内暗带、胎盘膨出和子宫浆膜面异常血管是PAS 高危患者子宫切除的独立危险因素。
就单一征象而言,胎盘膨出和子宫浆膜面异常血管是较理想的独立危险因素。胎盘膨出被认为是诊断PAS 可靠的征象[7,14],由于胎盘绒毛膜深入肌层或穿过子宫肌层而导致邻近肌层中断,胎盘向外凸出,甚至造成子宫轮廓曲线扭曲。Jha 等[15]发现该征象敏感度及特异度分别达97%、96%,联合其他征象可100%提示子宫肌层侵犯。在本研究中,该征象敏感度及特异度均约80%,与术中子宫切除密切相关。
子宫浆膜面异常血管是近几年比较关注PAS 的MRI 征象,表现为子宫下段沿子宫浆膜紧密排列的血管,与诊断PAS及术中大出血有关[7]。本研究中,子宫浆膜面异常血管可用于PAS 高危患者术中子宫切除的风险评估,优势比高于胎盘膨出。造成子宫浆膜面异常血管可能是因为绒毛组织刺激子宫胎盘循环血管的异常扩张或新生血管和动静脉瘘形成[16]。对异常血管的了解,有利于产科医生对术区的选择,减少出血。
T2WI胎盘内暗带被认为是最有用MRI征象,并且在不同的观察者之间具有良好的一致性[17]。Linduska 等[18]认为T2WI 胎盘内暗带可能是由于胎盘梗死后出现纤维组织沉积、钙化所致。Zhang 等[19]研究指出该征象可预测术中大出血及大量输血,Chen等[20]研究发现,T2WI 胎盘内暗带是合并前置胎盘PAS患者出现术中大出血及子宫切除的独立危险因素,与本研究结果相符。
剖宫产次数和前置胎盘与PAS的发生密切相关,有5 次剖宫产史产妇PAS 发病率为1 次剖宫产史的10 倍[21],其敏感度高,特异度低,Chu 等[22]认为联合1~2个MRI征象可以提高其对PAS的诊断效能。
3.3 PAS高危患者子宫切除风险预测模型
Clark 等[23]发现胎盘膨出、T2WI 胎盘内暗带、胎盘异质性等征象与PAS孕妇子宫切除相关,但未进一步分析征象敏感度、特异度及联合使用的效能。本研究联合应用四个独立危险因素,构建PAS高危患者子宫切除风险产前预测模型,使其优势互补,提高了PAS 高危患者术中子宫切除风险的预测效能,又兼顾了预测的敏感度和特异度,拟合优度检验结果显示其拟合度良好,提示该预测模型具有良好的区分度及校准度,可对产前评估患者是否存在子宫切除风险提供依据。
本研究存在以下局限性:(1)本研究为单中心回顾性研究,主要考虑胎盘因素导致的子宫切除,因此除外了5例由羊水栓塞导致子宫切除患者,未涵盖更多其他因素;(2) MRI征象判断存在一定的主观性,缺乏量化指标。(3)子宫切除与医师及患者意愿有关,本研究产妇治疗决策由三级甲等医院具有20年经验产科医生参与决定。
本研究结果表明,基于孕妇临床指标及MRI 征象,有望产前为PAS高危患者子宫切除风险的评估提供依据,改善患者预后。当出现上述独立危险因素时,应做好充分的围术期准备,组织多学科团队合作,以改善产妇和新生儿结局。
作者利益冲突声明:全体作者均声明无利益冲突。
