诺氟沙星葡萄糖注射液有关物质检测方法的研究
2021-06-30荣娜娜刘继华桂丽华任李玥李志远
荣娜娜,刘 屹,刘继华,桂丽华,任李玥,李志远*
(1.云南省食品药品监督检验研究院,昆明 650106;2.云南省食品药品审核查验中心,昆明 650106)
诺氟沙星为第三代喹诺酮类药物,主要作用于拓扑异构酶Ⅳ,通过影响细菌DNA合成从而导致细菌死亡呈现杀菌作用,具有抗菌谱广、抗菌作用强的特性,对革兰氏阳性菌、阴性菌,包括铜绿假单胞菌均有良好的抗菌活性〔1-2〕。临床主要用于敏感菌所致的呼吸道感染、尿路感染、淋病、前列腺炎、肠道感染和伤寒及其他沙门菌感染〔3-4〕。诺氟沙星葡萄糖注射液为我国独有剂型,国内首研企业为安徽蚌埠丰原涂山制药厂。诺氟沙星葡萄糖注射液是2018年国家评价性抽验品种,为复方制剂,由诺氟沙星和葡萄糖两种成分组成,其中诺氟沙星作为有效成分,葡萄糖则作为渗透压调节剂。
检索各国药典发现,《中华人民共和国药典》2020版(ChP2020)〔5〕、《美国药典》41版(USP41)〔6〕和《欧洲药典》9.3版(EP9.3)〔7〕等均未收载诺氟沙星葡萄糖注射液,均只收载诺氟沙星的原料药质量标准〔5-6〕。诺氟沙星葡萄糖注射液的现行标准为国家药品监督管理局国家药品标准WS1-(X-0722)-94Z,在该标准中缺少对有关物质的控制。有关物质是反映药品生产工艺水平的重要参数,也是评价药品质量的重要指标,直接关系到注射剂的安全性,所以有必要建立诺氟沙星葡萄糖注射液中有关物质的检测方法,从而对相关杂质进行控制。查阅文献,未见对诺氟沙星葡萄糖注射液有关物质及测定方法的报道〔8-9〕。本文采用高效液相色谱梯度洗脱的方法,检查诺氟沙星葡萄糖注射液有关物质,该方法能使所有杂质完全分离,方法专属性更强,灵敏度更高。
1 仪器与试剂
1.1 仪器 高效液相色谱仪(岛津LC-20AD,二极管阵列检测器);电子天平(赛多利斯BP211D)。
1.2 试剂 乙腈(色谱纯,德国默克公司,批号:JA084830);磷酸(分析纯,国药集团化学试剂有限公司,批号:20200911);三乙胺(分析纯,国药集团化学试剂有限公司,批号:20200612)。
1.3 对照品 诺氟沙星对照品(中国食品药品检定研究院,批号:130550-201206;纯度99.5%);诺氟沙星杂质A对照品(USP,批号:F000D0);诺氟沙星杂质E对照品(USP,批号:F000E0);诺氟沙星杂质K对照品(USP,批号:F000G0);诺氟沙星杂质H对照品(USP,批号:F000F0)。
1.4 样品 诺氟沙星葡萄糖注射液(湖南科伦制药有限公司;规格:100 mL∕瓶,诺氟沙星0.2 g、葡萄糖5 g;2018年国家监督抽验样品);诺氟沙星原料、葡萄糖原料和辅料由湖南科伦制药有限公司提供。
2 方法与结果
2.1 色谱条件 流动相A:0.02 mol∕L磷酸溶液(用三乙胺调节pH至(3.0±0.1))-乙腈(90∶10);流动相B:乙腈,梯度洗脱(0~30 min 100%A;30~35 min,100%→80%A;35~60 min,80%→100%A);色谱柱:SHISEIDO C18柱(MGII,4.6 mm×250 mm,5μm);检测波长:278 nm;柱温:40℃;流速:1.0 mL∕min;进样量:20μL。
2.2 溶液制备
2.2.1 系统适应性溶液 精密称取诺氟沙星杂质A、E、K、H对照品各10 mg置于100 mL量瓶中,加乙腈溶解并稀释至刻度,摇匀,精密量取适量,加流动相A定量稀释成每1 mL中约含10μg的杂质品混合溶液。
2.2.2 供试品溶液 精密量取诺氟沙星葡萄糖注射液15 mL(取约相当于诺氟沙星30 mg)置于200 mL量瓶中,用流动相A定容至刻度。摇匀、滤过即得(0.15 mg∕mL)。
2.2.3 原料溶液 精密称取诺氟沙星原料30 mg置于200 mL量瓶中,用流动相A定容至刻度。摇匀、滤过即得(0.15 mg∕mL)。
2.2.4 对照品溶液 取诺氟沙星对照品适量,精密称定,加流动相A溶解并定量稀释制成每1 mL中含诺氟沙星10μg的溶液作为对照品溶液。
2.2.5 空白对照溶液 根据厂家提供的辅料种类和处方比例配制空白混合辅料,混匀后按供试品溶液所需称样量取样,按“2.2.2”项下供试品溶液同法处理配制即得。
2.3 专属性试验 取系统适用性溶液、供试品溶液、原料溶液、对照品溶液和空白对照溶液按“2.1”项下色谱条件进样,系统适用性溶液中诺氟沙星杂质A、E、K、H的分离度良好,供试品中各杂质峰之间,杂质峰和主峰之间分离度良好,色谱图见图1。
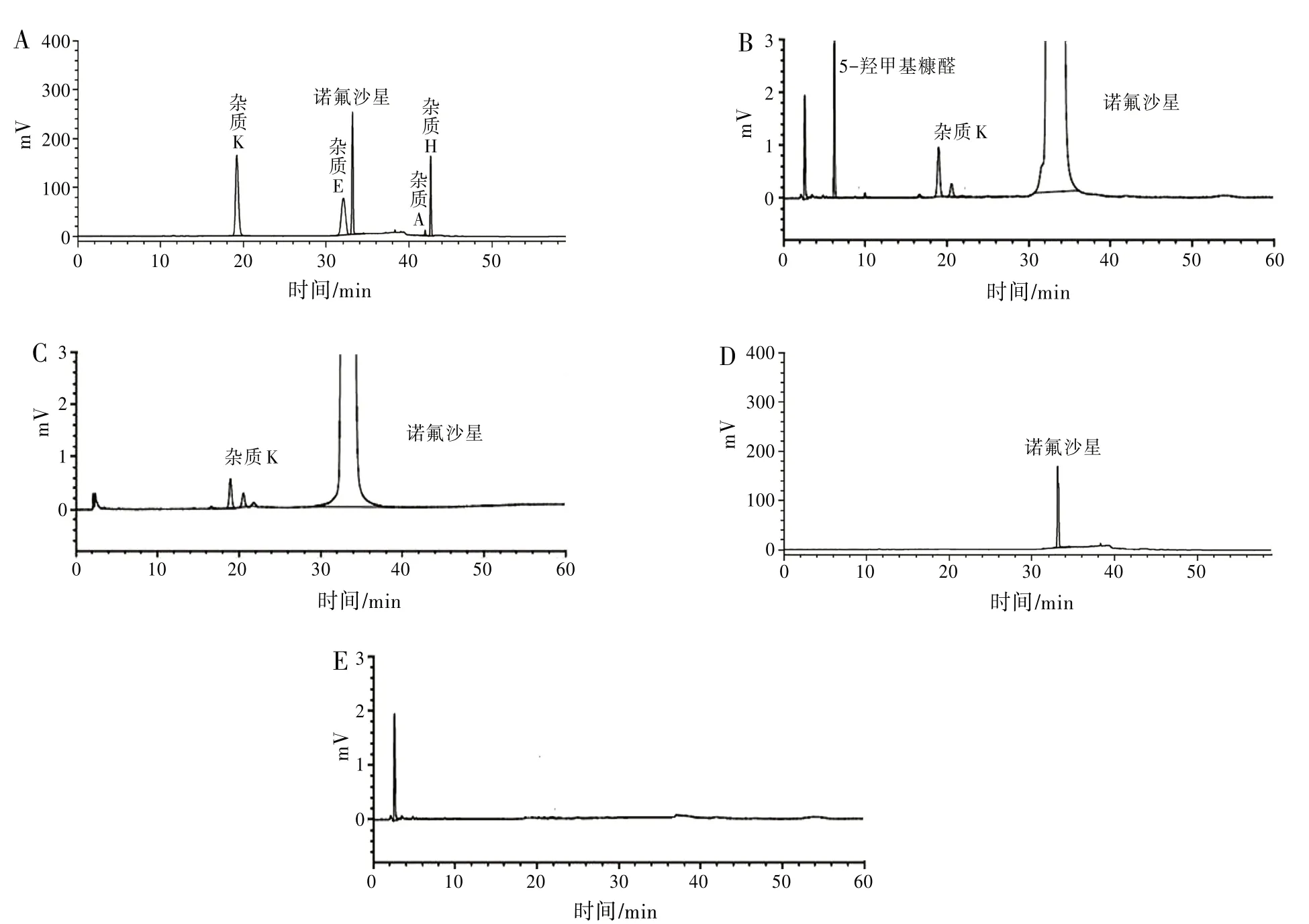
图1 色谱图
2.4 线性关系考察 精密称取诺氟沙星及其杂质A、E、K、H对照品适量,加入0.1 mol∕L的盐酸溶液2 mL溶解,并用流动相A稀释制成系列浓度梯度的溶液,按“2.1”项下的色谱条件进行测定,以浓度(X)为横坐标,峰面积(Y)为纵坐标,得线性回归方程:诺氟沙星线性方程Y=18 519X+3 660,r=0.999 7(n=6);杂质A线性方程Y=20 241X+1 037,r=0.999 7(n=6);杂质E线性方程Y=24 617X+3 366,r=0.999 7(n=6);杂质K线性方程Y=19 177X+1 021,r=0.999 7(n=6);杂质H线性方程Y=172 189X+2 209,r=0.999 7(n=6)。结果表明,诺氟沙星、杂质A、E、K、H在3.018~603.590μg∕mL范围内,峰面积与浓度呈良好线性关系。
2.5 检测限和定量限 在“2.1”项下色谱条件下,以信噪比S∕N=3为指标,计算最低检测限,以信噪比S∕N=10为指标,计算定量限。结果:诺氟沙星及其杂质A、E、K、H检测限分别为20.0、19.2、16.4、14.7和11.6 ng,定量限分别为0.010、0.097、0.029、0.032和0.022μg。
2.6 破坏性试验 取经酸破坏(1 mol∕L盐酸溶液放置24 h)、碱破坏(1 mol∕L氢氧化钠溶液放置24 h)的样品,分别中和至中性后的样品,氧化破坏(30%过氧化氢浸润24 h)的样品,紫外光破坏(紫外光照射24 h)的样品按照“2.1”项下的方法进行试验,色谱图见图2。
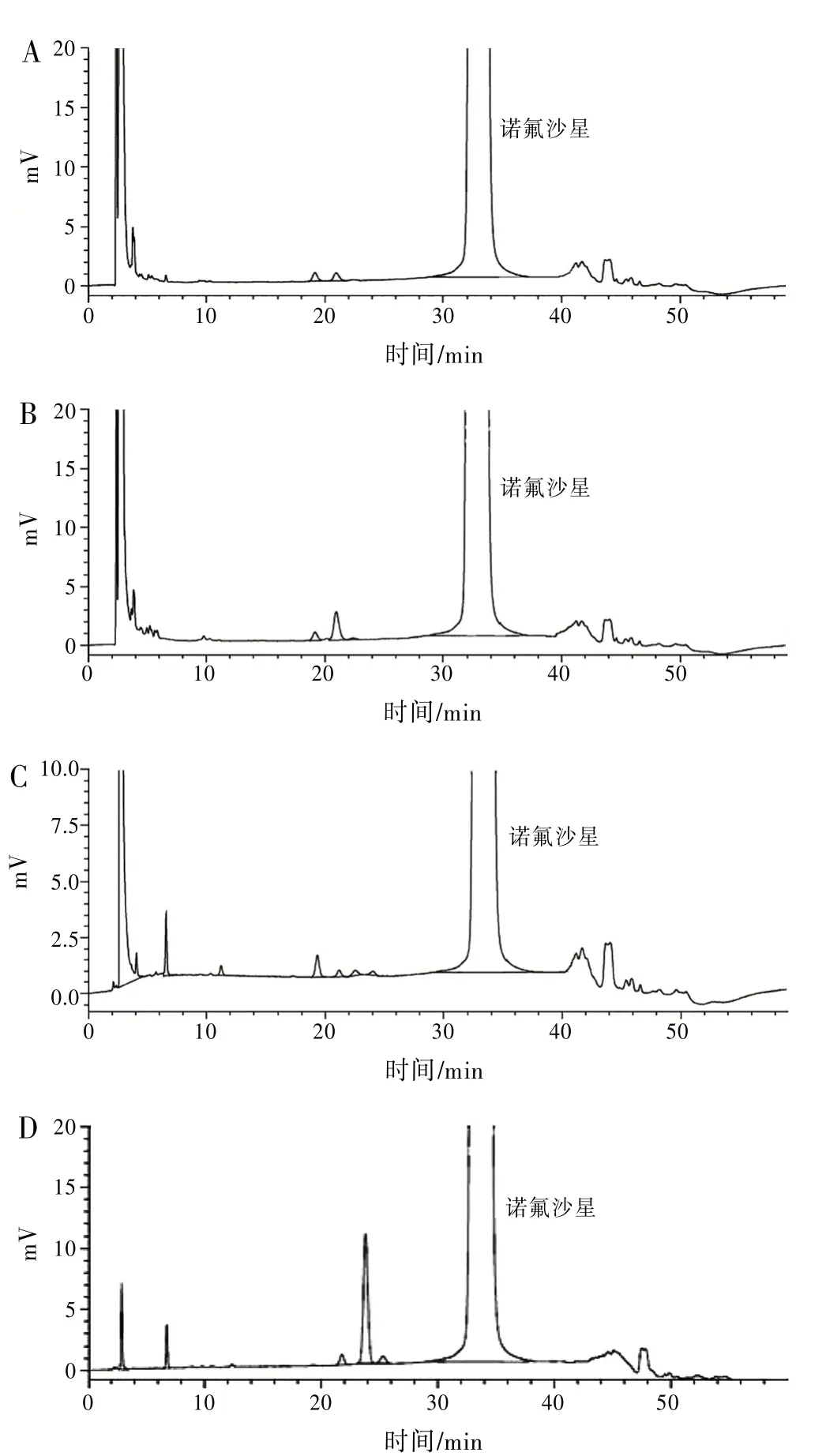
图2 破坏性试验色谱图
酸破坏、碱破坏和氧化破坏对样品的稳定性影响较小,紫外光破坏后杂质(相对保留时间(RRt)=0.75)有明显增大的趋势。在各破坏条件下杂质峰之间及杂质峰与主峰之间分离度良好,诺氟沙星的主成分及各降解杂质均能有效分离。
2.7 重复性试验 按“2.1”项下的色谱条件,用线性关系考察试验的对照品溶液,重复进样6次,峰面积的RSD为0.47%(n=6)。取同一批样品6份,按“2.2.2”项下方法制成供试品溶液,按“2.1”项下色谱条件进样测定,总杂质的RSD为1.6%(n=6),表明分析方法重复性良好。
2.8 稳定性试验 按“2.1”项下色谱条件,取供试品溶液,分别于0、1、2、4、6、24 h进样分析,诺氟沙星峰面积RSD为1.2%(n=6),杂质K、最大单杂质及总杂质的峰面积RSD分别为0.1%、0.6%和1.2%,未有新杂质引入,表明样品溶液在24 h内稳定性良好。
2.9 样品测定 按“2.1”项下色谱条件,对2018年国家评价性抽验的1个企业15批样品及企业提供的1批原料中有关物质进行检测,从图1可知,诺氟沙星葡萄糖注射液杂质较少,杂质谱主要集中为RRt 0.18、0.31、0.51、0.59和0.67的5个杂质,其中RRt=0.18的杂质为5-羟甲基糠醛,由主药葡萄糖降解产生;RRt=0.67的杂质为杂质K;样品和原料中均未检出杂质A、H、E。样品中单个最大杂质的平均含量为0.08%~0.10%,总杂质的平均含量为0.20%,杂质K的含量为0.05%;原料中单个杂质的含量为0.06%,总杂质的含量为0.20%;杂质K的含量为0.05%。原料和样品中杂质K的含量一样,说明杂质K由原料带入,提示相关生产企业应关注对杂质K的控制。
3 讨论
3.1 流动相的优化 在前期研究中,参考了ChP2020、USP41和EP9.3中诺氟沙星原料有关物质的检测方法,其中USP41和EP9.3的检测方法相同。ChP2020中只对杂质A进行了控制,未对杂质E、H、K进行控制,采用该方法测定,杂质E和诺氟沙星主峰不能分离,杂质K和本品中紫外光破坏的降解杂质(RRt=0.75)的峰不能分离。USP41版中的方法对杂质A、E、H、K均进行控制,但使用的色谱柱较为特殊,在USP41中标注的型号为L60,是在多孔硅胶表面进行共价修饰棕榈酰胺-丙基的C18柱。选用国内生产填料工艺接近的色谱柱,采用USP41的方法进行测定后,杂质E和杂质A的分离度不能满足要求,该法对诺氟沙星葡萄糖注射液的杂质检出率较低,仅能检出2个杂质,色谱图2中的RRt为0.51、0.59和0.67的色谱峰表现为一个峰。本研究采用国内较常见的C18柱,对ChP2020中的流动相进行优化,选择磷酸溶液-乙腈系统按不同比例进行梯度洗脱,杂质A、E、H、K和本品中各降解杂质峰均能有效分离。在流动相中磷酸溶液浓度分别选择了0.01、0.02、0.05 mol∕L的3个浓度进行试验,结果发现浓度为0.02 mol∕L时目标物质分离效果最好,出峰稳定且峰形尖锐,故选择磷酸溶液浓度为0.02 mol∕L。
3.2 检测波长的选择 采用二极管阵列检测器对诺氟沙星、葡萄糖和杂质峰在200~400 nm波长范围进行光谱扫描,诺氟沙星峰在波长278 nm处有最大吸收,最大单个杂质的最大吸收波长在278 nm,虽杂质A的最大吸收在262 nm,但在278 nm处也有吸收,同时由于其他破坏杂质含量过低无法通过扫描获得紫外吸收光谱以确定最大吸收波长,故根据诺氟沙星和最大杂质的紫外吸收特征选择278 nm作为检测波长。
3.3 柱温的考察 USP41中的测定方法柱温要求为60℃,这个温度是国内较多数C18柱使用的极限温度,在这个温度下使用,色谱柱填料容易塌陷,导致色谱柱的使用寿命较短。ChP2020中的方法未对柱温进行要求。考察30、40、50℃时,各杂质之间以及杂质和主峰之间的分离度:柱温为30℃时,虽然各杂质峰分离较好,但柱压较高;柱温为50℃时,杂质A和杂质H峰分离度不能满足要求;柱温为40℃时,柱压和各峰之间的分离度均良好,所以柱温选择40℃。
4 结论
本研究为诺氟沙星葡萄糖注射液提供了一种高效的有关物质测定方法,所建立方法专属性良好,空白辅料均不干扰测定,专属性强、灵敏度高,能有效分离诺氟沙星葡萄糖注射液的主成分及各种降解杂质。测定的方法和结果对有关生产企业加强原料、辅料质量控制、改进工艺并通过稳定性试验考察制定更加合理的贮藏条件和有效期具有较强的指导意义。
