灯盏乙素衍生物的合成及抗白血病活性研究
2021-06-30韩通陈曦张永博李达翃金成浩
韩通,陈曦,张永博,李达翃,金成浩
(1.黑龙江八一农垦大学生命科学技术学院,大庆163319;2.沈阳药科大学中药学院)
灯盏乙素(scutellarin),又名野黄芩苷,是从灯盏细辛中提取分离得到的一种重要的黄酮类天然产物(图1)[1]。现代药理学研究表明,灯盏乙素具有心脑血管保护、抗氧化、抗炎和抗肿瘤等多种药理活性[2]。目前,灯盏乙素已作为药物的主要有效成分广泛应用于心血管疾病的治疗中,如灯盏花素片、注射剂和滴丸等。因此,基于灯盏乙素良好的生物活性,近年来对灯盏乙素的研究越来越广泛。其中,灯盏乙素的抗肿瘤作用是近年来研究较多的热点方向之一。根据文献报道,灯盏乙素可以通过多种途径来发挥抗癌作用。例如,灯盏乙素可以诱导肿瘤细胞凋亡[3-4]、抑制肿瘤转移和侵袭[5-6]、逆转肿瘤细胞的耐药性[7]和增加肿瘤对药物的敏感性等[8-9]。除了具有良好的抗肿瘤活性,灯盏乙素还具有较低的毒性,体外抗细胞增殖实验表明,灯盏乙素可以选择性的靶向肿瘤细胞,而对正常细胞毒性较小[10-11]。动物实验表明灯盏乙素在持续高剂量的给药下对小鼠几乎无毒性[12]。这为以灯盏乙素为先导化合物进一步开发新的高效低毒的抗癌药物提供了良好的基础。
图1 灯盏乙素的化学结构Fig.1 Chemical structure of scutellarin
然而,灯盏乙素的溶解性差、半衰期短和生物利用度低等药代动力学问题,限制灯盏乙素的进一步应用。对灯盏乙素进行结构修饰是改善灯盏乙素药代动力学性质的主要手段之一。科研工作者尝试对灯盏乙素的糖羧基进行酯化获得灯盏乙素酯类前药,如灯盏乙素乙酯、苄酯和不同分子量的聚乙二醇酯等,并研究酯化对灯盏乙素体内代谢的影响,发现酯化后灯盏乙素的水溶性、稳定性和生物利用度有了一定的提高[13-14]。然而,体内酯酶较多,酯键在体内仍极易代谢,相比于酯键,酰胺键的稳定性更高,因此,研究选择多种脂肪胺,合成了灯盏乙素的酰胺衍生物。此外,苄基是黄酮类化合物结构改造一个常用的药效团,如黄芩素的7-OH苄基化后,其衍生物的抗肿瘤活性显著增强[15-16]。为了进一步提高灯盏乙素的抗肿瘤活性,灯盏乙素结构中的4′-OH和6-OH进行苄基取代。综上,研究以天然产物灯盏乙素为先导化合物,通过简单易行的化学合成方法,获得了4个灯盏乙素酰胺类衍生物,并对目标化合物进行抗肿瘤细胞株增殖活性测试。根据数据,对测试结果进行了分析。
1 材料与方法
1.1 药品与试剂
市售灯盏乙素购于南京泽朗生物科技有限公司;溴化苄、1-乙基-3(3-二甲基丙胺)碳二亚胺(EDCI)、1-羟基苯并三唑(HOBt)、丙胺、异丙胺、己胺和环己胺等药品均购于上海阿拉丁生化科技有限公司;碳酸钾,N,N-二甲基甲酰胺(DMF),乙酸乙酯,无水甲醇等试剂均为化学纯或分析纯。醇钠由金属钠和无水甲醇制得。柱色谱分离采用硅胶H或硅胶(200~300目),薄层色谱用硅胶GF254,均采购于青岛海洋化工厂。
1.2 仪器
磁力搅拌器(巩义市予华仪器设备有限公司);旋转蒸发仪(EYELA,东京理化器械株式会社);Bruker-ARX-300型和Bruker-AV-600型(TMS作内标)核磁共振光谱仪;日本岛津GCMS-5050A气质联用仪;Agilent 1100离子阱型液-质联用仪。
1.3 方法
1.3.1 4 ′,6-二苄基-灯盏乙素苄酯(2)的合成
取市售灯盏乙素1(300 mg,0.65 mmol),溶于10 mL DMF,搅拌至完全溶解。加入溴化苄(0.38 mL,3 mmol)和无水碳酸钾(414 mg,3 mmol),室温搅拌24 h,硅胶薄层色谱(TLC)监测反应进程,待反应完成后。将反应液倾入20 mL冰水混合物中,乙酸乙酯萃取(3×30 mL),饱和食盐水溶液洗涤,无水硫酸钠干燥,过滤,滤液浓缩,经硅胶柱色谱分离(二氯甲烷∶甲醇20∶1),得黄色粉末状固体2,该化合物结构经1H-NMR、13C-NMR和HR-MS确证。
1.3.2 4 ′,6-二苄基-灯盏乙素(3)的合成
取化合物2(1 000 mg,1.37 mmol),溶于80 mL甲醇中,搅拌至固体完全溶解,滴加2 mL甲醇钠,室温反应24 h,硅胶薄层色谱(TLC)监测反应进程,待反应完成后。将反应液浓缩,加水调pH至4~5,有大量沉淀析出,抽滤,烘干,得黄色粉末状固体3,该化合物结构经1H-NMR和MS确证。
1.3.3 4 ′,6-二苄基-灯盏乙素丙基酰胺(4a)的合成
将中间体3(100 mg,0.16 mmol),溶于5 mL的DMF中,搅拌至固体完全溶解。加入HOBT(26 mg,0.19 mmol)、EDC(I60 mg,0.32 mmol)和丙胺(20μL,0.16 mmol),于室温反应24 h。硅胶薄层色谱(TLC)监测反应进程,待反应完成后。将反应液倾入30 mL的H2O中,乙酸乙酯萃取(3×20 mL),饱和食盐水溶液洗涤,无水硫酸钠干燥,过滤,滤液浓缩,经硅胶柱色谱分离(二氯甲烷∶甲醇20∶1),得到黄色粉末状固体4a,该化合物结构经1H-NMR、13C-NMR和HRMS确证。
1.3.4 4 ′,6-二苄基-灯盏乙素异丙基酰胺(4b)的合成
化合物4b的合成方法同4a,4′,6-二苄基-灯盏乙素(3)与异丙胺进行缩合,得到黄色粉末状固体4′,6-二苄基-灯盏乙素异丙基酰胺(4b)。该化合物结构经1H-NMR、13C-NMR和HR-MS确证。
1.3.5 4′,6-二苄基-灯盏乙素己基酰胺(4c)的合成
化合物4c的合成方法同4a,4′,6-二苄基-灯盏乙素(3)与己胺进行缩合,得到黄色粉末状固体4',6-二苄基-灯盏乙素己基酰胺(4c)。该化合物结构经1H-NMR、13C-NMR和HR-MS确证。
1.3.6 4 ′,6-二苄基-灯盏乙素环己基酰胺(4d)的合成
化合物4d的合成方法同4a,4′,6-二苄基-灯盏乙素(3)与环己胺进行缩合,得到黄色粉末状固体4′,6-二苄基-灯盏乙素环己基酰胺(4d)。化合物结构经1H-NMR、13C-NMR和HR-MS确证。
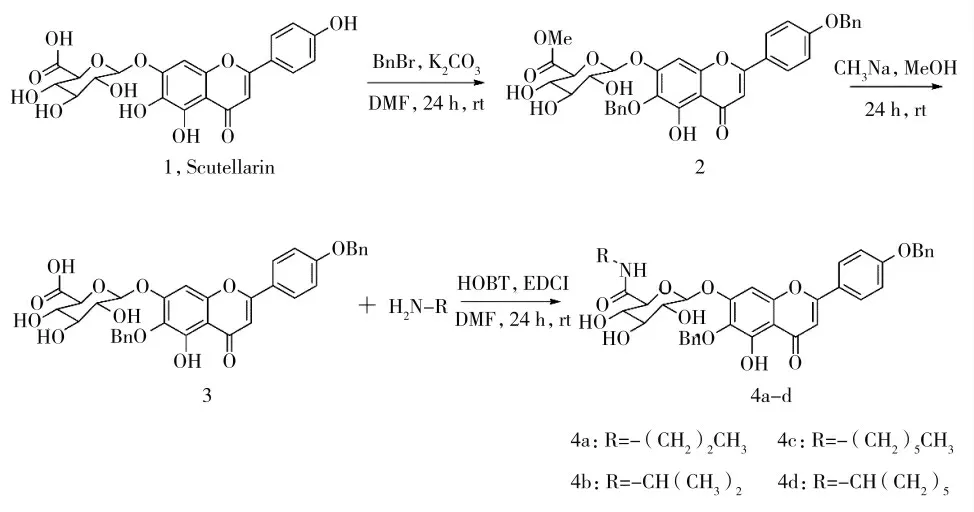
图2 灯盏乙素衍生物的合成路线Fig.2 Synthesis route of scutellarin derivatives
1.3.7 体外抗增殖活性测试
采用台盼蓝法测试目标化合物4a~d的抗肿瘤活性。选取人白血病细胞株HL-60和THP-1在37℃、5%CO2饱和湿度的培养箱中常规培养。培养液为含10%热灭活胎牛血清,青霉素100 U·mL-1和链霉素100 U·mL-1的RPMI1640细胞培养基。48 h更换培养液,细胞贴壁后,用0.25%胰蛋白酶消化传代。实验用细胞均处于对数生长期,台盼蓝拒染法表明细胞活力大于95%。
取对数生长期的受试细胞,以5×104cells·mL-1的密度接种于24孔板内,每孔内2 mL。接种完毕后即加入相应浓度的待测药物。药物处理72 h后,从每孔的细胞悬液中吸取50μL细胞悬液,加入50μL的0.4%台盼蓝溶液中混匀,在3 min内,于光学显微镜下观察,分别计数每孔的细胞总数。每孔中的总细胞数占对照孔总细胞数的百分比即为该浓度药物的生长抑制率。每个细胞及药物至少进行3次独立重复实验。采用SPSS软件对实验结果进行统计学分析,各组数据均采用平均值±SD的方式表示。
2 结果与分析
2.1 灯盏乙素衍生物的结构鉴定
中间体及目标化合物的结构,采用核磁波谱1HNMR和13C-NMR,以及质谱MS进行了鉴定。
中间体2:4′,6-二苄基-灯盏乙素苄酯,产率67%。1H-NMR(DMSO-d6,400 MHz)δ(ppm):12.96(s,1H,5-OH),8.03(d,2H,J=9.0 Hz,H-2′,6′),7.55(d,2H,J=7.0 Hz,Ar-H),7.48(d,2H,J=7.4 Hz,Ar-H),7.36(m,9H,Ar-H),7.25(d,2H,J=7.0 Hz,Ar-H),7.20(d,2H,J=9.0 Hz,H-3′,5′),7.12(s,1H,H-8),6.95(s,1H,H-3),5.66(d,1H,J=5.3 Hz,H-1″),5.57(d,1H,J=5.7 Hz,sugar hydroxyl),5.43(d,1H,J=7.4 Hz,sugar hydroxyl),5.37(d,1H,J=5.3 Hz,sugar hydroxyl),5.24(s,2H,-CH2-),5.17(d,2H,J=11.9 Hz,-CH2-),5.02(d,2H,J=10.9 Hz,-CH2-),4.29(d,1H,J=9.6 Hz,H-5″),3.53-3.40(m,3H,H-2″,3″,4″);MS(ESI)m/z:733.2[M+H]+.
中间体3:4′,6-二苄基-灯盏乙素(3),产率95%。1H-NMR(DMSO-d6,400 MHz)δ(ppm):12.98(s,1H,5-OH),8.05(d,2H,J=8.5 Hz,H-2′,6′),7.56(d,2H,J=7.3 Hz,Ar-H),7.48(d,2H,J=7.3 Hz,Ar-H),7.41(t,2H,J=7.4 Hz,Ar-H),7.37(m,3H,Ar-H),7.32(t,1H,J=7.1 Hz,Ar-H),7.21(d,2H,J=8.7 Hz,H-3′,5′),7.13(s,1H,H-8),6.95(s,1H,H-3),5.67(d,1H,J=4.9 Hz,H-1″),5.40(d,2H,J=7.4 Hz,sugar hydroxyl),5.22(s,2H,-CH2-),5.02(dd,2H,J=10.9 Hz,-CH2-),4.09(d,1H,H-5″),3.48-3.42(m,3H,H-2″,3″,4″);MS(ESI)m/z:643.2[M+H]+.
目标化合物4a:4′,6-二苄基-灯盏乙素丙基酰胺,产率91%。1H-NMR(DMSO-d6,400 MHz)δ(ppm):12.96(s,1H,5-OH),8.08(d,2H,J=9.0 Hz,H-2′,6′),8.01(t,1H,J=5.7 Hz,-NH-),7.57(d,2H,J=6.8 Hz,Ar-H),7.49(d,2H,J=6.9 Hz,Ar-H),7.41(d,2H,J=7.0 Hz,Ar-H),7.35(m,4H,Ar-H),7.21(d,2H,J=9.0 Hz,H-3′,5′),7.07(s,1H,H-8),6.96(s,1H,H-3),5.59(d,1H,J=5.8 Hz,H-1″),5.31(d,1H,J=5.3 Hz,sugar hydroxyl),5.26(d,1H,J=5.0 Hz,sugar hydroxyl),5.21(d,1H,J=7.7 Hz,sugar hydroxyl),5.24(s,2H,-CH2-),5.09(d,1H,J=10.9 Hz,-CH2-),4.98(d,1H,J=10.9 Hz,-CH2-),3.94(d,1H,J=9.6 Hz,H-5″),3.53-3.36(m,3H,H-2″,3″,4″),3.03(m,2H,-CH2-),1.40(m,2H,-CH2-),0.78(t,3H,J=7.2 Hz,-CH3);13C-NMR(DMSO-d6,100 MHz)δ(ppm):182.84,168.14,164.25,162.04,156.77,153.24,152.68,138.02,136.93,131.84,128.98,128.98,128.87,128.87,128.57,128.57,128.52,128.52,128.31,128.31,123.35,115.86,115.86,106.39,103.88,100.59,94.72,76.93,76.32,74.66,73.42,71.21,70.07,22.50,11.67;HR-MS(ESI)m/z calcd for C38H37NO11[M+Na]+706.236 7,found 706.227 9.
目标化合物4b:4′,6-二苄基-灯盏乙素异丙基酰胺,产率49%。1H-NMR(DMSO-d6,400 MHz)δ(ppm):12.94(s,1H,5-OH),8.09(d,2H,J=9.0 Hz,H-2′,6′),7.95(d,1H,J=7.7 Hz,-NH-),7.56(d,2H,J=6.9 Hz,Ar-H),7.48(d,2H,J=7.0 Hz,Ar-H),7.41(t,2H,J=7.4 Hz,Ar-H),7.36(m,3H,Ar-H),7.32(d,1H,J=7.0 Hz,Ar-H),7.20(d,2H,J=9.0 Hz,H-3′,5′),7.09(s,1H,H-8),6.96(s,1H,H-3),5.59(d,1H,J=5.9 Hz,H-1″),5.31(d,1H,J=5.2 Hz,sugar hydroxyl),5.27(d,1H,J=5.1 Hz,sugar hydroxyl),5.17(d,1H,J=7.7 Hz,sugar hydroxyl),5.24(s,2H,-CH2-),5.09(d,1H,J=10.8 Hz,-CH2-),4.98(d,1H,J=10.8 Hz,-CH2-),3.87(d,1H,J=9.4 Hz,H-5″),3.82(m,1H,-CH-),3.58-3.43(m,3H,H-2″,3″,4″),1.07(d,3H,J=6.6 Hz,-CH3),1.02(d,3H,J=6.5 Hz,-CH3);13C-NMR(DMSO-d6,100 MHz)δ (ppm):182.84,167.01,164.20,162.05,156.77,153.22,152.64,138.00,136.92,131.86,128.97,128.97,128.88,128.88,128.57,128.57,128.51,128.51,128.32,128.32,123.33,115.83,115.83,106.41,103.83,100.88,94.90,77.01,76.51,74.66,73.47,70.94,70.08,22.74,22.63;HR-MS(ESI)m/z calcd for C38H37NO11[M+Na]+706.236 7,found 706.226 9.
目标化合物4c:4′,6-二苄基-灯盏乙素己基酰胺,产率49%。1H-NMR(DMSO-d6,400 MHz)δ(ppm):12.95(s,1H,5-OH),8.10(d,2H,J=8.9 Hz,H-2′,6′),8.00(t,1H,J=5.3 Hz,-NH-),7.56(d,2H,J=6.9 Hz,Ar-H),7.49(d,2H,J=7.1 Hz,Ar-H),7.42(t,2H,J=7.6 Hz,Ar-H),7.36(m,3H,Ar-H),7.32(d,1H,J=7.2 Hz,Ar-H),7.21(d,2H,J=9.0 Hz,H-3′,5′),7.07(s,1H,H-8),6.98(s,1H,H-3),5.60(brs,1H,H-1″),5.20(d,1H,J=7.8 Hz,sugar hydroxyl),5.24(s,2H,-CH2-),5.09(d,1H,J=10.8 Hz,-CH2-),4.98(d,1H,J=10.8 Hz,-CH2-),3.92(d,1H,J=9.6 Hz,H-5″),3.54-3.43(m,4H,H-2″,3″,4″),3.06(m,2H,-CH2-),1.35(m,2H,-CH2-),1.15(m,2H,-CH2-),1.04(m,4H,-CH2-),0.65(t,3H,J=6.9 Hz,-CH3);13C-NMR(DMSO-d6,100 MHz)δ (ppm):182.85,166.71,164.24,162.05,156.72,153.27,152.73,138.00,136.19,131.84,131.21,130.77,128.98,128.98,128.88,128.88,128.58,128.58,128.52,128.52,128.31,128.31,123.33,115.87,115.87,106.44,103.89,100.58,94.70,76.99,76.44,74.69,73.42,70.96,70.07,47.33,25.48,19.66,18.05,16.48,6.93;HR-MS(ESI)m/z calcd for C41H41NO11[M+Na]+746.268 0,found 746.257 8.
目标化合物4d:4′,6-二苄基-灯盏乙素环己基酰胺,产率39%。1H-NMR(DMSO-d6,400 MHz)δ(ppm):12.94(s,1H,5-OH),8.10(d,2H,J=8.9 Hz,H-2′,6′),7.94(d,1H,J=8.1 Hz,-NH-),7.56(d,2H,J=6.9 Hz,Ar-H),7.48(d,2H,J=7.0 Hz,Ar-H),7.41(t,3H,J=7.8 Hz,Ar-H),7.36(d,2H,J=7.7 Hz,Ar-H),7.32(d,1H,J=7.1 Hz,Ar-H),7.19(d,2H,J=9.0 Hz,H-3′,5′),7.11(s,1H,H-8),6.97(s,1H,H-3),5.59(brs,1H,H-1″),5.28(m,4H,-CH2,sugar hydroxyl),5.14(d,1H,J=7.8 Hz,sugar hydroxyl),5.09(d,1H,J=10.9 Hz,-CH2-),4.98(d,1H,J=10.9 Hz,-CH2-),3.90(d,1H,J=9.7 Hz,H-5″),3.57-3.43(m,4H,H-2″,3″,4″),1.58(m,6H,-CH2-),1.19(m,4H,-CH2-);13C-NMR(DMSO-d6,100 MHz)δ(ppm):182.85,166.88,164.20,162.04,156.73,153.18,152.66,138.00,136.93,131.84,128.99,128.99,128.87,128.87,128.57,128.57,128.51,128.51,128.32,128.32,123.36,115.81,115.81,106.40,103.84,100.88,94.97,76.11,76.37,74.66,73.50,70.74,70.06,47.70,32.54,32.49,25.62,24.65,24.56;HR-MS(ESI)m/z calcd for C41H41NO11[M+Na]+746.268 0,found 746.259 8.
目标化合物的结构解析以4a为例,在1H-NMR谱数据中,存在明显的灯盏乙素结构中B环上4个氢信号,以AA XX的系统形式存在;在δ7.57~7.35附近存在10个芳香氢信号,判断为两个苄基中苯环氢信号;在δ5.24处存在二氢单峰以及δ5.09和4.98处存在两个一氢双峰,判断为4和6取代苄基上的亚甲基氢信号;δ3.03处表现为二氢多重峰,归属为丙基中与氮相连的亚甲基;δ1.40处表现为二氢多重峰,归属为丙基中的亚甲基;δ0.78处表现为三氢三重峰,归属为丙基中与亚甲基相连的甲基氢信号。另外,在13C-NMR谱数据中出现24个芳香碳信号以及两个羰基碳信号,判断为灯盏乙素结构中的芳香碳、4位羰基和糖上的羰基信号以及两个苄基上的芳香碳信号;在高场区出现丙基的碳信号。高分辨质谱HR-MS(ESI)m/z calcd for C38H37NO11[M+Na]+706.236 7,found 706.227 9。综上,确认化合物为所设计合成的目标化合物4a。
2.2 生物活性测试
对所合成的灯盏乙素衍生物4a~d进行抗白血病活性测试,选取人白血病细胞株HL-60和THP-1,采用台盼蓝染色法进行测试,测试结果见表1。从表中的数据可以看出,所有化合物对两株肿瘤细胞株均表现出一定的抑制作用。4a~d对THP-1细胞株的抗增殖活性强于HL-60,表现出明显的肿瘤细胞选择性,并且对THP-1的抗肿瘤作用强于先导化合物灯盏乙素,表明苄基取代可以提升灯盏乙素对THP-1细胞株的抑制作用。其中,化合物4d对THP-1的作用最强,其IC50值为16.77μmmol·mL-1。

表1 灯盏乙素衍生物的体外抗白血病细胞株增殖活性Table 1 Anti-proliferation activity of scutellarin derivatives against leukemic cell lines in vitro
3 讨论
当前,恶性肿瘤依然是在世界范围内威胁人类健康的最主要疾病之一。在中国,癌症俨然已经成为一个重大的公共卫生问题,其致死率仅次于心脑血管疾病高居第二位[17]。随着科技发展和生活水平的不断提高,癌症的预防、诊断和治疗能力不断提高,化疗方法依然在癌症的治疗过程中占据重要地位,但化疗药物发挥药效的同时,伴随着较多的毒副作用,因此,开发新型的抗肿瘤药物仍然是迫在眉睫的问题。
从天然产物中寻找新型的抗肿瘤药物一直是研究的热点之一[18-19]。黄酮类化合物是一类极有研究价值的天然次生代谢产物,其广泛分布于自然界植物中,具有结构多样、活性优良和含量较高等诸多优点。因此,黄酮类化合物一直是研究人员热衷的研究对象。依靠丰富的自然资源,黄酮类化合物的研究开发极为迅速,在过去的20年里,提取,鉴定的黄酮类新化合物多达几千余个[20-25]。这些丰富多样的结构为药物发现提供了先导化合物来源,也为新药研发及药物设计提供了灵感。已有多种黄酮类药物进入临床应用,如醋柳黄酮、依普黄酮和黄酮哌酯等。此外,汉黄芩素作为抗癌新药,也已进入临床研究。因此,开发黄酮类抗癌药物成为近年来的研究热点[26]。灯盏乙素是一种极具药用价值的黄酮类化合物,其抗癌能力近年来研究较多,众多药理学实验证实灯盏乙素对于肿瘤的发生和发展起到重要的抑制作用。灯盏乙素对血液瘤和实体瘤都具有较强的抑制作用,已有文献报道,灯盏乙素可以抑制多种白血病细胞株如HL-60、THP-1、CHRF、H9、NB4、U937、K562和Ju rkat的增殖,其半数抑制浓度(IC50)从35μmmol·mL-1到165μmmol·mL-1不等,并呈现明显的浓度依赖性[2,27]。因此,可以证实灯盏乙素对血液瘤细胞具有广谱性且抗肿瘤活性良好。
截至目前,针对灯盏乙素抗肿瘤活性的结构改造研究较少,并由于其药代性质差的问题,使其很难进行深入的体内抗肿瘤活性研究。为了进一步扩展灯盏乙素的抗肿瘤功能,探索其体内抗肿瘤效果。基于前期的文献调研,研究合成了灯盏乙素的酰胺类衍生物,期望在改善药代性质的同时,进一步增强其抗肿瘤活性,获得4个目标化合物4a~d。选取对灯盏乙素较为敏感的白血病细胞株HL-60(人早幼粒白血病细胞)和THP-1(人急性单核白血病细胞),采用台盼蓝染色法,进行了体外抗增殖活性测试。测试结果显示,衍生物对两株细胞都具有抑制作用,但比较衍生物对两株细胞的IC50值,可以发现化合物4a~d具有肿瘤细胞选择性,对THP-1细胞株的抑制活性更强。尤其以环己基酰胺化合物4d的IC50值最小,为灯盏乙素的三分之一。从测试结果可以分析出,此类化合物的构效关系如下:(1)随着脂肪胺碳链的增加,抗肿瘤增殖活性逐步降低;(2)4′位和6位苄基取代后,对THP-1的抑制活性增加;(3)脂肪环酰胺衍生物对THP-1的抗肿瘤活性强于直连脂肪酰胺。后续,我们将会对灯盏乙素酰胺类衍生物进行正常细胞毒性实验测试,评价酰胺类衍生物的选择性,择优进行抗肿瘤机制研究。
4 结论
以灯盏乙素为先导化合物,基于其良好的抗肿瘤活性和低毒性,对其开展药物化学研究。通过三步化学反应,对灯盏乙素的4′,6位羟基进行苄基化,水解裸露糖羧基,并在糖羧基位置通过与多种胺缩合,获得灯盏乙素酰胺衍生物。采用台盼蓝染色法测试目标化合物4a~d的抗白血病细胞株HL-60和THP-1增殖活性。活性测试数据表明,化合物4d对THP-1细胞具有较强的抗增殖能力,IC50值为16.77μmmol·mL-1,明显强于先导化合物灯盏乙素,值得进行更为深入的药理作用机制研究,为灯盏乙素的抗肿瘤功能开发提供理论依据。
